2. 海军军医大学(第二军医大学)东方肝胆外科医院肝胆二科, 上海 200438;
3. 上海中医药大学附属龙华医院肿瘤科, 上海 200032
2. Department of Hepatobiliary (Ⅱ), Eastern Hepatobiliary Surgery Hospital, Naval Medical University (Second Military Medical University), Shanghai 200438, China;
3. Department of Oncology, Longhua Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China
肝门部胆管癌是胆道系统常见的恶性肿瘤,发生率逐年升高,约占胆管癌的2/3,且多数患者确诊晚、预后差[1],因此一直是临床上疾病治疗的难题之一。尽管手术切除对肝门部胆管癌患者生存率有所改善,但患者5年生存率仍不高,中位生存期仅为1 ~ 2年[1-2]。早期诊断有助于提高肝门部胆管癌患者的生存率。近年来,随着对分子生物学研究及应用的不断深入,不少生物学分子已成为肿瘤诊断和预后的标志物[3-4]。研究发现醛酮还原酶家族(aldo-keto reductase,AKR)成员醛酮还原酶1-A1(aldo-keto reductase 1-A1,AKR1A1)参与了肺癌[5]、乳腺癌[6]和肝癌[7]等的代谢过程,与肿瘤发生、发展有关,但其在肝门部胆管癌中的作用罕见报道。本研究拟探讨人肝门部胆管癌中AKR1A1的表达及其临床意义。
1 资料和方法 1.1 研究资料收集2003年至2013年于温州医科大学附属第一医院和海军军医大学(第二军医大学)东方肝胆外科医院接受肝门部胆管癌手术切除治疗的49例患者的临床资料、肝门部胆管癌组织标本和相应的癌旁非肿瘤组织标本(距离癌组织边缘至少2 cm)。49例患者中,男35例、女14例,中位年龄为55(31~79)岁。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)肝门部胆管癌TNM分期(第8版)分级标准[8]行病理分期。所有患者均有完整的随访资料。
1.2 免疫组织化学染色49对癌组织和癌旁组织标本均用10%甲醛溶液固定,常规石蜡包埋,行4 μm厚连续切片。石蜡切片放入60 ℃烤箱烤1 h后,转至室温下常规二甲苯10 min×3次脱蜡,经无水乙醇10 min、95%乙醇5 min、88%乙醇5 min、75%乙醇5 min、流水5 min梯度脱水。行柠檬酸盐缓冲液高压修复,3%过氧化氢溶液去除内源性过氧化物酶。山羊血清室温封闭10 min后用1 : 200比例稀释的一抗(兔抗人AKR1A1单克隆抗体,货号sc374204,美国Santa Cruz公司)标记,4 ℃保存过夜。磷酸盐缓冲液洗3 min×3次,用生物素标记的二抗室温孵育10 min,再经磷酸盐缓冲液洗3 min×3次,加链霉素抗生素-过氧化物酶溶液室温孵育10 min,磷酸盐缓冲液洗脱后经二氨基联苯胺(diaminobenzidine,DAB)显色。流水5 min后浸苏木精中复染1 min,清水冲洗后磷酸盐缓冲液返蓝,于显微镜下观察。
1.3 结果判定AKR1A1阳性着色呈现褐色或深棕色,主要位于细胞核。评判采用二级计分法[4]:按照阳性细胞染色强度,无着色记0分,淡黄色记1分,棕黄色记2分,深褐色记3分;按阳性细胞占总计数细胞的百分比,≤5%记0分,6%~25%记1分,26%~50%记2分,51%~75%记3分,≥76%记4分。每张切片的染色强度与阳性细胞占总计数细胞百分比得分的乘积<1为低表达,≥1为高表达。
1.4 统计学处理应用SPSS 19.0软件进行统计学分析。计数资料以例数和百分数表示,组间比较采用χ2检验。肿瘤患者生存期分析采用Kaplan-Meier生存分析,预后影响因素分析采用多因素回归分析。检验水准(α)为0.05。
2 结果 2.1 AKR1A1在肝门部胆管癌和癌旁组织中的表达AKR1A1染色主要位于肝门部胆管癌细胞胞核内,呈棕褐色。49例肝门部胆管癌组织中,AKR1A1高表达率为59.2%(29/49),癌旁组织中高表达率为25.0%(3/12),二者差异有统计学意义(P=0.044)。见图 1。
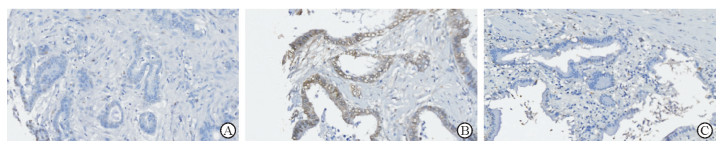
|
图 1 AKR1A1在肝门部胆管癌和癌旁组织中的表达 A: AKR1A1在癌旁组织中的表达; B: AKR1A1在肝门部胆管癌组织中高表达; C: AKR1A1在肝门部胆管癌组织中低表达. AKR1A1:醛酮还原酶1-A1.免疫组织化学染色. Original magnification: ×100 |
2.2 AKR1A1表达与肝门部胆管癌患者临床病理特征的关系
AKR1A1在肝门部胆管癌组织中的表达与患者年龄、性别及肿瘤的神经侵犯、浸润深度、TNM分期均无明显关联(P均>0.05),而与肿瘤大小和淋巴结转移有关(P=0.028、P=0.001)。见表 1。
|
|
表 1 AKR1A1表达与肝门部胆管癌患者临床病理特征的关系 |
2.3 AKR1A1表达与肝门部胆管癌患者预后的关系
Kaplan-Meier生存分析显示,AKR1A1高表达患者的总生存期中位数为15个月,短于低表达者(中位数39个月),差异有统计学意义(P=0.012),且AKR1A1高表达患者的无进展生存期(中位数15个月)也短于低表达者(中位数32个月),差异有统计学意义(P=0.022)。
2.4 预后影响因素的多因素分析对肝门部胆管癌患者总生存期和无进展生存期的影响因素进行多因素分析,结果显示肿瘤浸润深度是肝门部胆管癌患者总生存期和无进展生存期的独立预测因素(P均<0.05,表 2)。
|
|
表 2 肝门部胆管癌患者总生存期和无进展生存期影响因素的多因素分析 |
3 讨论
AKR主要通过以还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)作为其辅酶参与氧化还原反应。作为AKR成员之一,AKR1A1是醛还原酶,定位于人类染色体1p33→p32[9],参与催化体内醛类化合物代谢过程,具有重要的生物学作用。研究证明AKR1A1参与不同肿瘤的生物代谢过程,例如AKR1A1参与丙酮醛和3-脱氧葡糖醛酮解毒作用,介导大鼠肝脏中糖基化反应过程二羰基化合物的产生[9],而体内醛水平增高与肿瘤发生有关;AKR1A1是有效的突变诱变剂,能激活多环芳香烃,参与肺癌氧化还原循环中G→T颠换突变的发生[5];AKR1A1在星形胶质细胞瘤中起到抗氧化应激作用[10]。已有研究证明,AKR1A1在多种肿瘤内稳定表达[11],但因不同肿瘤的发生机制不同其表达水平也有差异,在肝癌、肺癌和乳腺癌中高表达,但与脑胶质细胞瘤发生关联不大[5-7, 12-13]。在乳腺癌相关研究中发现,治疗后肿瘤组织的AKR1A1表达水平高于正常组织,推测AKR1A1可能在化学治疗中具有预后预测价值[13]。以上证据均表明,AKR1A1与肿瘤发生及预后存在一定关系,但AKR1A1与肝门部胆管癌的研究少见。
本研究采用免疫组织化学染色法检测肝门部胆管癌及其癌旁组织中的AKR1A1表达情况,结果显示AKR1A1在肝门部胆管癌中的表达率(59.2%,29/49)远高于癌旁正常组织(25.0%,3/12),差异有统计学意义(P<0.05),且AKR1A1表达与肿瘤大小和淋巴结转移有关,肿瘤较大、有淋巴结转移提示肝门部胆管癌恶性程度较高,AKR1A表达水平也较高。上述结果提示AKR1A1可能是肝门部胆管癌的促癌基因,参与了肝门部胆管癌的进展和转移。本研究还发现,AKR1A1 高表达的肝门部胆管癌患者总生存期和无进展生存期均短于AKR1A1低表达者的生存期(中位数15个月vs 39个月,中位数15个月vs 32个月),表明AKR1A1高表达的肝门部胆管癌患者预后较差。据此,我们推测AKR1A1可能是肝门部胆管癌预后的一个分子标志物。单因素生存分析中,AKR1A1表达与肝门部胆管癌患者预后有关,但多因素分析仅显示肿瘤浸润深度是肝门部胆管癌患者的独立预后因素,可能与本研究样本量小有关,后续研究将加大样本量进一步评估AKR1A1预测胆管癌复发和预后的价值。
目前,手术治疗仍是肝门部胆管癌的主要治疗手段,手术治疗的5年生存率为45%,排除晚期肿瘤(ⅢB期或更高)后可升高至为65%[14-15],因此早期发现、早期治疗对于提高肝门部胆管癌患者的生存率及改善预后均有重要意义。然而临床上肝门部胆管癌大多诊断难、发现晚,尚缺乏有效的生物学分子标志物。本研究提示AKR1A1高表达的肝门部胆管癌患者预后较差。此外,有研究证明肝门部胆管癌患者术后配合放射和(或)化学治疗能令患者临床获益[16]。通过AKR1A1的临床应用及靶向治疗可能有助于肝门部胆管癌患者预后的有效评估和早期干预。
综上所述,AKR1A1在肝门部胆管癌中的表达与肿瘤大小和淋巴结浸润有关,且与肿瘤术后预后相关,其可能在肝门部胆管癌发生、发展中有重要作用,并有望成为肝门部胆管癌患者复发和预后预测标志物。
| [1] |
DARWISH MURAD S, KIM W R, THERNEAU T, GORES G J, ROSEN C B, MARTENSON J A, et al. Predictors of pretransplant dropout and posttransplant recurrence in patients with perihilar cholangiocarcinoma[J]. Hepatology, 2012, 56: 972-981. DOI:10.1002/hep.25629 |
| [2] |
HAMEED A, PANG T, CHIOU J, PLEASS H, LAM V, HOLLANDS M, et al. Percutaneous vs. endoscopic pre-operative biliary drainage in hilar cholangiocarcinoma-a systematic review and meta-analysis[J]. HPB (Oxford), 2016, 18: 400-410. DOI:10.1016/j.hpb.2016.03.002 |
| [3] |
朱童, 胡学谦, 汪妍, 于观贞, 王杰军. Latexin在胃癌组织中的表达及临床意义[J]. 临床肿瘤学杂志, 2015, 20: 1006-1009. |
| [4] |
吴成利, 王咏梅, 王革芳, 于观贞, 王杰军. 乙醛脱氢酶1A1在胃癌组织中的表达及其临床意义[J]. 临床肿瘤学杂志, 2014, 19: 992-995. |
| [5] |
PENNING T M. Human aldo-keto reductases and the metabolic activation of polycyclic aromatic hydrocarbons[J]. Chem Res Toxicol, 2014, 27: 1901-1917. DOI:10.1021/tx500298n |
| [6] |
HOFMAN J, SKARKA A, HAVRANKOVA J, WSOL V. Pharmacokinetic interactions of breast cancer chemotherapeutics with human doxorubicin reductases[J]. Biochem Pharmacol, 2015, 96: 168-178. DOI:10.1016/j.bcp.2015.05.005 |
| [7] |
ALZEER S, ELLIS E M. Metabolism of gamma hydroxybutyrate in human hepatoma HepG2 cells by the aldo-keto reductase AKR1A1[J]. Biochem Pharmacol, 2014, 92: 499-505. DOI:10.1016/j.bcp.2014.09.004 |
| [8] |
毛谅, 陈骏, 孙士全, 王可欣, 仇毓东. 美国癌症联合委员会肝门部胆管癌分期系统(第8版)更新解读[J]. 中国实用外科杂志, 2017, 37: 510-513. |
| [9] |
FUJII J, HAMAOKA R, MATSUMOTO A, FUJII T, YAMAGUCHI Y, EGASHIRA M, et al. The structural organization of the human aldehyde reductase gene, AKR1A1, and mapping to chromosome 1p33→p32[J]. Cytogenet Cell Genet, 1999, 84(3/4): 230-232. |
| [10] |
李丹, 张岐山, 周立娜, 刘融. 敲减AKR1A1基因对H2O2及4-羟基壬烯醛诱导的1321N1脑星形细胞瘤细胞损伤的影响[J]. 细胞与分子免疫学杂志, 2013, 29: 273-276. |
| [11] |
ZHANG S, WEN B, ZHOU B, YANG L, CHA C, XU S, et al. Quantitative analysis of the human AKR family members in cancer cell lines using the mTRAQ/MRM approach[J]. J Proteome Res, 2013, 12: 2022-2033. DOI:10.1021/pr301153z |
| [12] |
ALZEER S, ELLIS E M. The role of aldehyde reductase AKR1A1 in the metabolism of γ-hydroxybutyrate in 1321N1 human astrocytoma cells[J]. Chem Biol Interact, 2011, 191(1/2/3): 303-307. DOI:10.1016/j.cbi.2011.01.018 |
| [13] |
HLAVÁČ V, BRYNYCHOVÁ V, VÁCLAVÍKOVÁ R, EHRLICHOVÁ M, VRÁNA D, PECHA V, et al. The role of cytochromes p450 and aldo-keto reductases in prognosis of breast carcinoma patients[J/OL]. Medicine (Baltimore), 2014, 93: e255. doi: 10.1097/MD.0000000000000255.
|
| [14] |
KOIZUMI N, NAKASE Y, KOBAYASHI H, TAKAGI T, FUKUMOTO K. [A case of peritoneal dissemination of hilar cholangiocarcinoma presenting with hematuria six years after radical surgery][J]. Gan To Kagaku Ryoho, 2016, 43: 2407-2409. |
| [15] |
MOLINA V, SAMPSON J, FERRER J, DíAZ A, AYUSO J R, SÁNCHEZ-CABúS S, et al. Surgical treatment of perihilar cholangiocarcinoma: early results of en bloc portal vein resection[J]. Langenbecks Arch Surg, 2017, 402: 95-104. DOI:10.1007/s00423-016-1542-9 |
| [16] |
KIM Y S, OH S Y, GO S I, KANG J H, PARK I, SONG H N, et al. The role of adjuvant therapy after R0 resection for patients with intrahepatic and perihilar cholangiocarcinomas[J]. Cancer Chemother Pharmacol, 2017, 79: 99-106. DOI:10.1007/s00280-016-3206-4 |
 2019, Vol. 40
2019, Vol. 40


