2. 海军军医大学(第二军医大学)长海医院肛肠外科, 上海 200433
2. Department of Colorectal Surgery, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China
卵巢癌是我国发病率第三、死亡率最高的妇科恶性肿瘤,严重威胁着女性生命健康[1-2]。手术联合化学治疗、放射治疗、分子靶向治疗、免疫治疗是目前卵巢癌的主要治疗手段[3]。但是,超过四分之三的卵巢癌患者确诊时已发展至晚期,其治疗效果往往不甚理想,患者5年生存率仅为30%[4]。卵巢癌的发生、发展、转归是一个受多因素、多分子影响和调控的过程,其内在的精细调控机制十分复杂,其中体细胞突变发挥着至关重要的作用[5-8]。找出原发性卵巢癌与转移性卵巢癌关键的体细胞突变基因群,分析发挥作用的功能和信号通路,对于探索卵巢癌转移机制具有重要的意义,并可能为寻找卵巢癌转移的诊治靶标提供参考和线索。
本研究拟利用来自癌症体细胞突变目录(catalogue of somatic mutations in cancer,COSMIC)公共数据库的全外显子测序数据,筛选原发性卵巢癌组织和转移性卵巢癌组织之间突变率差异具有统计学意义的体细胞突变基因群,并进行基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,确定其发挥作用的潜在功能和通路。
1 资料和方法 1.1 下载并预处理公共数据库卵巢癌全外显子测序数据从COSMIC数据库(https://cancer.sanger.ac.uk/cosmic/)下载其收录的COSMIC Mutation Data,从中抽提卵巢癌全外显子测序数据。通过下载数据库公开发布的COSMIC Sample Features文件(详细记录全外显子测序样本的临床病理等基本信息),查找并整理原发性卵巢癌和转移性卵巢癌两种类型样本的基本信息,并利用样本ID进一步从COSMIC Mutation Data中提取两类样本的体细胞基因突变数据。
1.2 归纳、整理、统计卵巢癌的基因位点突变率对COSMIC数据库收录的含有全外显子测序数据的卵巢癌组织样本的体细胞基因突变位点信息进行归纳、整理、统计,统计每个突变位点的COSMIC ID、突变形式、突变基因、突变数量、突变频率。
1.3 挖掘原发性卵巢癌和转移性卵巢癌差异分布的突变基因归纳、整理、统计COSMIC数据库中全外显子测序数据记录的12 380个基因突变情况,分别统计每个基因在原发性卵巢癌和转移性卵巢癌类样本中的基因突变情况。对12 380个基因突变在两类样本中的突变率行χ2检验或Fisher确切概率法分析,判断其差异是否具有统计学意义。
1.4 挖掘原发性卵巢癌和转移性卵巢癌差异分布的突变基因位点归纳、整理、统计COSMIC数据库中全外显子测序数据记录的30 052个基因突变位点情况,分别统计每个基因突变位点在原发性卵巢癌和转移性卵巢癌两类样本中的突变情况。对30 052个基因突变位点在两类样本中的突变率行χ2检验或Fisher确切概率法分析,判断其差异是否具有统计学意义,并对基因突变位点突变率的统计学差异情况在Manhattan图中可视化。
1.5 原发性卵巢癌和转移性卵巢癌差异分布突变基因群GO功能、KEGG通路富集分析在R 3.5.3环境下,加载Cluster Profiler包,对原发性卵巢癌和转移性卵巢癌两类样本差异分布突变基因群进行GO功能和KEGG通路富集分析,富集差异P<0.05的GO功能或KEGG通路被认为具有统计学意义。
2 结果 2.1 组织样本的一般情况共有902个卵巢癌组织样本纳入研究,均含有全外显子测序数据。其中原发性卵巢癌组织样本561个、转移性卵巢癌组织样本17个、局部复发卵巢癌组织样本4个、未知类型卵巢癌组织样本320个。转移性卵巢癌组织样本转移部位分别为网膜7个、腹膜6个、腹水3个,信息缺失1个。
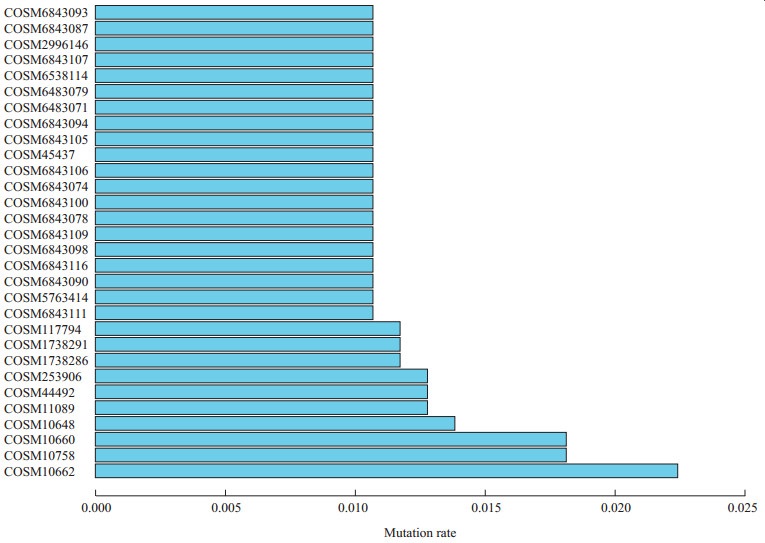
2.2 卵巢癌基因位点突变率一般情况共发现692 684个基因突变位点,其中突变率前10的基因位点为COSM10662、COSM10758、COSM10660、COSM10648、COSM11089、COSM44492、COSM253906、COSM1738286、COSM1738291、COSM117794(表 1),突变率前30位的基因位点如图 1所示。
|
|
表 1 突变率前10的基因位点 Tab 1 Top 10 gene loci of mutation rate |
|
图 1 突变率前30位的基因位点 Fig 1 Top 30 gene loci of mutation rate |
2.3 原发性卵巢癌和转移性卵巢癌突变率差异基因群
共发现520个基因在原发性卵巢癌和转移性卵巢癌组织中突变率差异具有统计学意义(P均<0.05),分别为跨膜丝氨酸蛋白酶13(transmembrane protease serine 13,TMPRSS13)、高尔基蛋白转运抑制剂A抗性因子1(Golgi brefeldin A resistance factor 1,GBF1)、Fos样抗体2(Fos-like antigen 2,FOSL2)、主导控制样蛋白3(mastermind-like 3,MAML3)、角蛋白8(keratin 8,KRT8)、闭眼同源基因(eyes shut ortholog,EYS)、神经元突触膜结合蛋白2(RIM-binding protein 2,RIMBP2)等。其中两类组织前10个差异突变基因见表 2。
|
|
表 2 原发性卵巢癌和转移性卵巢癌前10个差异突变基因 Tab 2 Top 10 differentially mutated genes between primary ovarian cancer and metastatic ovarian cancer |
2.4 原发性卵巢癌和转移性卵巢癌突变率差异基因位点
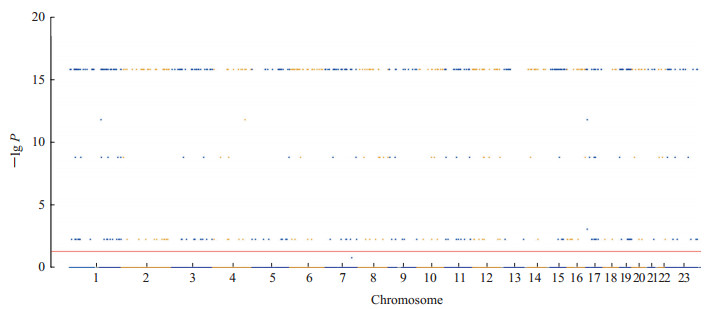
共发现635个基因突变位点在原发性卵巢癌和转移性卵巢癌组织中突变率差异具有统计学意义(P均<0.05),分别为TMPRSS13|COSM253906|c.248_262del15、MAML3|COSM5975003|c.1508_1509insACA、ZNF669|COSM5415797|c.1310A>C、TMPRSS13|COSM1746060|c.233A>G、TMPRSS13|COSM1604153|c.230C>G、ARF6|COSM6843623|c.425C>A、SRPK2|COSM6843093|c.1023C>G、ARMC10|COSM6842546|c.750C>T等。两类组织前10个差异突变基因位点见表 3。图 2显示了全部差异基因突变位点的染色体位置及基因突变率差异P值。
|
|
表 3 原发性卵巢癌和转移性卵巢癌前10个差异突变基因位点 Tab 3 Top 10 differentially mutated gene loci between primary ovarian cancer and metastatic ovarian cancer |
|
图 2 差异基因突变位点的Manhattan图 Fig 2 Manhattan map of differential gene mutation loci The red line represents P value equals 0.05 |
2.5 GO功能和KEGG通路富集结果
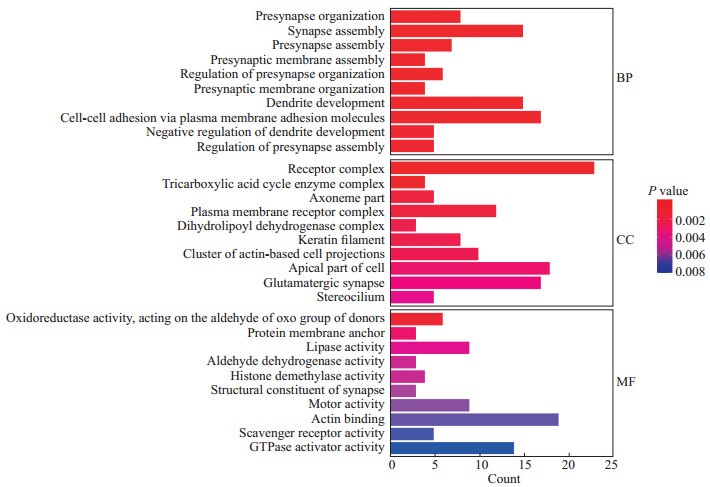
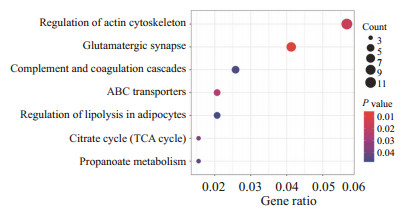
为了进一步探索突变率差异基因群在卵巢癌中可能参与的生物学功能和信号通路,我们对其进行了GO功能和KEGG通路富集分析,结果发现这些突变率差异基因群在突触前组织、对突触前组织的监管、树突发育、通过质膜黏附分子的细胞黏附、质膜受体复合物、中间丝细胞骨架、角蛋白丝、基于肌动蛋白的细胞投射簇、蛋白质膜锚、组蛋白去甲基化酶活性、肌动蛋白结合等功能的富集差异具有统计学意义(P均<0.05),见图 3。KEGG通路富集结果显示,突变率差异基因群在下列通路中有显著富集,如肌动蛋白细胞骨架的调节、谷氨酸能突触、三磷酸腺苷结合盒(adenosine triphosphate-binding cassette,ABC)运载体、三羧酸(tricarboxylic acid,TCA)循环等,见图 4。
|
图 3 GO功能富集结果 Fig 3 Results of GO functional enrichment GO: Gene ontology; BP: Biological process; CC: Cellular component; MF: Molecular function; GTPase: Guanosine triphosphatase |
|
图 4 KEGG通路富集结果 Fig 4 Enrichment results of KEGG pathway KEGG: Kyoto encyclopedia of genes and genomes; ABC: Adenosine triphosphate-binding cassette; TCA: Tricarboxylic acid |
3 讨论
我国是卵巢癌的高发地区之一,每年至少有5万名女性确诊为卵巢癌且至少有2万名女性死于卵巢癌[9]。由于卵巢癌发病的隐匿性,大部分卵巢癌患者确诊时已为晚期,但目前尚难以对卵巢癌采取有效的早期预测和诊断措施,导致其病死率居高不下,成为妇科工作者面临的一大难题[10]。目前有观点认为,恶性肿瘤的发生、发展遵循着大自然普适的规律即“突变-选择-适应”,大量的体细胞突变基因经历选择、适应最终成为恶性肿瘤的驱动基因,促进恶性肿瘤的发生、发展[11]。已有肿瘤科研工作者发现体细胞突变基因对恶性肿瘤生物学行为的改变尤其是侵袭性方面有着很大的驱动作用[12-14]。因此,深入探索原发性卵巢癌与转移性卵巢癌的突变率差异基因群对于整体了解卵巢癌转移状态下的驱动基因群和信号通路的动态变化具有十分重要的意义。
大量研究证实基因突变在卵巢癌的侵袭转移中发挥作用。Hu等[12]发现TP53突变可以通过调节脂质代谢促进卵巢癌向网膜转移;Ren等[13]也有类似发现,他们发现TP53突变可以通过调节肿瘤分化、转移和对类固醇激素的反应来促进上皮性卵巢癌的进展;还有研究者甚至发现乳腺癌易感基因1/2(breast cancer susceptibility gene 1/2,BRCA1/2)突变状态直接影响卵巢癌是否发生脑转移[15-16];一些肿瘤科研人员通过实验证明转移性浆液性上皮性卵巢癌可能与视网膜母细胞瘤(retinoblastoma,RB)基因、p53和BRCA1或BRCA2的干扰协同诱导密切相关[17]。然而这些研究也仅仅是从单个或几个基因层面研究基因突变与卵巢癌转移的内在生物学联系,从整体层面、基因群层面把控基因突变和卵巢癌转移的研究尚待开展。
本研究借助目前关于癌症体细胞突变最大的公共数据库COSMIC数据库,通过大数据挖掘筛选原发性卵巢癌和转移性卵巢癌之间突变率差异有统计学意义的基因群,前10个差异突变基因为TMPRSS13、GBF1、FOSL2、MAML3、KRT8、EYS、RIMBP2、VPS13B、ZNF669、MUC12。经查阅文献,部分基因在卵巢癌生物学行为中的作用已经被研究,如Li等[18]发现lncRNA-UCA1通过调节miRNA-143/FOSL2信号通路介导卵巢癌细胞对顺铂的抵抗。有意思的是有研究者已经发现FOSL2在结肠癌转移中发挥促进作用[19]。本研究发现FOSL2在转移性卵巢癌中的突变率高于原发性卵巢癌,基于前人的研究,FOSL2是否在卵巢癌转移中发挥促进作用十分值得研究。Onishi等[20]通过实验证实靶向沉默重组信号结合蛋白Jκ(recombination signal binding protein for immunoglobulin-κ-J region,RBPJ)、MAML3后,非小细胞肺癌的增殖侵袭活性明显降低,并且更为重要的是已经有研究者发现MAML3在恶性肿瘤转移中扮演着重要角色,如Li等[21]通过细胞实验技术证明miRNA-2392通过靶向MAML3和沃尔夫-赫施霍恩综合征1(Wolf-Hirschhorn syndrome candidate 1,WHSC1)基因抑制胃癌的转移与上皮间质转化。这些研究既支持了本研究的可靠性、科学性,又从创新性的角度为未来卵巢癌转移机制研究和分子标志物研究提供了借鉴与思路。
本研究对原发性卵巢癌和转移性卵巢癌之间突变率显著差异基因群进行了GO功能和KEGG通路富集分析,以获知其主要产生生物学功能的GO功能和KEGG通路。在GO功能层面,我们发现这些差异突变基因主要显著富集在突触前组织、树突发育、通过质膜黏附分子的细胞黏附、中间丝细胞骨架、基于肌动蛋白的细胞投射簇、蛋白质膜锚、肌动蛋白结合等功能上;在KEGG通路层面,我们发现肌动蛋白细胞骨架的调节、ABC运载体、谷氨酸能突触、TCA循环等重要通路均有差异体细胞突变基因的富集,结果提示筛选出的突变率差异基因群可能通过这些重要功能、通路,调控卵巢癌细胞转移、侵袭。
综上所述,本研究借助于COSMIC数据库,完成了原发性卵巢癌和转移性卵巢癌两类组织样本突变率差异体细胞基因群的筛选及其GO功能和KEGG通路的挖掘,为卵巢癌转移调控机制研究提供了一些参考与借鉴,这些差异基因群有可能作为卵巢癌诊治的标志物和治疗靶点应用于临床。
| [1] |
李克敏, 宋亮, 尹如铁. 2017年第4版NCCN卵巢癌临床实践指南解读[J]. 华西医学, 2018, 33: 398-402. |
| [2] |
王欣. 联合用药对卵巢癌晚期患者的疗效观察[J]. 中国城乡企业卫生, 2019, 34: 113-114. |
| [3] |
SMITH R A, ANDREWS K S, BROOKS D, FEDEWA S A, MANASSARAM-BAPTISTE D, SASLOW D, et al. Cancer screening in the United States, 2018:a review of current American Cancer Society guidelines and current issues in cancer screening[J]. CA Cancer J Clin, 2018, 68: 297-316. DOI:10.3322/caac.21446 |
| [4] |
王英. EGFR、COX-2、Caspase-3、Blc-2及MMP与卵巢癌患者化疗耐药的关系[J]. 实用癌症杂志, 2018, 33: 721-723, 727. DOI:10.3969/j.issn.1001-5930.2018.05.008 |
| [5] |
LHEUREUX S, BRAUNSTEIN M, OZA A M. Epithelial ovarian cancer:evolution of management in the era of precision medicine[J]. CA Cancer J Clin, 2019, 69: 280-304. |
| [6] |
何松原, 雷开键. A549和SK-OV-3细胞株中CD44v6、整合素αvβ3、EGFR及E-钙黏素的表达差异与远处转移关系[J]. 实用肿瘤杂志, 2015, 30: 225-228. |
| [7] |
张婧. WAVE1在上皮性卵巢癌恶性行为中的作用及其机制的初步研究[D].重庆: 重庆医科大学, 2013.
|
| [8] |
PETLJAK M, ALEXANDROV L B, BRAMMELD J S, PRICE S, WEDGE D C, GROSSMANN S, et al. Characterizing mutational signatures in human cancer cell lines reveals episodic APOBEC mutagenesis[J/OL]. Cell, 2019, 176: 1282-1294.e20. doi: 10.1016/j.cell.2019.02.012.
|
| [9] |
CHEN W, ZHENG R, BAADE P D, ZHANG S, ZENG H, BRAY F, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115-132. DOI:10.3322/caac.21338 |
| [10] |
KOPPER O, DE WITTE C J, LÕHMUSSAAR K, VALLE-INCLAN J E, HAMI N, KESTER L, et al. An organoid platform for ovarian cancer captures intra-and interpatient heterogeneity[J]. Nat Med, 2019, 25: 838-849. DOI:10.1038/s41591-019-0422-6 |
| [11] |
ROZHOK A, DEGREGORI J. A generalized theory of age-dependent carcinogenesis[J]. Elife, 2019, 8. DOI:10.7554/eLife.39950 |
| [12] |
HU J, LIU Z, WANG X. Does TP53 mutation promote ovarian cancer metastasis to omentum by regulating lipid metabolism?[J]. Med Hypotheses, 2013, 81: 515-520. DOI:10.1016/j.mehy.2013.06.009 |
| [13] |
REN Y A, MULLANY L K, LIU Z, HERRON A J, WONG K K, RICHARDS J S. Mutant p53 promotes epithelial ovarian cancer by regulating tumor differentiation, metastasis, and responsiveness to steroid hormones[J]. Cancer Res, 2016, 76: 2206-2218. DOI:10.1158/0008-5472.CAN-15-1046 |
| [14] |
MIRCETIC J, DIETRICH A, PASZKOWSKI-ROGACZ M, KRAUSE M, BUCHHOLZ F. Development of a genetic sensor that eliminates p53 deficient cells[J/OL]. Nat Commun, 2017, 8: 1463. doi: 10.1038/s41467-017-01688-w. https://www.nature.com/articles/s41467-017-01688-w?WT.feed_name=subjects_physical-sciences
|
| [15] |
STASENKO M, CYBULSKA P, FEIT N, MAKKER V, KONNER J, O'CEARBHAILL R E, et al. Brain metastasis in epithelial ovarian cancer by BRCA1/2 mutation status[J]. Gynecol Oncol, 2019, 154: 144-149. |
| [16] |
ROOT K, ARMAGHANY T. Solitary brain metastasis in a patient with ovarian cancer with BRCA2 mutation[J/OL]. J Clin Oncol, 2012, 30: e239-e240. doi: 10.1200/JCO.2011.41.5919. https://www.researchgate.net/publication/228105682_Solitary_Brain_Metastasis_in_a_Patient_With_Ovarian_Cancer_With_BRCA2_Mutation
|
| [17] |
SZABOVA L, YIN C, BUPP S, GUERIN T M, SCHLOMER J J, HOUSEHOLDER D B, et al. Perturbation of Rb, p53, and Brca1 or Brca2 cooperate in inducing metastatic serous epithelial ovarian cancer[J]. Cancer Res, 2012, 72: 4141-4153. DOI:10.1158/0008-5472.CAN-11-3834 |
| [18] |
LI Z, NIU H, QIN Q, YANG S, WANG Q, YU C, et al. LncRNA UCA1 mediates resistance to cisplatin by regulating the miR-143/FOSL2-signaling pathway in ovarian cancer[J]. Mol Ther Nucleic Acids, 2019, 17: 92-101. DOI:10.1016/j.omtn.2019.05.007 |
| [19] |
LI S, FANG X D, WANG X Y, FEI B Y. Fos-like antigen 2(FOSL2) promotes metastasis in colon cancer[J]. Exp Cell Res, 2018, 373(1/2): 57-61. |
| [20] |
ONISHI H, ICHIMIYA S, YANAI K, UMEBAYASHI M, NAKAMURA K, YAMASAKI A, et al. RBPJ and MAML3:potential therapeutic targets for small cell lung cancer[J]. Anticancer Res, 2018, 38: 4543-4547. DOI:10.21873/anticanres.12758 |
| [21] |
LI J, LI T, LU Y, SHEN G, GUO H, WU J, et al. MiR-2392 suppresses metastasis and epithelial-mesenchymal transition by targeting MAML3 and WHSC1 in gastric cancer[J]. FASEB J, 2017, 31: 3774-3786. DOI:10.1096/fj.201601140RR |
 2019, Vol. 40
2019, Vol. 40


