2. 北京中科遗传与生殖医学研究院新技术研究室, 北京 102629;
3. 南京医科大学第一附属医院江苏省人民医院生殖医学中心, 南京 210029
2. New Technology Research Laboratory, Peking Medriv Academy of Genetics and Reproduction, Beijing 102629, China;
3. Reproductive Medicine Center, Jiangsu Province Hospital, The First Affiliated Hospital with Nanjing Medical University, Nanjing 210029, Jiangsu, China
拉曼效应由印度物理学家拉曼于1928年首次提出,指光波被散射后频率会发生变化[1]。拉曼光谱是与入射光频率不同的散射光谱,其表征的是分子的振动、转动信息,可用于对样品的化学成分和分子结构进行无损分析,提供其“分子指纹”[2-5]。表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)衍生于拉曼光谱,极大地提高了拉曼光谱的检测灵敏度并克服了信号弱的缺点,因其具有快速、简单、无创、准确且不受水干扰等优势,近年来被广泛应用于生物医学领域[6-8]。
受环境、激素和相关疾病等因素的影响,近年来不孕不育患者日益增多,患者往往面临生物学、心理学及社会学等一系列复杂问题,焦虑增加,健康受到严重影响,相关问题困扰全球约10%~15%的人群[9-11]。造成女性不孕症的原因多样,如内分泌失调、输卵管疾病、慢性盆腔炎、子宫内膜异位症、多囊卵巢、生殖器发育异常等[12-13]。目前,人们正尝试将SERS应用于女性生殖医学分析领域,如乳腺癌[14-15]、卵巢癌[16-17]、多囊卵巢综合征[18]和宫内膜异位症[19]等,相关研究正日趋成为热点。
卵巢储备是指女性卵巢中卵泡的数量和质量,可有效反映女性的生育力,临床常用的卵巢储备功能评价指标有雌二醇(estradiol,E2)、抗苗勒管激素(anti-Müllerian hormone,AMH)、窦卵泡数目(antral follicle count,AFC)等[20-21]。随卵巢储备功能的下降,女性的生育力降低,不孕症的发病率升高。目前,卵巢储备功能低下是不孕症临床治疗的热点和难点,理想的卵巢储备检测方法应具备成本低、无创和检测迅速等优点。血清标本中代谢物成分复杂,适合用SERS进行无标记和非侵入性检测,以客观反映机体细胞和组织的生理及病理变化[22-26]。本研究采用银纳米粒子作为活性增强基底,对比分析不孕女性和健康女性的血清SERS差异,以为临床不孕不育患者的快速诊断提供一种简单、高效的备选方法。
1 材料和方法 1.1 血清样本健康和不孕症女性实验用血清标本均收集自南京医科大学第一附属医院生殖医学中心,共计236份。采用博洛尼亚标准[27]作为卵巢低反应(poor ovarian response,POR)诊断标准:(1)高龄(≥40岁)或存在其他POR危险因素;(2)前次常规促排卵方案获卵数≤3枚;(3)卵巢储备下降,即AFC<5~7个或AMH<0.5~1.1 ng/mL。根据上述标准及临床检测结果,将血清标本分为E2高值组(>5 000 pmol/L,78例)与E2低值组(<500 pmol/L,86例)、AMH高值组(≥1.1 ng/mL,33例)与AMH低值组(<1.1 ng/mL,30例)、AFC高值组(>14个,68例)与AFC低值组(<7个,34例)。所有受试者年龄均处于育龄阶段(22~49岁),平均年龄为(30.8±5.1)岁,各组年龄随机分布,差异无统计学意义。血清保存于-80 ℃冰箱内,并于1周内完成检测。
1.2 试剂与仪器银纳米粒子购自厦门普识纳米科技有限公司(CP-S1,粒径50 nm)。便携式拉曼光谱仪(型号i-Raman® Pro)为必达泰克光电科技(上海)有限公司产品,QL-901型涡旋器为海门市其林贝尔仪器制造有限公司产品,移液枪(2~20 μL,0.1~2.5 μL)为芬兰Biohit公司产品。
1.3 检测方法将血清标本从-80 ℃冰箱取出后置于室温(25 ℃)数分钟自然解冻。然后取10 μL样品与10 μL银纳米颗粒混合于新的0.2 mL PCR管中,于涡旋器中充分震荡混匀,并让血清和胶体银孵育反应30 min,后用移液枪取混合样品2.5 μL点样至贴有锡纸的载玻片上,待其自然风干。拉曼仪检测激发光波长为785 nm,激发光功率为60 mW,积分时间为10 000 ms,收集的拉曼光谱范围为400~1 800 cm-1,平均次数为3次,以减少宇宙射线的影响。所有标本均在相同条件下测量,每个样品在不同位点测量5次,然后取平均谱,以此代表该样品的拉曼信号。
1.4 统计学处理使用Bwspec4软件(美国B & W Tek公司)对所有拉曼谱图进行背景扣除和光谱平滑,并进行面积归一化处理。光谱数据用SIMCA 14.1软件(瑞典Umetrics公司)进行正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)。OPLS-DA是一种有监督的判别分析统计方法[28],模型中R2X和R2Y分别表示所建模型对X和Y矩阵的解释率,Q2表示模型的预测能力,理论上R2、Q2值越接近1模型的拟合准确性越高,通常情况下R2和Q2均以>0.5(50%)为较好,>0.4即可接受,且两者之间差值不应过大(0.2~0.3),差值较大表明过度拟合。用受试者工作特征(receiver operating characteristic,ROC)曲线评估方法的准确性,用置换检验验证模型的可靠性。用SPSS 25软件对波谱数据进行t检验,检验水准(α)为0.05。
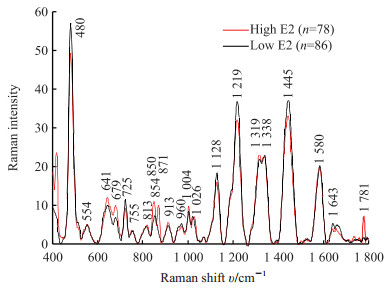
2 结果 2.1 血清样本平均拉曼谱图的比较 2.1.1 E2高值组和低值组的血清平均SERS图及特征见图 1。两组的平均拉曼光谱形态和谱峰基本相似,均在480、554、641、679、725、755、813、913、960、1 004、1 026、1 128、1 219、1 319、1 338、1 445、1 580、1 643 cm-1处有拉曼峰;在1 781 cm-1处只有E2高值组有峰,且在641、679、913、1 004、1 319 cm-1处E2高值组峰强较强,但在480、725、1 128、1 219、1 445、1 643 cm-1处E2低值组峰强较强;E2低值组在854 cm-1处有峰,但E2高值组裂解为850 cm-1和871 cm-1峰;除554、755、1 026、1 338、1 580 cm-1峰外,其余谱峰强度两组间比较差异均有统计学意义(P 均<0.05)。
|
图 1 E2高值组(>5 000 pmol/L)和低值组(<500 pmol/L)归一化后血清平均SERS谱图 Fig 1 Average SERS of normalized serum in high E2 value (> 5 000 pmol/L) and low E2 value (< 500 pmol/L) groups E2: Estradiol; SERS: Surface-enhanced Raman spectroscopy |
2.1.2 AMH高值组和低值组的血清平均SERS图及特征
见图 2。两组的平均拉曼光谱形态和谱峰基本相似,均在480、554、641、679、725、755、813、854、913、960、1 004、1 026、1 128、1 219、1 338、1 445、1 580、1 643 cm-1处有拉曼峰;在1 781 cm-1处只有AMH低值组有峰,且在480、554、725、913、960、1 026、1 128、1 219、1 445、1 580 cm-1处AMH高值组峰强较强,但在641、679、854、1 004、1 338、1 643 cm-1处AMH低值组峰强较强;在480、641、913、960、1 026、1 128 cm-1处谱峰强度两组间比较差异均有统计学意义(P 均<0.05)。

|
图 2 AMH高值组(≥1.1 ng/mL)和低值组(<1.1 ng/mL)归一化后血清平均SERS谱图 Fig 2 Average SERS of normalized serum in high AMH value (≥1.1 ng/mL) and low AMH value (< 1.1 ng/mL) groups AMH: Anti-Müllerian hormone; SERS: Surface-enhanced Raman spectroscopy |
2.1.3 AFC高值组和低值组的血清平均SERS图及特征
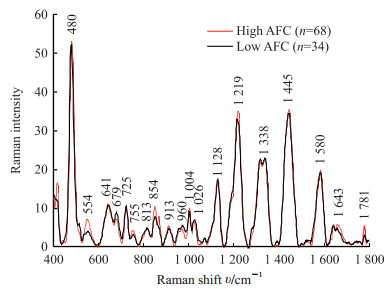
见图 3。两组的平均拉曼光谱形态和谱峰基本相似,均在480、554、641、679、725、755、813、854、913、960、1 004、1 026、1 128、1 219、1 338、1 445、1 580、1 643、1 781 cm-1处有拉曼峰;在554、755、854、1 219、1 445、1 643、1 781 cm-1处AFC高值组峰强较强;在554、755、854、1 004、1 219、1 643、1 781 cm-1处谱峰两组间比较差异均有统计学意义(P 均<0.05)。
|
图 3 AFC高值组(>14)和低值组(<7)归一化后血清平均SERS谱图 Fig 3 Average SERS of normalized serum in high AFC value (> 14) and low AFC value (< 7) groups AFC: Antral follicle count; SERS: Surface-enhanced Raman spectroscopy |
2.2 OPLS-DA模型分析 2.2.1 E2指标OPLS-DA模型
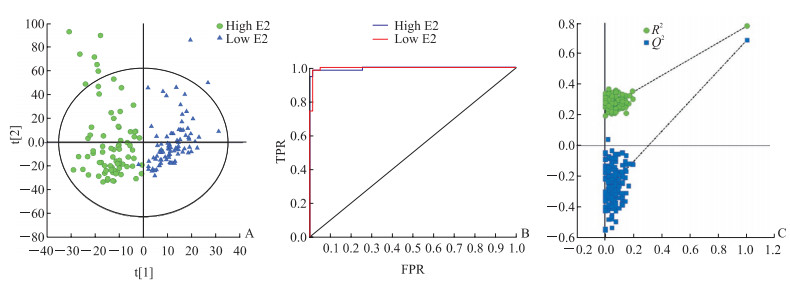
由图 4A可以看出E2高值组和低值组有着明显的聚类趋势(即组间分离趋势),横坐标为主成分1的得分值,纵坐标为主成分2的得分值,椭圆代表整个样本分析结果的95%置信区间。OPLS-DA模型参数为R2X(cum)=0.716,R2Y(cum)=0.778,Q2(cum)=0.687,即拟合得出的主成分涵盖了所有观测信息的71.6%,拟合得出的主成分可以解释样本所有变量的77.8%,该模型的预测能力为68.7%。ROC曲线是反映灵敏度和特异度连续变量的综合指标,曲线下面积(area under curve,AUC)越大诊断准确性越高。该模型中E2高值组和低值组的AUC均为0.996,接近于1,表明该模型的分类效果好(图 4B)。使用SIMCA 14.1软件对数据进行200次置换检验,结果如图 4C所示,得到R2截距为0.242、Q2截距为-0.303,一般当前者<0.3~0.4、后者<0.05时可认为模型较好,且该模型R2和Q2值都比随机数据产生的值大,表明该模型有效,不存在过度拟合。
|
图 4 E2高值组(>5 000 pmol/L)和低值组(<500 pmol/L)血清样本OPLS-DA图 Fig 4 OPLS-DA diagram of serum samples from high E2 value (> 5 000 pmol/L) and low E2 value (< 500 pmol/L) groups A: Score chart of serum samples in high E2 value group (n=78) and low E2 value group (n=86); B: ROC curve of serum SERS in high E2 value group and low E2 value group after OPLS-DA; C: OPLS-DA post-displacement test. E2: Estradiol; OPLS-DA: Orthogonal partial least squares discriminant analysis; ROC: Receiver operating characteristic; SERS: Surface-enhanced Raman spectroscopy; TPR: True positive rate; FPR: False positive rate; R2: Goodness of fit; Q2: Predictive capability |
2.2.2 AMH指标OPLS-DA模型
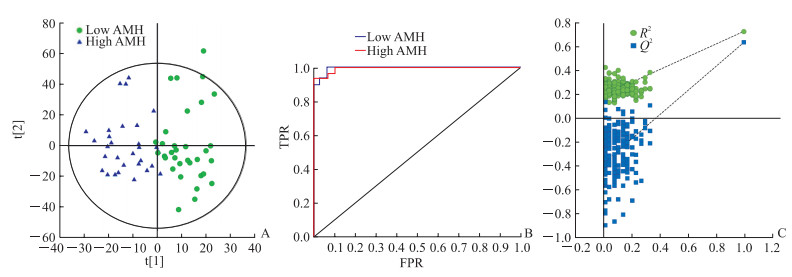
见图 5。OPLS-DA模型参数为R2X(cum)=0.542,R2Y(cum)=0.726,Q2(cum)=0.633,表现出很好的组间分离趋势,且模型稳定,预测能力较好。AMH高值组和低值组的ROC AUC均为0.995,接近于1,表明该模型的分类效果很好。使用SIMCA 14.1软件对数据进行200次置换检验,得到R2截距为0.192,Q2截距为-0.379,该模型R2和Q2值都比随机数据产生的值大,模型标准不存在过度拟合,表明该模型可靠。
|
图 5 AMH高值组(≥1.1 ng/mL)和低值组(<1.1 ng/mL)血清样本OPLS-DA图 Fig 5 OPLS-DA diagram of serum samples from high AMH value (≥1.1 ng/mL) and low AMH value (< 1.1 ng/mL) groups A: Score chart of serum samples in high AMH value group (n=33) and low AMH value group (n=30); B: ROC curve of serum SERS in high AMH value group and low AMH value group after OPLS-DA; C: OPLS-DA post-displacement test. AMH: Anti-Müllerian hormone; OPLS-DA: Orthogonal partial least squares discriminant analysis; ROC: Receiver operating characteristic; SERS: Surface-enhanced Raman spectroscopy; TPR: True positive rate; FPR: False positive rate; R2: Goodness of fit; Q2: Predictive capability |
2.2.3 AFC指标OPLS-DA模型
见图 6。OPLS-DA模型参数为R2X(cum)=0.652,R2Y(cum)=0.741,Q2(cum)=0.619,模型稳定,预测能力较好。模型具有很好的组间分离趋势,但组内有些分散,可能与生物个体差异大有关。AFC高值组和低值组的ROC AUC均为1,表明该模型的分类效果很好。使用SIMCA 14.1软件对数据进行200次置换检验,得到R2截距为0.2,Q2截距为-0.279,该模型R2和Q2值都比随机数据产生的值大,表明该模型有效,不存在过度拟合。

|
图 6 AFC高值组(>14)和低值组(<7)血清样本OPLS-DA图 Fig 6 OPLS-DA diagram of serum samples from high AFC value (> 14) and low AFC value (< 7) groups A: Score chart of serum samples in high AFC value group (n=68) and low value group (n=34); B: ROC curve of serum SERS in high AFC value group and low AFC value group after OPLS-DA; C: OPLS-DA post-displacement test. AFC: Antral follicle count; OPLS-DA: Orthogonal partial least squares discriminant analysis; ROC: Receiver operating characteristic; SERS: Surface-enhanced Raman spectroscopy; TPR: True positive rate; FPR: False positive rate; R2: Goodness of fit; Q2: Predictive capability |
3 讨论
本研究应用SERS结合OPLS-DA方法,采用银纳米粒子作为活性增强基底,对比分析了育龄期女性不同水平的关键生育力评价指标。SERS谱峰峰位归属分析表明,E2高值组与低值组、AMH高值组与低值组、AFC高值组与低值组之间谱峰强度存在差异,部分峰位强度差异有统计学意义(P 均<0.05)。本研究结果表明,采用合适的光谱条件、光谱预处理方法,血清SERS结合OPLS-DA模型能有效分析女性的关键生育力评价指标,可用于不孕症患者的快速筛查,值得进一步研究和探讨其临床应用价值。
不孕症患者的卵巢储备功能评价主要依据E2、AMH、AFC等的测定结果[21]。E2产生于雌性卵巢或雄性睾丸,是影响生殖和性功能的重要因素。目前临床应用的E2检测方法在低浓度下(<10 pg/mL)无法准确评估其浓度,但基于SERS的E2检测限可低至0.65 pg/mL[29]。AMH是性腺特异性糖蛋白,属转化生长因子β超家族,产生于卵泡发育早期阶段的卵泡颗粒细胞,血清中AMH水平于青春期后逐渐降低,绝经后低至无法检测。血清AMH水平表征原始卵泡和发育中卵泡的数目[30-31],是目前评估卵巢储备的最佳指标。AFC指在月经周期的早期卵泡期中超声可观察到的双卵巢中直径≥2 mm的卵泡总数,AFC和AMH之间强相关,可互换地用于卵巢储备功能估计[32]。本研究中的OPLS-DA模型可有效区分高值和低值水平的E2、AMH和AFC,各指标在不同水平下均有明显聚类趋势。
为防止OPLS模型过度拟合,提高其可预测性[33-34],我们对模型进行了ROC曲线分析和置换检验。结果表明各组的ROC AUC均接近1或等于1,表明模型的准确性高、分类效果好。本研究采用SIMCA 14.1软件对各组数据进行了200次置换检验,3个指标的模型R2和Q2值都比随机数据产生的值大,表明模型有效。
通过对各组测得的SERS谱峰峰位的归属,发现E2高值组和低值组、AMH高值组和低值组及AFC高值组和低值组血清SERS图谱有不同之处,主要受体内氨基酸、蛋白质、核酸、脂质和糖类等生物分子的代谢变化的影响[35-42]。E2高值组和低值组SERS谱在480、641、679、725、813、854、913、960、1 004、1 128、1 219、1 319、1 445、1 643 cm-1处差异有统计学意义(P 均<0.05),可能与体内酪氨酸、脯氨酸、苯基丙氨酸、苯丙氨酸、L-丝氨酸、L-色氨酸、葡萄糖、胆固醇、酰胺Ⅰ、酰胺Ⅲ及磷脂等代谢有关;AMH高值组与低值组在480、641、913、960、1 026、1 128 cm-1处差异具有统计学意义(P 均<0.05),可能与体内酪氨酸、类胡萝卜素、胆固醇、葡萄糖等代谢有关;AFC高值组和低值组在554、755、854、1 004、1 219、1 643、1 781 cm-1处差异具有统计学意义(P 均<0.05),可能与体内酪氨酸、脯氨酸、苯基丙氨酸、色氨酸、葡萄糖、酰胺Ⅰ等代谢有关。
本研究结果表明,拉曼光谱技术可初步分析育龄期女性关键生育力评价指标,SERS可为临床不孕不育患者的快速诊断提供一种简单、高效的备选新方法。本研究最大的不足是前期收集的样本数量较少,在后续研究中,为提升模型的预测能力及稳定性,还需扩大样本量建立更加实用和可靠的模型。目前对于生物样本的检测均需要采用SERS谱并对光谱数据进行一定的预处理,但对光谱数据预处理的过程及后续的统计分析并没有形成统一的标准,将拉曼光谱技术应用于临床不孕不育症诊断还需进一步研究。
| [1] |
RAMAN C V, KRISHNAN K S. A new type of secondary radiation[J]. Nature, 1928, 121: 501-502. |
| [2] |
ZHANG J, FAN Y, HE M, MA X, SONG Y, LIU M, et al. Accuracy of Raman spectroscopy in differentiating brain tumor from normal brain tissue[J]. Oncotarget, 2017, 8: 36824-36831. |
| [3] |
ESMONDE-WHITE K A, CUELLAR M, UERPMANN C, LENAIN B, LEWIS I R. Raman spectroscopy as a process analytical technology for pharmaceutical manufacturing and bioprocessing[J]. Anal Bioanal Chem, 2017, 409: 637-649. |
| [4] |
WANG W T, ZHANG H, YUAN Y, GUO Y, HE S X. Research progress of Raman spectroscopy in drug analysis[J]. AAPS PharmSciTech, 2018, 19: 2921-2928. |
| [5] |
PAVLICEK R L, CRANE N J, GHEBREMEDHIN M, CILWA K E, ELSTER E A. Diagnostic bacteriology:Raman spectroscopy[J]. Methods Mol Biol, 2017, 1616: 249-261. |
| [6] |
李如男, 费嘉, 郭兴道, 沈丽霞, 张癸荣. 拉曼光谱检测在辅助生殖领域的研究进展[J]. 国际生殖健康/计划生育杂志, 2018, 37: 347-352. DOI:10.3969/j.issn.1674-1889.2018.04.020 |
| [7] |
ANKUDZE B, PHILIP A, PAKKANEN T T. Ultrasensitive and recyclable superstructure of AuSiO2@Ag wire for surface-enhanced Raman scattering detection of thiocyanate in urine and human serum[J]. Anal Chim Acta, 2019, 1049: 179-187. |
| [8] |
BUTLER H J, ASHTON L, BIRD B, CINQUE G, CURTIS K, DORNEY J, et al. Using Raman spectroscopy to characterize biological materials[J]. Nat Protoc, 2016, 11: 664-687. |
| [9] |
MASSAROTTI C, GENTILE G, FERRECCIO C, SCARUFFI P, REMORGIDA V, ANSERINI P. Impact of infertility and infertility treatments on quality of life and levels of anxiety and depression in women undergoing in vitro fertilization[J]. Gynecol Endocrinol, 2019, 35: 485-489. |
| [10] |
OMAR M I, PAL R P, KELLY B D, BRUINS H M, YUAN Y, DIEMER T, et al. Benefits of empiric nutritional and medical therapy for semen parameters and pregnancy and live birth rates in couples with idiopathic infertility:a systematic review and meta-analysis[J]. Eur Urol, 2019, 75: 615-625. |
| [11] |
苑杰, 贾娜娜, 庞静娟, 韩宝生, 王静, 王树松. 不孕不育患者抑郁焦虑情绪影响因素研究进展[J]. 中国医药导报, 2016, 13: 48-51. |
| [12] |
黄小琼, 邓光尧, 汪欢生, 杨秀桂, 肖丹妮. 育龄女性不孕的影响因素及治疗方式研究[J]. 中国当代医药, 2016, 23: 63-68. |
| [13] |
赵永新. 女性不孕不育症相关因素及病因980例分析[J]. 现代预防医学, 2012, 39: 3528-3529. |
| [14] |
VARGAS-OBIETA E, MARTÍNEZ-ESPINOSA J C, MARTÍNEZ-ZEREGA B E, JAVE-SUÁREZ L F, AGUILAR-LEMARROY A, GONZÁLEZ-SOLÍS J L. Breast cancer detection based on serum sample surface enhanced Raman spectroscopy[J]. Lasers Med Sci, 2016, 31: 1317-1324. |
| [15] |
BILAL M, BILAL M, TABASSUM S, SALEEM M, MAHMOOD H, SARWAR U, et al. Optical screening of female breast cancer from whole blood using Raman spectroscopy[J]. Appl Spectrosc, 2017, 71: 1004-1013. |
| [16] |
PARASKEVAIDI M, ASHTON K M, STRINGFELLOW H F, KEATING P J, WOOD N J, ROWBOTTOM A W, et al. Raman spectroscopic techniques to detect ovarian cancer biomarkers in blood plasma[J]. Talanta, 2018, 189: 281-288. |
| [17] |
OWENS G L, GAJJAR K, TREVISAN J, FOGARTY S W, TAYLOR S E, DA GAMA-ROSE B, et al. Vibrational biospectroscopy coupled with multivariate analysis extracts potentially diagnostic features in blood plasma/serum of ovarian cancer patients[J]. J Biophotonics, 2014, 7(3/4): 200-209. |
| [18] |
MOMENPOUR A, LIMA P D A, CHEN Y A, TZENG C R, TSANG B K, ANIS H. Surface-enhanced Raman scattering for the detection of polycystic ovary syndrome[J]. Biomed Opt Express, 2018, 9: 801-817. |
| [19] |
NOTARSTEFANO V, GIOACCHINI G, BYRNE H J, ZACÀ C, SERENI E, VACCARI L, et al. Vibrational characterization of granulosa cells from patients affected by unilateral ovarian endometriosis:new insights from infrared and Raman microspectroscopy[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2019, 212: 206-214. DOI:10.1016/j.saa.2018.12.054 |
| [20] |
TAL R, SEIFER D B. Ovarian reserve testing:a user's guide[J]. Am J Obstet Gynecol, 2017, 217: 129-140. |
| [21] |
李凤琼, 冯琳, 韩倩倩. AMH、性激素、AFC联合年龄对不孕症患者卵巢储备功能预测的意义[J]. 实用妇科内分泌杂志, 2018, 5: 30-31. |
| [22] |
STEFANCU A, MOISOIU V, COUTI R, ANDRAS I, RAHOTA R, CRISAN D, et al. Combining SERS analysis of serum with PSA levels for improving the detection of prostate cancer[J]. Nanomedicine (Lond), 2018, 13: 2455-2467. DOI:10.2217/nnm-2018-0127 |
| [23] |
PANIKAR S S, RAMÍREZ-GARCÍA G, SIDHIK S, LÓPEZ-LUKE T, RODRIGUEZ-GONZALEZ C, CIAPARA I H, et al. Ultra-sensitive SERS substrate for label-free therapeutic drug monitoring of paclitaxel and cyclophosphamide in blood serum[J]. Anal Chem, 2019, 91: 2100-2111. DOI:10.1021/acs.analchem.8b04523 |
| [24] |
CERVO S, MANSUTTI E, DEL MISTRO G, SPIZZO R, COLOMBATTI A, STEFFAN A, et al. SERS analysis of serum for detection of early and locally advanced breast cancer[J]. Anal Bioanal Chem, 2015, 407: 7503-7509. |
| [25] |
DUMONT E, DE BLEYE C, CAILLETAUD J, SACRÉ P Y, VAN LERBERGHE P B, ROGISTER B, et al. Development of a SERS strategy to overcome the nanoparticle stabilisation effect in serum-containing samples:application to the quantification of dopamine in the culture medium of PC-12 cells[J]. Talanta, 2018, 186: 8-16. DOI:10.1016/j.talanta.2018.04.038 |
| [26] |
LÓPEZ-BASCÓN M A, PRIEGO-CAPOTE F, PERALBO-MOLINA A, CALDERÓN-SANTIAGO M, LUQUE DE CASTRO M D. Influence of the collection tube on metabolomic changes in serum and plasma[J]. Talanta, 2016, 150: 681-689. |
| [27] |
FERRARETTI A P, LA MARCA A, FAUSER B C, TARLATZIS B, NARGUND G, GIANAROLI L; ASHER Working group on Poor Ovarian Response Definition. ESHRE consensus on the definition of 'poor response' to ovarian stimulation for in vitro fertilization:the Bologna criteria[J]. Hum Reprod, 2011, 26: 1616-1624. |
| [28] |
SONG H H, KIM D Y, WOO S, LEE H K, OH S R. An approach for simultaneous determination for geographical origins of Korean Panax ginseng by UPLC-QTOF/MS coupled with OPLS-DA models[J]. J Ginseng Res, 2013, 37: 341-348. DOI:10.5142/jgr.2013.37.341 |
| [29] |
WANG R, CHON H, LEE S, CHENG Z, HONG S H, YOON Y H, et al. Highly sensitive detection of hormone estradiol E2 using surface-enhanced Raman scattering based immunoassays for the clinical diagnosis of precocious puberty[J]. ACS Appl Mater Interfaces, 2016, 8: 10665-10672. |
| [30] |
SHAHROKHI S Z, KAZEROUNI F, GHAFFARI F. Anti-Müllerian hormone:genetic and environmental effects[J]. Clin Chim Acta, 2018, 476: 123-129. |
| [31] |
NADERI Z, KASHANIAN M, CHENARI L, SHEIKHANSARI N. Evaluating the effects of administration of 25-hydroxyvitamin D supplement on serum anti-mullerian hormone (AMH) levels in infertile women[J]. Gynecol Endocrinol, 2018, 34: 409-412. |
| [32] |
LOY S L, CHEUNG Y B, FORTIER M V, ONG C L, TAN H H, NADARAJAH S, et al. Age-related nomograms for antral follicle count and anti-Mullerian hormone for subfertile Chinese women in Singapore[J/OL]. PLoS One, 2017, 12: e0189830. doi: 10.1371/journal.pone.0189830. https://www.ncbi.nlm.nih.gov/pubmed/29240820
|
| [33] |
WORLEY B, POWERS R. PCA as a practical indicator of OPLS-DA model reliability[J]. Curr Metabolomics, 2016, 4: 97-103. |
| [34] |
TRIBA M N, LE MOYEC L, AMATHIEU R, GOOSSENS C, BOUCHEMAL N, NAHON P, et al. PLS/OPLS models in metabolomics:the impact of permutation of dataset rows on the K-fold cross-validation quality parameters[J]. Mol Biosyst, 2015, 11: 13-19. |
| [35] |
李乔敏, 张毅, 吕金燕, 马辉, 高文斌, 王若雨. 利用主成分分析法分析乳腺癌术后患者的血清表面增强拉曼光谱[J]. 激光生物学报, 2012, 21: 257-262. DOI:10.3969/j.issn.1007-7146.2012.03.012 |
| [36] |
冯尚源, 潘建基, 伍严安, 林多, 陈燕坪, 席刚琴, 等. 基于SERS技术结合多变量统计分析胃癌患者血浆拉曼光谱[J]. 中国科学:生命科学, 2011, 41: 550-557. |
| [37] |
SHEN A G, PENG J, ZHAO Q H, SU L, WANG X H, HU J M, et al. Accurate and noninvasive embryos screening during in vitro fertilization (IVF) assisted by Raman analysis of embryos culture medium[J]. Laser Phys Lett, 2012, 9: 322-328. DOI:10.1002/lapl.201110134 |
| [38] |
CHEN N, RONG M, SHAO X, ZHANG H, LIU S, DONG B, et al. Surface-enhanced Raman spectroscopy of serum accurately detects prostate cancer in patients with prostate-specific antigen levels of 4-10 ng/mL[J]. Int J Nanomedicine, 2017, 12: 5399-5407. |
| [39] |
郭晶, 荣振, 肖瑞, 王升启. 基于表面增强拉曼散射的血清指纹谱检测方法研究[J]. 军事医学, 2016, 40: 602-605. |
| [40] |
SILVEIRA L Jr, BORGES R C F, NAVARRO R S, GIANA H E, ZÂNGARO R A, PACHECO M T T, et al. Quantifying glucose and lipid components in human serum by Raman spectroscopy and multivariate statistics[J]. Lasers Med Sci, 2017, 32: 787-795. |
| [41] |
王德力. 小白鼠和人体血清的表面增强拉曼光谱研究[J]. 世界最新医学信息文摘, 2018, 18: 190-191. |
| [42] |
OLESZKO A, HARTWICH J, WÓJTOWICZ A, GĄSIOR-GŁOGOWSKA M, HURAS H, KOMOROWSKA M. Comparison of FTIR-ATR and Raman spectroscopy in determination of VLDL triglycerides in blood serum with PLS regression[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2017, 183: 239-246. |
 2019, Vol. 40
2019, Vol. 40


