2. 上海中医药大学附属曙光医院麻醉科, 上海 200021;
3. 海军军医大学(第二军医大学)长海医院麻醉学部, 上海 200433;
4. 上海中医药大学附属岳阳中西医结合医院麻醉科, 上海 200437
2. Department of Anesthesiology, Shuguang Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 200021, China;
3. Department of Anesthesiology, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China;
4. Department of Anesthesiology, Yueyang Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200437, China
类风湿性关节炎所致的疼痛是一种慢性炎性疼痛,其发病与自身免疫调节功能失调及氧化应激平衡异常密切相关[1]。目前类风湿性关节炎的治疗过多地注重于免疫调节而忽略了对体内氧化应激平衡异常的干预,大量免疫调节药物的应用导致了一系列问题,如心血管并发症的发生率升高等[2]。氢气是分子结构最简单的物质,在人体内能发挥抗炎、抗氧化、抗凋亡、抗过敏的作用[3],研究还发现氢气对组织器官缺血再灌注、动脉粥样硬化、糖尿病及肿瘤等疾病有着显著的治疗效果[4-7]。然而,关于氢气对类风湿性关节炎所致的慢性炎性疼痛治疗作用的研究很少。本研究采用完全弗氏佐剂(complete Freund’s adjuvant,CFA)制备大鼠单关节炎模型,使用氢氧雾化机经呼吸道给予大鼠氢气与氧气的混合气体(氢气体积占混合气体总体积的比例为65%),观察氢气对单关节炎大鼠是否具有保护作用并初步探索其作用机制。
1 材料和方法 1.1 实验材料成年雄性SD大鼠55只,体质量为180~220 g,由海军军医大学(第二军医大学)实验动物中心提供[实验动物生产许可证号:SCXK(沪)2012-0003]。von Frey纤毛(美国Stolting公司),氢氧雾化机(型号:HMS-B-01,上海惠美医疗科技有限公司),氢气浓度检测仪(型号:XP-3140,上海惠美医疗科技有限公司)。大鼠超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成科技有限公司)。
1.2 模型建立及分组大鼠随机均分为5组:单关节炎组、单关节炎+氢气0~14 d组、单关节炎+氢气0~3 d组、单关节炎+氢气4~14 d组、假手术+氢气0~14 d组,每组8只。单关节炎模型大鼠用七氟烷深度麻醉后,用碘酒、乙醇消毒左后肢皮肤,然后将其握于手中,绷紧踝关节局部皮肤,用4号无菌针头刺入关节间隙,当有落空感时停止进针,向踝关节腔内注射CFA 50 μL,4~8 h后观察关节局部有无炎症反应;应用相同方法向假手术组大鼠左侧踝关节腔注射等量生理盐水。模型组大鼠关节出现红肿、跛行表明建模成功。于致炎后1、3、5、7、10、14 d时进行行为学检测以测试机械触诱发痛。
1.3 氢气吸入用带有密封圈的进气接头及呼吸管路连接氢氧雾化机、氢气浓度检测仪和动物实验盒。打开氢氧雾化机,待动物实验盒中的氢气浓度达到65%时放入大鼠,计时1.5 h后关闭氢氧雾化机并检测大鼠机械痛阈的变化。单关节炎组不吸入氢气;单关节炎+氢气0~14 d组在造模当天及造模后第1~14天每天吸入氢气1.5 h;单关节炎+氢气0~3 d组在造模当天及造模后第1~3天每天吸入氢气1.5 h;单关节炎+氢气4~14 d组在造模后第4~14天每天吸入氢气1.5 h;假手术+氢气0~14 d组在假手术当天及之后第1~14天每天吸入氢气1.5 h。在大鼠吸入氢气时保持室内通风,并持续监测室内氢气浓度,当室内氢气浓度超过2%时须立刻停止实验。
1.4 机械刺激抬腿反应阈值(paw withdrawal threshold,PWT)测定利用不同强度的von Frey纤毛压力作用于大鼠脚掌中心部位,引起大鼠缩爪反应,以引起缩爪反应的最小纤毛压力表示PWT[8]。测试时,动物预先适应环境30 min,待动物处于安静状态后开始测试。按照递增的顺序依次施加不同克数的von Frey纤毛(1、1.4、2、4、6、8、10、15 g),以纤毛适度弯曲作为完全受力的标准。每次持续刺激时间为2 s,间隔15 s,连续5次。若有3次不抬腿,则换用更高克数的纤毛;如果5次测试中有3次抬腿,则用低一级克数的纤毛重新测试,直到每5次测试中有3次抬腿。5次测试中能够引起3次抬腿的最低von Frey纤毛的克数即为PWT。于第0、1、3、5、7、10、14天分别测定5组大鼠双侧后爪的PWT。
1.5 氧化应激相关指标检测另取15只大鼠,每组3只,于造模或假手术后第10天(单关节炎组、单关节炎+氢气0~3 d组大鼠处理不变;单关节炎+氢气0~14 d组、单关节炎+氢气4~14 d组、假手术+氢气0~14 d组大鼠吸入氢气均于第10天停止),通过腹腔注射水合氯醛麻醉后放血处死,剪开背部,用咬骨钳小心剪开脊髓腔,暴露脊髓腰膨大,小心移除腰膨大,并分为左右两半,立即放入液氮保存。检测时,将致炎侧组织标本置于蛋白质抽提缓冲液中匀浆,匀浆液40 000×g离心1 h,取上清。用BCA法测上清液的总蛋白质含量。然后用大鼠SOD、CAT、MDA检测试剂盒分别检测脊髓组织中SOD、CAT、MDA的含量。
1.6 统计学处理应用SPSS 17.0软件进行统计学分析,数据以x±s表示。行为学结果多组间比较采用随机区组设计的双因素方差分析,然后采用LSD-t检验分析不同组间的差异;任意两组间SOD、CAT、MDA检测结果的比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 单关节炎大鼠的痛敏反应单关节炎大鼠造模数小时后,致炎侧踝关节即出现明显红肿。PWT测定结果显示,单关节炎组致炎侧后爪PWT在建模后第1天即低于健侧,在第3天达到最低值并维持稳定至第14天(P<0.01,图 1A);而单关节炎组健侧后爪PWT从建模后至第14天与假手术+氢气0~14 d组相比差异无统计学意义(P>0.05,图 1A)。
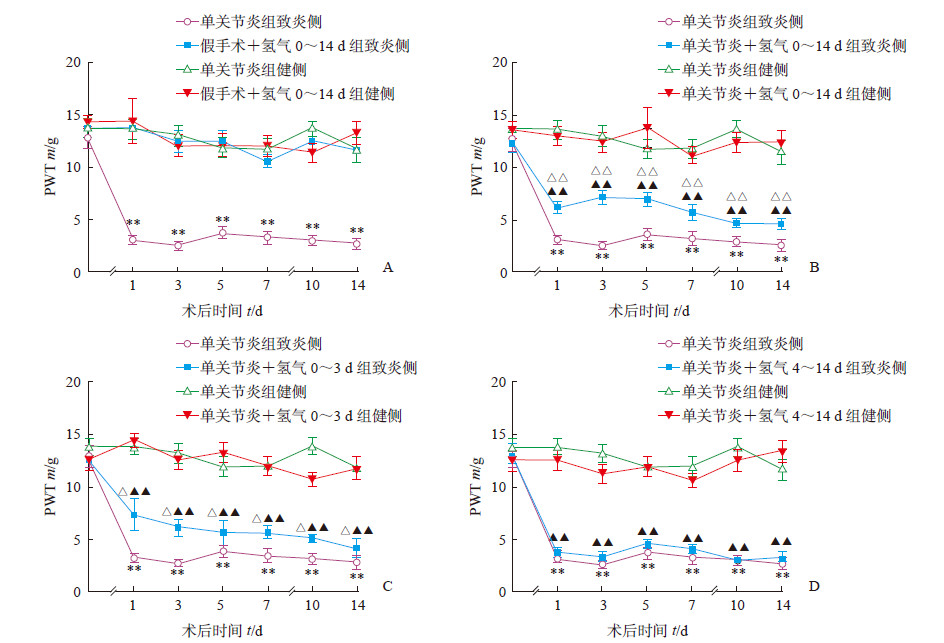
|
图 1 单关节炎大鼠及吸入65%氢气后PWT变化 A:单关节炎大鼠造模后PWT变化; B:于造模0~14 d给予单关节炎大鼠氢气后致炎侧PWT相比于未给予氢气组大鼠的变化; C:于造模0~3 d给予单关节炎大鼠氢气后致炎侧PWT相比于未给予氢气组大鼠的变化; D:于造模4~14 d给予单关节炎大鼠氢气后致炎侧PWT相比于未给予氢气组大鼠的变化. PWT:抬腿反应阈值. **P<0.01与单关节炎组健侧比较; △P<0.05, △△P<0.01与单关节炎组致炎侧比较; ▲▲P<0.01与单关节炎+氢气组健侧比较. n=8, x±s |
2.2 65%氢气吸入可减轻单关节炎大鼠的机械痛敏
从造模后第1天开始,单关节炎+氢气0~14 d组大鼠致炎侧后爪的机械痛敏反应较单纯单关节炎组致炎侧减轻,可维持至第14天,差异有统计学意义(P<0.01),但仍高于单关节炎+氢气0~14 d组健侧后爪,差异有统计学意义(P<0.01),见图 1B。单关节炎+氢气0~3 d组大鼠吸入65%氢气后致炎侧后爪的机械痛敏反应与单关节炎+氢气0~14 d组变化一致,与单纯单关节炎组致炎侧、单关节炎+氢气0~3 d组健侧的差异亦均有统计学意义(P<0.05,P<0.01;图 1C)。单关节炎+氢气4~14 d组大鼠致炎侧与健侧后爪的机械痛敏反应差异也有统计学意义(P<0.01),但与单纯单关节炎组致炎侧相比差异无统计学意义(P>0.05),见图 1D。
2.3 65%氢气吸入可减轻单关节炎大鼠的氧化应激大鼠脊髓氧化应激检测结果显示,65%氢气吸入可减轻单关节炎大鼠的氧化应激。造模后第10天,单关节炎组大鼠致炎侧脊髓组织中SOD和CAT水平较假手术+氢气0~14 d组降低(P<0.05),MDA水平升高(P<0.05);而单关节炎+氢气0~14 d组大鼠致炎侧脊髓组织中的SOD和CAT水平相比单关节炎组回升(P<0.05),MDA水平降低(P<0.05)。单关节炎+氢气0~3 d组和单关节炎+氢气4~14 d组大鼠致炎侧脊髓组织中SOD、CAT和MDA水平与单关节炎组相比差异均无统计学意义(P均>0.05)。见图 2。
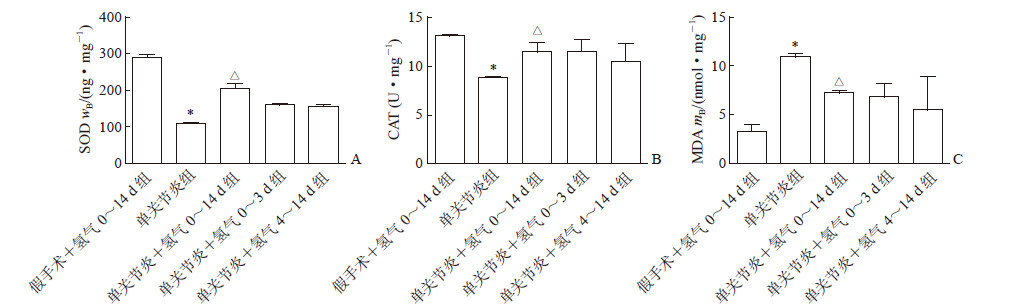
|
图 2 65%氢气吸入可减轻单关节炎大鼠的氧化应激 假手术+氢气0~14 d组、单关节炎+氢气0~14 d组、单关节炎+氢气4~14 d组大鼠吸入氢气均于第10天停止. SOD:超氧化物歧化酶; CAT:过氧化氢酶; MDA:丙二醛. *P<0.05与假手术+氢气0~14 d组比较; △P<0.05与单关节炎组比较. n=3, x±s |
3 讨论
分子氢可以在体内中和羟自由基而不产生其他自由基[9]。目前临床及基础研究采用的分子氢给药方式多为饱和氢气溶于生理盐水或低浓度吸入给药,而本实验采用经呼吸道给予65%高浓度的氢气,是一种方便快捷的给药方式,并且给药浓度不受氢气在水中溶解度的限制。本研究发现,相比单关节炎组大鼠,单关节炎+氢气0~14 d组大鼠机械痛敏减轻最明显,痛敏减轻可持续至术后第14天(P<0.01),单关节炎+氢气0~3 d组大鼠在造模后第3天停止给药后,痛敏减轻仍可维持,直至第14天(P<0.05),而单关节炎+氢气4~14 d组大鼠痛敏并无明显减轻,表明预先给予氢气可以防止单关节炎大鼠机械痛敏的形成。
正常状态下人体氧化磷酸化的过程中会产生少量活性氧,如超氧化物、过氧化氢和羟自由基等,但不会对人体产生危害,因人体内存在对活性氧的防御机制,体内的SOD、CAT和髓过氧化物酶等可以将其代谢为对人体无害的水等物质[10-11]。
当机体内存在慢性炎症时会产生过量的活性氧,一旦超出体内抗氧化酶的代谢能力,体内活性氧的代谢平衡即被打破,过量的活性氧会和生物膜发生脂质过氧化反应生成MDA等脂质过氧化产物,从而破坏细胞膜的通透性和流动性,最终对人体造成伤害[12]。本实验中单关节炎+氢气0~14 d组大鼠在造模后第10天致炎侧脊髓组织中SOD和CAT水平均高于单关节炎组(P 均<0.05),而MDA水平低于单关节炎组(P<0.05),表明氢气在单关节炎大鼠体内增加了体内抗氧化酶的含量,减少了MDA等脂质过氧化物的产生,这可能是氢气防止单关节炎大鼠机械痛敏形成的关键。
活性氧在类风湿性关节炎的发病过程中起着重要作用,其作用机制与放大核因子κB(nuclear factor κB,NF-κB)依赖的炎症级联放大反应有关[13-14]。发生类风湿性关节炎时,体内会产生过量活性氧,这些活性氧可以通过上调NF-κB活性打破活性氧的氧化还原平衡,然后上调的NF-κB可诱导白细胞介素1和肿瘤坏死因子α等炎性因子的转录,随后体内增多的炎性因子又可以再次募集中性粒细胞、巨噬细胞等从而产生更多的活性氧,而这些增多的活性氧又可进入上述循环进一步加重体内的氧化应激[1]。因此,治疗类风湿性关节炎的新方法必须注重减少患者体内及关节中的活性氧。在单关节炎形成早期,经呼吸道给予65%氢气可能抑制了NF-κB依赖的炎性因子的转录,从而大大减少了活性氧及其相关物质的生成,最终抑制痛觉敏化和减轻氧化应激反应;而在造模第4天给予65%氢气时,大鼠体内的炎症反应恶性循环已经形成,短时间吸入氢气并不能完全阻断这个循环,因此短时间吸入氢气对大鼠单关节炎症状的减轻作用并不明显。因条件有限,本实验只观察了吸入0~14 d氢气对大鼠单关节炎模型的作用,延长单次吸入氢气的时间及延长治疗时间是否可以改善单关节炎大鼠的氧化应激反应有待进一步探究。
本研究结果表明,在单关节炎发生早期给予65%氢气吸入可以减轻大鼠体内氧化应激,减少大鼠关节组织破坏,从而阻止机械痛敏的形成;而在单关节炎已经形成后,体内活性氧相关物质堆积过多,吸入氢气后近期效果不明显,可能需要比14 d更长时间的氢气吸入才能显现出其减轻机械痛敏及抗氧化的作用。本研究仍存在不足之处,未探究假手术组大鼠在未吸入氢气时体内的氧化应激水平,经呼吸道吸入氢气对单关节炎治疗作用的机制也需要更深入的探索。
| [1] |
ISHIBASHI T. Molecular hydrogen: new antioxidant and anti-inflammatory therapy for rheumatoid arthritis and related diseases[J]. Curr Pharm Des, 2013, 19: 6375-6381. DOI:10.2174/13816128113199990507 |
| [2] |
MCINNES I B, SCHETT G. The pathogenesis of rheumatoid arthritis[J]. N Engl J Med, 2011, 365: 2205-2219. DOI:10.1056/NEJMra1004965 |
| [3] |
MATEI N, CAMARA R, ZHANG J H. Emerging mechanisms and novel applications of hydrogen gas therapy[J]. Med Gas Res, 2018, 8: 98-102. DOI:10.4103/2045-9912.239959 |
| [4] |
OHSAWA I, ISHIKAWA M, TAKAHASHI K, WATANABE M, NISHIMAKI K, YAMAGATA K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13: 688-694. DOI:10.1038/nm1577 |
| [5] |
OHSAWA I, NISHIMAKI K, YAMAGATA K, ISHIKAWA M, OHTA S. Consumption of hydrogen water prevents atherosclerosis in apolipoprotein E knockout mice[J]. Biochem Biophys Res Commun, 2008, 377: 1195-1198. DOI:10.1016/j.bbrc.2008.10.156 |
| [6] |
KAJIYAMA S, HASEGAWA G, ASANO M, HOSODA H, FUKUI M, NAKAMURA N, et al. Supplementation of hydrogen-rich water improves lipid and glucose metabolism in patients with type 2 diabetes or impaired glucose tolerance[J]. Nutr Res, 2008, 28: 137-143. DOI:10.1016/j.nutres.2008.01.008 |
| [7] |
张瑶, 姜婧, 周海玥, 蒋芮, 李雅婷, 宋立华. 富氢水对结直肠癌荷瘤小鼠肿瘤的生长抑制作用及其机制[J]. 第二军医大学学报, 2016, 37: 1082-1087. ZHANG Y, JIANG J, ZHOU H Y, JIANG R, LI Y T, SONG L H. Inhibitory effects of hydrogen-rich water against tumor growth in tumor-bearing mice with colorectal cancer and the molecular mechanisms[J]. Acad J Sec Mil Med Univ, 2016, 37: 1082-1087. |
| [8] |
SUN S, CHEN W L, WANG P F, ZHAO Z Q, ZHANG Y Q. Disruption of glial function enhances electroacupuncture analgesia in arthritic rats[J]. Exp Neurol, 2006, 198: 294-302. DOI:10.1016/j.expneurol.2005.11.011 |
| [9] |
OHNO K, ITO M, ICHIHARA M, ITO M. Molecular hydrogen as an emerging therapeutic medical gas for neurodegenerative and other diseases[J/OL]. Oxid Med Cell Longev, 2012, 2012: 353152. doi: 10.1155/2012/353152.
|
| [10] |
TURRENS J F. Mitochondrial formation of reactive oxygen species[J]. J Physiol, 2003, 552(Pt 2): 335-344. |
| [11] |
DRÖGE W. Free radicals in the physiological control of cell function[J]. Physiol Rev, 2002, 82: 47-95. DOI:10.1152/physrev.00018.2001 |
| [12] |
SHEU S S, NAUDURI D, ANDERS M W. Targeting antioxidants to mitochondria: a new therapeutic direction[J]. Biochim Biophys Acta, 2006, 1762: 256-265. DOI:10.1016/j.bbadis.2005.10.007 |
| [13] |
LAWRENCE T, BEBIEN M, LIU G Y, NIZET V, KARIN M. IKKα limits macrophage NF-κB activation and contributes to the resolution of inflammation[J]. Nature, 2005, 434: 1138-1143. DOI:10.1038/nature03491 |
| [14] |
LEE E G, BOONE D L, CHAI S, LIBBY S L, CHIEN M, LODOLCE J P, et al. Failure to regulate TNF-induced NF-κB and cell death responses in A20-deficient mice[J]. Science, 2000, 289: 2350-2354. DOI:10.1126/science.289.5488.2350 |
 2019, Vol. 40
2019, Vol. 40


