2. 海军军医大学(第二军医大学)东方肝胆外科医院病理科, 上海 201805
2. Department of Pathology, Eastern Hepatobiliary Surgery Hospital, Naval Medical University(Second Military Medical University), Shanghai 201805, China
肾集合管癌(collecting duct renal cell carcinoma,CDRCC)又称Bellini管癌,是一种非常罕见且具有独特的临床和病理特征的肾细胞癌亚型,仅占肾细胞癌的0.4%~2.0%[1]。近10年报道的CDRCC最大样本量为95例[2]。与肾透明细胞癌起源于近端肾小管不同,CDRCC一般起源于远端肾小管上皮主细胞[3]。CDRCC属于恶性程度较高的肾小管上皮细胞肿瘤,临床预后差,易发生早期转移[4]。约有35%~40%的CDRCC患者发生远处转移,三分之二的患者在确诊2年内死亡[5]。CDRCC的生物学行为和病理特点与其他常见类型肾细胞癌不同,可获得的相关临床资料较少,患者治疗效果不佳、生存期较短,且病理形态上易被误诊为乳头状肾细胞癌或其他恶性肿瘤。CDRCC的临床决策主要以局部浸润和转移为主要参考依据,目前对CDRCC的预后评估仍然较为困难。本研究回顾分析了21例CDRCC患者的临床资料、病理学资料、手术情况、术后辅助治疗情况及随访资料,分析其临床诊治特点及预后情况。
1 资料和方法 1.1 研究对象回顾性分析2002年3月至2017年4月海军军医大学(第二军医大学)长海医院、长征医院和东方肝胆外科医院收治的6 950例肾癌患者资料,将其中经病理确诊为CDRCC的21例患者纳入本研究。本研究通过海军军医大学(第二军医大学)东方肝胆外科医院伦理委员会审批。
1.2 诊断标准按美国癌症联合委员会(American Joint Committee on Cancer,AJCC)[6]2016年TNM分期标准进行临床分期。以中华医学会泌尿外科学分会推荐的世界卫生组织2016年肾癌分类标准[7]作为病理诊断标准,诊断其为Bellini管癌,排除肾透明细胞癌、多房囊性肾细胞癌、乳头状肾细胞癌、肾嫌色细胞癌、肾髓样癌、Xp11.2异位性癌、神经母细胞瘤相关性肾细胞癌、黏液性小管状及梭形肾细胞癌、未分类的肾细胞癌等类型。以Fuhrman核分级系统进行病理分级[8]。
1.3 影像学检查所有患者均接受超声、计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)检查,明确肿瘤位置和大小。
1.4 治疗方法20例患者接受手术治疗,其中12例行腹腔镜下肾癌根治术,3例行腹腔镜下肾部分切除术,4例行开放性肾癌根治术,1例行右肾肿瘤根治性切除术+腔静脉癌栓取出术+下腔静脉滤器植入术。另外1例患者因全身状态差,与家属沟通后未进行手术,采取吉西他滨联合顺铂方案进行化学治疗。5例患者失访;5例患者术后6~9个月以内接受免疫治疗,方案为重组人白细胞介素2(125Ser)200万单位肌内注射,隔日1次;1例术后拒绝辅助治疗;5例术后辅助化学治疗,方案为吉西他滨1 000 mg/m2第1天和第8天静脉滴注,顺铂70 mg/m2第1、2、3天静脉滴注,3周为1个周期;4例患者术后接受肾癌靶向药物治疗(索拉非尼或舒尼替尼)。
1.5 术后随访术后2年内每3个月复查1次,包括中腹部CT平扫、泌尿系超声、肝胆胰脾超声、血尿常规、肝肾功能等检查。术后2年至5年每半年复查1次,每年至少进行1次胸部CT、肾脏增强CT等检查,每年进行电话随访1次,随访内容包括局部复发、远处转移及死亡情况。生存时间为术后第1天至末次随访或死亡的时间。
1.6 统计学处理应用SPSS 19.0软件进行统计学分析。计量资料如符合正态分布,则采用x±s表示;若不符合正态分布,则采用中位数表示。计数资料以例数和百分数表示。采用Kaplan-Meier法计算生存率。
2 结果 2.1 总体情况本组21例患者中,男18例、女3例;年龄为29~66岁,平均年龄为(55±13)岁。均为单侧发病,左侧7例、右侧14例。4例以肉眼血尿为首发症状,4例以腰痛为首发症状,1例腰部隐痛3个月伴低热1周就诊,经CT证实为肾脏占位性病变;12例为健康体检时经超声检查发现。20例患者行手术治疗,术后病理诊断为CDRCC。1例未手术的患者接受超声引导下穿刺活组织检查确诊为CDRCC。TNM分期Ⅰ期8例(38.1%)、Ⅱ期2例(9.5%)、Ⅲ期5例(23.8%)、Ⅳ期6例(28.6%),Fuhrman核分级Ⅰ级1例(4.8%)、Ⅱ级4例(19.0%)、Ⅲ级11例(52.4%)、Ⅳ级5例(23.8%)。
2.2 治疗情况20例行手术治疗患者均顺利完成手术,未出现术中并发症。另外1例未手术的患者接受超声引导下穿刺活组织检查,确诊后给予吉西他滨联合顺铂方案化学治疗,4个月后患者因多发转移而死亡。21例患者肿瘤最大径为2.4~8.5 cm,平均(5.6±1.7)cm;其中15例肿瘤最大径<7 cm,6例肿瘤最大径≥7 cm。2例接受术后6个月的免疫治疗,3例接受术后9个月的免疫治疗,2例接受舒尼替尼靶向治疗,2例接受索拉非尼靶向治疗;其中1例接受免疫治疗和1例服用索拉非尼的患者之后出现广泛腹膜后淋巴结转移。5例患者发生淋巴结转移。3例患者就诊时已有椎骨转移,其中2例伴腰大肌转移(1例椎骨转移伴腰大肌转移的患者给予索拉非尼400 mg口服、每日2次,因患者服用4个月后不良反应较大,遂减量服用,肿瘤未得到明显控制;1例椎骨转移伴腰大肌转移的患者给予免疫治疗联合化学治疗,患者不良反应大,2个月后中断治疗,失访)。1例为单纯椎骨转移(给予舒尼替尼50 mg口服、每日1次,按服药4周、停药2周方案规律服药,6个月后发生耐药,骨转移灶进一步增大)。2例患者发生全身多处转移伴腹水,给予化学治疗,1例3个月之内得到部分控制,另1例半年内得到部分控制、之后转移灶进一步增大。1例患者发生肺转移,持续服用舒尼替尼5个月后发生耐药,肺转移灶进一步增大、增多。
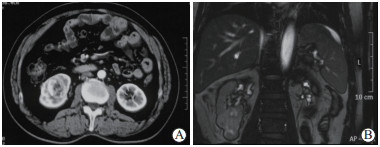
2.3 影像学表现所有患者均接受超声、CT或MRI检查。超声检查显示低回声肿块13例,中等偏高回声肿块8例。CT均提示肾占位性病变,多分布于上下两极,病变肾脏体积增大,轮廓欠光滑,肿块病灶边界欠清,呈浸润性生长;平扫显示肿块与周围肾组织边界不清,增强后呈不均匀强化(图 1A)。CT检查发现腹膜后广泛淋巴结转移2例,脊柱伴腰大肌转移2例。MRI显示肿物呈不规则混杂信号影,边界模糊(图 1B)。
|
图 1 CDRCC患者CT和MRI影像学资料 Fig 1 CT and MRI data of CDRCC patients A: CT showed that the tumor was located in the lower pole of the kidney, the size of the kidney increased, and the boundary was unclear. After enhancement, the mass was heterogeneously enhanced; B: MRI showed irregular mixed signal shadow and fuzzy boundary in the inferior pole of the kidney. CDRCC: Collecting duct renal cell carcinoma; CT: Computed tomography; MRI: Magnetic resonance imaging |
2.4 病理学特征
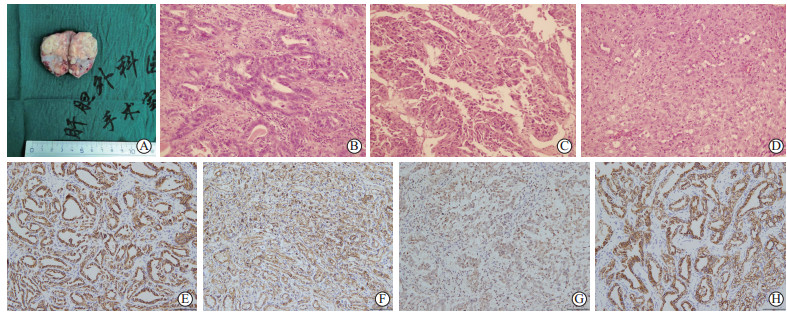
大体标本可见肿瘤切面呈灰白或灰黄色,实性,质中,浸润性生长(图 2A);病理结果显示肿瘤组织排列成不规则腺管状(图 2B)、乳头状(图 2C)、实性结构(图 2D);肿瘤细胞立方,部分呈鞋钉样,胞质嗜酸性,核大,核仁明显,异型性明显,间质可见大量纤维组织增生及炎症细胞浸润,部分区域可见砂粒体形成,分化较差的可伴有条索样或肉瘤样改变。免疫组织化学染色检查显示4例(19.0%)极低分子细胞角蛋白(very low molecular cytokeratin,CAM5.2)表达阳性(图 2E),4例(19.0%)肿瘤相关上皮膜抗原(tumor-associated epithelial membrane antigen,EMA)表达阳性(图 2F),5例(23.8%)配对盒基因8(paired box gene 8,PAX8)表达阳性(图 2G),3例(14.3%)细胞角蛋白7(cytokeratin 7,CK7)表达阳性(图 2H);3例(14.3%)碳酸酐酶Ⅸ(carbonic anhydrase Ⅸ,CAⅨ)表达阴性,2例(9.5%)原癌基因Ⅲ型跨膜酪氨酸激酶受体蛋白(proto-oncogene tyrosine-protein kinase kit,C-kit)表达阴性,2例(9.5%)GATA结合蛋白3(GATA binding protein 3,GATA-3)表达阴性,3例(14.3%)中性内肽酶(neutral endopeptidase,CD10)表达阴性,2例(9.5%)转化相关蛋白63(transformation-related protein 63,P63)表达阴性,2例(9.5%)细胞角蛋白20(cytokeratin 20,CK20)表达阴性。
|
图 2 CDRCC大体标本切面及病理学特征 Fig 2 Specimen section and pathological features of CDRCC A: On the section of the gross specimen, there were gray-white or gray-yellow solid masses in the capsule; B: The tumor tissue was arranged in irregular tubular structure; C: Tumor tissue was arranged in irregular papillary structure; D: Tumor tissue arranged in irregular solid structure; E: Positive expression of very low molecular cytokeratin (CAM5.2); F: Positive expression of tumor-associated epithelial membrane antigen (EMA); G: Positive expression of paired box gene 8 (PAX8); H: Positive expression of cytokeratin 7 (CK7). CDRCC: Collecting duct renal cell carcinoma. B-D: H-E staining; E-H: Immunohistochemical staining. Original magnification: ×200 |
2.5 预后情况
随访时间为4~87个月,平均(33.6±28.9)个月,5例患者失访。中位生存时间为39.1个月,1年总体生存率为71.5%,2年总体生存率为57.2%,5年总体生存率为44.5%。随访期间12例患者死亡,平均生存时间(32.2±27.5)个月。获得随访的16例患者一般资料及随访结果如表 1所示。
|
|
表 1 16例CDRCC患者一般资料及随访结果 Tab 1 General information and follow-up results of 16 CDRCC patients |
3 讨论
CDRCC被描述为一种有乳头状突起的囊性肾细胞癌,因囊壁被覆上皮似Bellini管又被称为Bellini上皮瘤[9-10]。1986年Fleming和Lewi[11]提出了CDRCC的诊断标准。由于病理特点与生物学行为与一般的肾细胞癌不同,CDRCC被认为是一种独立的组织学类型,目前世界卫生组织将其归属于肾细胞癌的独立类型,命名为Bellini管癌[12]。CDRCC非常少见,国外报道CDRCC患者仅占所有肾癌患者的0.4%~2.0%[1]。Cheville等[13]在对2 385例肾细胞癌患者进行组织学亚型统计时,发现仅有6例为CDRCC;Amin等[14]报道的405例成人肾上皮性肿瘤的组织学组成中,仅l例显示有CDRCC特征并伴有肉瘤样分化。
我们对海军军医大学(第二军医大学)长海医院、长征医院和东方肝胆外科医院三家医院6 950例肾癌患者进行回顾性分析,统计出21例(0.3%)CDRCC患者,该比例略低于国外报道[1]。但本研究是一项回顾性研究,无法对所有肾癌患者的病理组织切片进行集中评估,因此可能导致一些CDRCC被诊断为其他类型的肿瘤而丢失样本量。
本组21例CDRCC患者中,男18例、女3例,年龄为29~66岁,表现为男性患者多于女性,以青壮年为主,与既往报道[15]相符。CDRCC临床症状包括血尿、腹痛、腹块、消瘦等,这与其他肾肿瘤相似,影像学上有时提示为肾盂癌[15]。本组4例以肉眼血尿为首发症状,4例以腰痛为首发症状,1例腰痛伴发热,12例为健康体检时经超声检查发现。与常见的肾透明细胞癌、乳头状肾细胞癌、肾嫌色细胞癌相比,CDRCC具有高度侵袭性,通常起自肾髓质,向外可累及肾门,肿块较大时难于辨别其起源。当然,位于肾髓质的肿块并不意味着起源于集合管,位于中部的肿瘤也可来源于近端小管并向外累及肾窦脂肪组织,最终确诊仍依靠病理结果。大部分CDRCC切面灰白色、质硬、边界不清,很少囊性变。有时肿瘤邻近组织可出现梗死,可能与侵犯局部血供有关[15]。
2007年,Karakiewicz等[16]对41例CDRCC患者和5 246例肾透明细胞癌患者进行配对分析,结果显示CDRCC患者较肾透明细胞癌患者预后更差。Karakiewicz等[16]报道的CDRCC患者1年、5年、10年总体生存率分别为86.7%、48.3%、31.7%。在Tokuda等[17]的研究中,除了1例肺转移CDRCC患者对吉西他滨联合卡铂化学治疗有效,其余25例接受辅助疗法的远处转移CDRCC患者均无明显疗效,1年、3年、5年和10年肿瘤特异性生存率分别为69.0%、45.3%、34.3%和13.7%,明显低于常见的肾透明细胞癌。May等[2]通过对欧美16个医学中心的14 047例肾癌患者资料进行回顾性分析,发现95例CDRCC患者的1年、2年、5年和10年肿瘤特异性生存率分别为60.4%、47.3%、40.3%和32.8%。本组21例患者的1年、2年、5年总体生存率分别为71.5%、57.2%、44.5%,虽不如Karakiewicz等[16]的报道,但略好于其他报道。
Kwon等[18]对8个中心35例CDRCC患者资料进行回顾性分析,结果显示临床分期为Ⅰ~Ⅲ期的患者总体生存期为69.9个月,而Ⅳ期患者生存期仅为8.6个月,表明临床分期仍是决定CDRCC预后的重要因素。Vázquez-Lavista等[19]对2例CDRCC患者术后长期随访中发现,预后与分期关系紧密,低分期患者术后甚至可存活10年之久。May等[2]对95例CDRCC患者资料进行多元Cox模型分析,结果显示美国麻醉协会分级3~4级、肿瘤直径>7 cm、淋巴道和血行侵袭转移、Fuhrman分级Ⅲ~Ⅳ级和远处转移是肿瘤预后不佳的危险因素。本组资料6例Ⅳ期患者中有4例肿瘤直径>7 cm,6例均发生远处转移,且Fuhrman分级都在Ⅲ级以上。本组死亡的12例患者中,4例Ⅰ期患者总体生存期平均为66.5个月,6例Ⅳ期患者平均仅为10个月。Ⅳ期患者的生存期略好于Kwon等[18]的研究,但与Ⅰ期患者相比较差。因此早诊断、早治疗可能有助于使患者获得更好的预后。
Tokuda等[17]对日本281家医疗中心的81例CDRCC病例进行了回顾性分析,发现区域淋巴结转移达到44.2%,远处转移发生率达到32.1%。本研究发现淋巴结转移5例(23.8%),其中广泛腹膜后淋巴结转移2例(9.5%);骨转移3例(14.3%),其中伴随腰大肌转移2例(9.5%);全身多处转移2例(9.5%);肺转移1例(4.8%)。本组资料转移率虽低于Tokuda等[17]的报道,但仍然高于肾脏其他常见肿瘤[2]。可以认为相对于其他亚型的肾癌,CDRCC更易发生转移。
CDRCC的治疗仍以手术治疗为主。我们早年治疗CDRCC主要采用肾癌根治术,3例肾部分切除术均为近2年的患者,通过电话随访获患者基本情况良好,无局部复发。但由于样本量小,目前尚不能认为肾部分切除术治疗CDRCC的预后与肾癌根治术相当。由于CDRCC易发生转移,手术并不能完全达到理想的效果。Tokuda等[17]对49例术后接受辅助治疗的患者进行回顾性研究,17例接受化学治疗,3例接受放射治疗,34例接受免疫治疗(主要使用干扰素α、γ和白细胞介素2),结果显示仅有1例肺转移患者对吉西他滨联合卡铂有部分疗效、但对干扰素α耐药,其余转移和复发患者对辅助治疗均无明显疗效。也有极少数病例报告显示化学治疗和靶向治疗在CDRCC患者中获得部分应答[20-22]。以上研究说明化学治疗和靶向治疗对CDRCC的治疗效果尚不明确。Procopio等[23]对7例接受靶向治疗的CDRCC患者资料进行回顾性分析后认为,靶向药物在CDRCC中显示出一定的活性,需要深入研究找出CDRCC的生物标志物,从而总结出一套系统性靶向治疗方案。在本组资料中,由于样本量较小,且疾病进展快,无法全面比较哪种化学治疗或靶向治疗方案更好,但是我们赞同Chao等[24]的观点:在未发现最优化治疗方案之前,只有通过早期诊断才有可能最大程度改善患者预后。
总之,CDRCC是一种罕见的侵袭性较强的肾实质肿瘤,病程短,进展快,恶性程度高,易出现淋巴结和远处转移,预后不良;确诊的金标准是病理检查;目前主要治疗方法仍是手术,辅助治疗可以采用化学治疗和靶向治疗,但疗效有待进一步明确;不同临床分期的患者预后差异明显,因此早诊断、早治疗是CDRCC患者获得良好预后的关键。
| [1] |
KURODA N, TOI M, HIROI M, ENZAN H. Review of collecting duct carcinoma with focus on clinical and pathobiological aspects[J]. Histol Histopathol, 2002, 17: 1329-1334. |
| [2] |
MAY M, FICARRA V, SHARIAT S F, ZIGEUNER R, CHROMECKI T, CINDOLO L, et al. Impact of clinical and histopathological parameters on disease specific survival in patients with collecting duct renal cell carcinoma:development of a disease specific risk model[J]. J Urol, 2013, 190: 458-463. |
| [3] |
VERDORFER I, CULIG Z, HOBISCH A, BARTSCH G, HITTMAIR A, DUBA H C, et al. Characterisation of a collecting duct carcinoma by cytogenetic analysis and comparative genomic hybridisation[J]. Int J Oncol, 1998, 13: 461-464. |
| [4] |
PEYROMAURE M, THIOUNN N, SCOTTÉ F, VIEILLEFOND A, DEBRÉ B, OUDARD S. Collecting duct carcinoma of the kidney:a clinicopathological study of 9 cases[J]. J Urol, 2003, 170(4 Pt 1): 1138-1140. |
| [5] |
MATZ L R, LATHAM B I, FABIAN V A, VIVIAN J B. Collecting duct carcinoma of the kidney:a report of three cases and review of the literature[J]. Pathology, 1997, 29: 354-359. |
| [6] |
WILLIAMSON S R, TANEJA K, CHENG L. Renal cell carcinoma staging:pitfalls, challenges, and updates[J]. Histopathology, 2019, 74: 18-30. |
| [7] |
ZIMPFER A, GLASS Ä, ZETTL H, MARUSCHKE M, HAKENBERG O W, ERBERSDOBLER A. [Renal cell carcinoma diagnosis and prognosis within the context of the WHO classification 2016][J]. Urologe A, 2019, 58: 1057-1065. |
| [8] |
MOCH H. [The WHO/ISUP grading system for renal carcinoma][J]. Pathologe, 2016, 37: 355-360. DOI:10.1007/s00292-016-0171-y |
| [9] |
KENNEDY S M, MERINO M J, LINEHAN W M, ROBERTS J R, ROBERTSON C N, NEUMANN R D. Collecting duct carcinoma of the kidney[J]. Hum Pathol, 1990, 21: 449-456. |
| [10] |
JHORAWAT R, BENIWAL P, MALHOTRA V. Can analgesic-abuse nephropathy is a fertile groundfor for rare collecting duct (Bellini duct) renal cell carcinoma or merely a coincidence?[J]. Indian J Pharm Sci, 2016, 78: 159-161. DOI:10.4103/0250-474X.180245 |
| [11] |
FLEMING S, LEWI H J. Collecting duct carcinoma of the kidney[J]. Histopathology, 1986, 10: 1131-1141. |
| [12] |
LOPEZ-BELTRAN A, SCARPELLI M, MONTIRONI R, KIRKALI Z. 2004 WHO classification of the renal tumors of the adults[J]. Eur Urol, 2006, 49: 798-805. |
| [13] |
CHEVILLE J C, LOHSE C M, ZINCKE H, WEAVER A L, BLUTE M L. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma[J]. Am J Surg Pathol, 2003, 27: 612-624. DOI:10.1097/00000478-200305000-00005 |
| [14] |
AMIN M B, AMIN M B, TAMBOLI P, JAVIDAN J, STRICKER H, DE-PERALTA VENTURINA M, et al. Prognostic impact of histologic subtyping of adult renal epithelial neoplasms:an experience of 405 cases[J]. Am J Surg Pathol, 2002, 26: 281-291. DOI:10.1097/00000478-200203000-00001 |
| [15] |
SUI W, MATULAY J T, ROBINS D J, JAMES M B, ONYEJI I C, ROYCHOUDHURY A, et al. Collecting duct carcinoma of the kidney: disease characteristics and treatment outcomes from the National Cancer Database[J/OL]. Urol Oncol, 2017, 35: 540.e13-540.e18. doi: 10.1016/j.urolonc.2017.04.010. https://www.ncbi.nlm.nih.gov/pubmed/28495554
|
| [16] |
KARAKIEWICZ P I, TRINH Q D, RIOUX-LECLERCQ N, DE LA TAILLE A, NOVARA G, TOSTAIN J, et al. Collecting duct renal cell carcinoma:a matched analysis of 41 cases[J]. Eur Urol, 2007, 52: 1140-1145. |
| [17] |
TOKUDA N, NAITO S, MATSUZAKI O, NAGASHIMA Y, OZONO S, IGARASHI T; Japanese Society of Renal Cancer. Collecting duct (Bellini duct) renal cell carcinoma:a nationwide survey in Japan[J]. J Urol, 2006, 176: 40-43. |
| [18] |
KWON K A, OH S Y, KIM H Y, KIM H S, LEE H Y, KIM T M, et al. Clinical features and treatment of collecting duct carcinoma of the kidney from the korean cancer study group genitourinary and gynecology cancer committee[J]. Cancer Res Treat, 2014, 46: 141-147. |
| [19] |
VÁZQUEZ-LAVISTA L G, URIBE-URIBE N, GABILONDO-NAVARRO F. Collecting duct renal cell carcinoma:two different clinical stages, two different clinical outcomes[J]. Urol Int, 2008, 81: 116-118. DOI:10.1159/000137652 |
| [20] |
BAGRODIA A, GOLD R, HANDORF C, LIMAN A, DERWEESH I H. Salvage paclitaxel chemotherapy for metastatic collecting duct carcinoma of the kidney[J]. Can J Urol, 2008, 15: 4425-4427. |
| [21] |
ANSARI J, FATIMA A, CHAUDHRI S, BHATT R I, WALLACE M, JAMES N D. Sorafenib induces therapeutic response in a patient with metastatic collecting duct carcinoma of kidney[J]. Onkologie, 2009, 32(1/2): 44-46. |
| [22] |
MIYAKE H, HARAGUCHI T, TAKENAKA A, FUJISAWA M. Metastatic collecting duct carcinoma of the kidney responded to sunitinib[J]. Int J Clin Oncol, 2011, 16: 153-155. |
| [23] |
PROCOPIO G, VERZONI E, IACOVELLI R, COLECCHIA M, TORELLI T, MARIANI L. Is there a role for targeted therapies in the collecting ducts of Bellini carcinoma? Efficacy data from a retrospective analysis of 7 cases[J]. Clin Exp Nephrol, 2012, 16: 464-467. |
| [24] |
CHAO D, ZISMAN A, PANTUCK A J, GITLITZ B J, FREEDLAND S J, SAID J W, et al. Collecting duct renal cell carcinoma:clinical study of a rare tumor[J]. J Urol, 2002, 167: 71-74. |
 2019, Vol. 40
2019, Vol. 40


