2. 西部战区疾病预防控制中心, 成都 610021;
3. 成都中医药大学医学技术学院, 成都 610075
2. Center for Disease Control and Prevention of Western Theater Command of PLA, Chengdu 610021, Sichuan, China;
3. College of Medical Technology, Chengdu University of Traditional Chinese Medicine, Chengdu 610075, Sichuan, China
2017年冬季至2018年春季,我国南北方均进入流感冬季流行高峰季节,该流行季期间医院报告的门急诊流感样病例比例高于之前3年同期水平,流感病毒检测阳性率达往年高峰水平,特别是乙型流感病毒(influenza B virus,FluB)在流感流行季造成了严重危害[1]。乙型流感病毒是一种季节性流感病毒,分为Yamagata系(BY系)和Victoria系(BV系)2个谱系,代表毒株分别为Influenza B/Yamagata/16/88(GenBank No. M36105)和Influenza B/Victoria/2/87(GenBank No. M58428)[2]。根据中国国家流感中心网站信息显示,当前我国流行的乙型流感病毒以Yamagata系为主[3]。
乙型流感病毒感染症状有发热、畏寒、咽痛伴头痛等上呼吸道感染症状[4],在抵抗力较差的老年人和低龄儿童中易造成肌体损伤、肺炎等[5]。目前我国的流感疫苗为三联苗,组分包括甲型H1、甲型H3和乙型Victoria系3个毒株,不含乙型Yamagata系毒株[6]。鉴于上一个流感流行季乙型流感病毒的严重危害,世界卫生组织(World Health Organization,WHO)在发布的北半球2018—2019年度季节性流感疫苗推荐组分中优先推荐四价流感疫苗组分,相比往年的三价流感疫苗,新增了乙型Yamagata系B/Phuket/3073/2013类似毒株[7]。
血凝素(hemagglutinin,HA)是流感病毒表面的一种糖蛋白,负责使病毒与宿主细胞膜上的唾液酸受体结合,同时也是诱导机体产生中和抗体的重要靶标,HA的变异可引起流感病毒抗原性改变,从而逃避宿主免疫[8],对其基因序列的持续监测也是各个国家流感监测的主要任务。本研究拟对2017年冬季流感流行期驻成都某部一起乙型流感感染疫情的毒株序列进行测定,并对其HA基因关键位点进行分析,以揭示成都地区乙型流感病毒的变异特点,为今后该地区部队疫情防控提供指导。
1 材料和方法 1.1 试剂PureLinkTM病毒RNA/DNA小量提取试剂盒购自赛默飞世尔科技(中国)有限公司;引物、反转录GoldenstarTM RT6 cDNA合成试剂盒、高保真DNA聚合酶I5-MIX购自成都擎科梓熙生物技术有限公司;FastKing一步法qRT-PCR试剂盒购自天根生化科技(北京)有限公司;乙型流感病毒核蛋白单克隆抗体(B017)购自艾博抗(上海)贸易有限公司;FITC标记的山羊抗小鼠免疫球蛋白G(immunoglobulin,IgG)购自上海碧云天生物技术有限公司;生化试剂及耗材购自生工生物工程(上海)股份有限公司。
1.2 病例及咽拭子标本咽拭子标本采集于西部战区总医院呼吸道感染病例,男性,26岁,为驻成都某部战士,发热3 d,伴有咳嗽、咽痛等症状,于2017年11月23日收治入院。入院后血常规及生物化学指标检测显示白细胞计数(4.97×109/L)无显著升高,淋巴细胞比例(0.497)升高,超敏C-反应蛋白(4.28 mg/L)处在正常值范围。采集咽拭子标本,编号20171123,用PureLinkTM病毒RNA/DNA小量提取试剂盒提取病毒核酸,具体操作参照说明书进行,经qRT-PCR检测筛查呼吸道感染病毒,结果显示为乙型流感病毒。
1.3 呼吸道病毒qRT-PCR检测以咽拭子提取的病毒核酸为模板,采用qRT-PCR方法检测甲型流感病毒(influenza A virus,FluA)、乙型流感病毒和人腺病毒(human adenovirus,HAdV)。反应条件:42 ℃ 20 min;95 ℃ 1 min;94 ℃ 5 s,55 ℃ 10 s,72 ℃ 11 s,40个循环。所用引物和探针序列:FluA-F为5'-GAC CRA TCC TGT CAC CTC TGA C-3',FluA-R为5'-AGG GCA TTY TGG ACA AAK CGT CTA CG-3',FluA-probe为5'-FAM-TGC AGT CCT CGC TCA CTG GGC ACG-BHQ1-3';FluB-F为5'-TCC TCA ACT CAC TCT TCG AGC G-3',FluB-R为5'-CGG TGC TCT TGA CCA AAT TGG-3',FluB-probe为5'-FAM-CCA ATT CGA GCA GCT GAA ACT GCG GTG-BHQ1-3';HAdV-F为5'-TTT GAG GTY GAY CCC ATG GA-3',HAdV-R为5'-AGA ASG GTG TRC GCA GGT A-3',HAdV-probe为5'-FAM-ACC ACG TCG AAR ACT TCG AA-BHQ1-3'。
1.4 病原分离将犬肾上皮细胞(Madin-Darby canine kidney cell,MDCK细胞;购自中国科学院典型培养物保藏委员会细胞库)接种于6孔板,密度为1×108个/孔,用含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基于5% CO2孵箱中培养24 h。第2天先无菌化处理咽拭子标本,在1 000 μL咽拭子标本中加入20 μL双抗,4 ℃条件下孵育2 h;细胞用磷酸盐缓冲液(phosphate buffer solution,PBS)洗3遍,将处理好的咽拭子标本加到细胞上,35 ℃孵箱吸附2 h;更换为2 mL病毒生长液(0.2% BSA、1%青/链霉素、25 mmol/L HEPES、2 μg/mL TPCK-胰酶);35 ℃、5% CO2孵箱中培养,持续观察细胞病变。待80%细胞产生病变时,收集上清,分装保存于-80 ℃冰箱。
1.5 免疫荧光检测将MDCK细胞接种于96孔板,密度为1.5×104个/孔,用含10% FBS的DMEM培养基于5% CO2孵箱中培养24 h;接种分离的毒株,感染计量设置10倍倍比梯度稀释,感染后24 h弃上清,PBS洗1次,加甲醇100 μL/孔,-20 ℃固定20 min;PBS洗1次,加3% BSA 100 μL/孔,室温封闭2 h;PBS洗1次,将一抗(乙型流感病毒核蛋白单克隆抗体)用1% BSA进行1︰1 000比例稀释,加稀释后的一抗100 μL/孔,室温孵育2 h;PBS洗3次,加稀释后的二抗(FITC标记的山羊抗小鼠IgG,1︰200比例稀释)100 μL/孔,室温避光孵育30 min;PBS洗2次,荧光显微镜下观察拍照。
1.6 HA全长基因PCR扩增提取感染病例咽拭子及其分离毒株的核酸,采用反转录试剂盒制备cDNA,操作按照试剂盒说明书进行。采用高保真酶PCR反应扩增乙型流感病毒HA基因。反应体系:I5-MIX 25 μL,上游引物FluB HA-F 1 μL,下游引物FluB HA-R 1 μL,无菌纯水21 μL,模板cDNA 2 μL,混匀。PCR反应条件:98 ℃ 3 min;98 ℃ 10 s,55 ℃ 15 s,72 ℃ 60 s,30个循环;72 ℃ 5 min。引物序列为FluB HA-F:5'-ATG AAG GCA ATA ATT GTA C-3',FluB HA-R:5'-TTA TAG ACA GAT GGA GCA TGA AAC-3',产物长度为1 755 bp。PCR产物利用1%琼脂糖凝胶电泳判断结果,由成都擎科梓熙生物技术有限公司进行测序。
1.7 HA基因序列分析将获得的HA 基因序列通过美国国家生物信息中心(National Center for Biotechnology Information,NCBI)在线BLAST系统(http://www.ncbi.nlm.nih.gov/BLAST)进行分析,下载GenBank数据库中与之相近的序列,通过DNAMAN和MEGA 6.06软件对其序列进行比对,分析此次感染的乙型流感病毒HA基因的突变特点。
1.8 系统发育进化树构建从GenBank数据库下载乙型流感病毒HA 基因序列,采用邻位相连法(neighbor-joining)构建系统发育进化树,通过自举分析(bootstrap)进行置信度检测,自举数据集为1 000次,构建系统发育进化树。
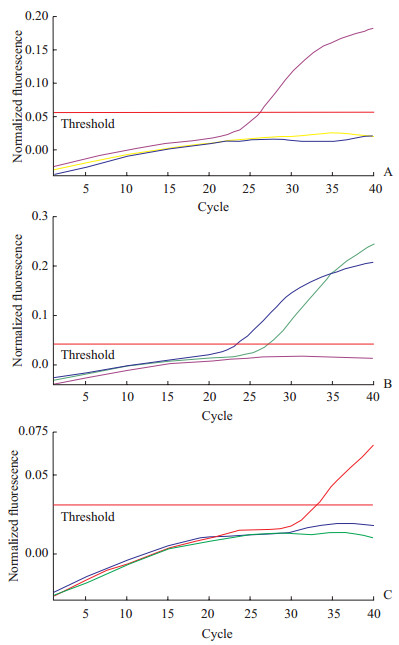
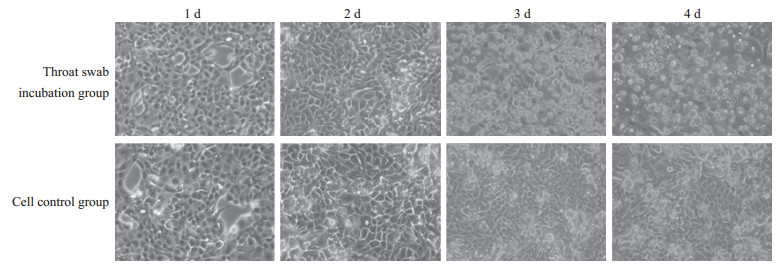
2 结果 2.1 呼吸道病毒检测及病原分离对咽拭子核酸进行常见的呼吸道病原体qRT-PCR检测,结果如图 1所示,甲型流感病毒和人腺病毒通用引物均未出现扩增曲线,而乙型流感病毒出现扩增曲线,初步提示该病例感染的病原体为乙型流感病毒。为进一步确证,采用MDCK细胞对咽拭子进行病原分离。咽拭子接种3 d后细胞出现明显病变效应,接种4 d后90%的细胞死亡,对照组细胞生长状态良好(图 2)。收集细胞上清,进行梯度稀释,感染MDCK细胞后24 h通过免疫荧光检测细胞内乙型流感病毒核蛋白表达情况,在感染的细胞内可检测到大量乙型流感病毒核蛋白的表达,分离的病毒在稀释1 000倍时仍能感染较多细胞(图 3)。
|
图 1 咽拭子中呼吸道病原体的qRT-PCR检测 Fig 1 qRT-PCR detection of respiratory pathogens in throat swabs A: Influenza A virus; B: Influenza B virus; C: Human adenovirus |
|
图 2 乙型流感病毒的分离培养 Fig 2 Isolation and incubation of influenza B virus Original magnification: ×100 |

|
图 3 免疫荧光检测乙型流感病毒感染的MDCK细胞内核蛋白表达 Fig 3 Immunofluorescence detection of nucleoprotein expression in MDCK cells infected with influenza B virus MDCK: Madin-Darby canine kidney. Original magnification: ×100 |
以感染病例咽拭子和分离毒株提取的病毒核酸为模板,均可扩增出大小为1 755 bp的目的片段(图 4),二者测序序列一致,提交至GenBank数据库,获得GenBank登录号为MH236281。

|
图 4 乙型流感病毒HA基因PCR产物电泳图 Fig 4 Electrophoresis of PCR product of the influenza B HA gene HA: Hemagglutinin; M: Marker; 1: Throat swab nucleic acid as template; 2: Isolated virus strain nucleic acid as template |
2.2 乙型流感病毒HA基因系统发育进化树
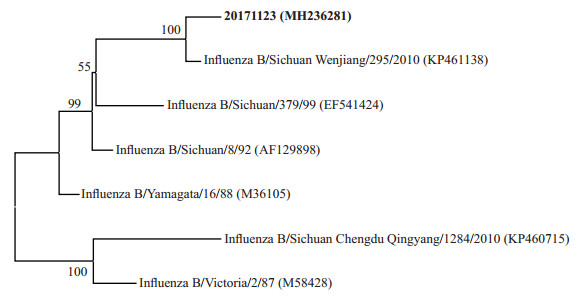
利用HA基因核酸序列构建系统发育进化树,结果如图 5所示,本研究感染病例HA基因(GenBank No. MH236281)与Yamagata系的代表毒株Influenza B/Yamagata/16/88(GenBank No. M36105)处在相同的进化分支上,而与Victoria系的代表毒株Influenza B/Victoria/2/87(GenBank No. M58428)处在不同分支上,说明此次感染的乙型流感病毒为Yamagata系。
|
图 5 基于HA基因的系统发育进化树 Fig 5 Phylogenetic evolutionary tree based on the HA gene The 20171123 (MH236281) is the sequence obtained in this study. The numbers in parentheses indicate the accession number in GenBank. The number at each branch points is the percentage supported by bootstrap. Bar: 0.01 sequence divergence. HA: Hemagglutinin |
2.3 基因变异位点分析
为进一步分析此次感染的Yamagata系毒株HA基因的变异特点,利用MEGA 6.06软件比对往年四川分离株及WHO推荐的疫苗株HA核酸序列的差异,结果如表 1所示。Influenza B/Utah/08/2014(GenBank No. KU592766)为WHO推荐的北半球乙型流感病毒代表毒株之一,病例HA基因与之相比,发生了20个碱基的点突变;与Yamagata系的代表毒株Influenza B/Yamagata/16/88(GenBank No. M36105)相比,点突变碱基达到57个;与1992年和1999年四川地区流行的乙型流感毒株相比,均发生了较多位点的碱基突变;与2010年四川温江的分离株相比,有17个碱基发生突变,说明此次分离的毒株已发生多处碱基突变。
|
|
表 1 乙型流感病毒代表毒株HA全长基因核苷酸序列变异位点 Tab 1 Variation sites of influenza B virus HA full-length gene nucleotide sequences |
进一步对其HA1的氨基酸序列进行比对,结果如表 2所示。与四川地区往年流行株相比均发生了不同程度的突变,其中与2010年四川温江的分离株相比突变位点较少,仅有4处点突变。
|
|
表 2 乙型流感病毒毒株HA1区氨基酸变异位点比较 Tab 2 Comparison of amino acid variation sites in the HA1 region of influenza B virus |
与WHO推荐的疫苗株Influenza B/Utah/08/2014(GenBank No. KU592766)相比,有2个氨基酸位点发生了变异,分别为L176Q和M255V,这2个位点均不在乙型流感病毒HA1上的抗原决定簇区域内。值得一提的是,HA1的176位点是一个全新的突变,以往四川流行毒株、Yamagata系的代表毒株Influenza B/Yamagata/16/88 (GenBank No.M36105)及WHO推荐的疫苗株Influenza B/Utah/08/2014(GenBank No. KU592766)的HA1 176位点均为亮氨酸(leucine,L),而本研究病例感染的乙型流感毒株HA1 176位点突变为谷氨酰胺(glutamine,Q),其突变意义仍有待深入研究。
3 讨论据WHO估计,每年约有10亿人感染流感病毒[9],其已成为危害人类健康的一大公共卫生问题。接种疫苗是预防流感的最有效方法,但由于流感病毒毒株的变化、抗原漂移及免疫减弱等原因,上一个流感季接种的疫苗在未来不一定具有预防效果,因此WHO每年都会公布下一个流感季推荐疫苗株。
流感病毒分为甲(A)、乙(B)、丙(C)3型,其中乙型流感病毒属正黏病毒科,有包膜结构,基因组为分段的负链RNA[10]。乙型流感病毒仅在人类中传播,无亚型[11],但有报道称在海豹体内分离出了乙型流感病毒[12]。首次分离出的乙型流感病毒株为B/Lee/40[13]。目前,流行的乙型流感毒株分为2个谱系:B/Victoria/2/87系和B/Yamagata/16/88系[2]。尽管缺乏亚型,乙型流感病毒通过遗传重组在不同谱系的共循环株中进行抗原性变异,并从累积突变中获得抗原漂移。2017年冬季至2018年春季,我国南北方均暴发了Yamagata系乙型流感病毒导致的流感,在全国大范围流行并造成了较大危害[1]。
本研究中,我们对驻成都某部2017年冬季一起乙型流感病毒感染的毒株HA基因进行了系统分析,通过构建系统发育进化树,发现此次感染的毒株属于Yamagata系,但通过基因位点分析,其与Yamagata系的原始毒株B/Yamagata/16/88对比已发生了较多变异,与四川地区以往流行的Yamagata系毒株也发生了不同程度的变异。但可以看出与最近流行的Yamagata系毒株序列比较相近,突变位点相对较少。
近日,WHO正式发布了2018—2019年度北半球季节性流感疫苗推荐组分[7],与2017—2018年度北半球流感季节的疫苗组分相比,除了B/Victoria系病毒组分和A(H3N2)亚型病毒组分有更新外,WHO首次优先给出了四价流感疫苗的组分。这一改变的原因可能是由于上一个流感流行季Yamagata系乙型流感病毒造成了严重危害。本研究中感染病例的乙型流感病毒HA基因与WHO推荐的最新的疫苗株相比,HA1氨基酸位点只发生了2处点突变,而且均没有处于HA1抗原决定簇区域,说明最新的四价流感疫苗对成都地区流行的Yamagata系病毒具有预防效果。
另外需要指出的是,本研究中感染病例的乙型流感病毒HA1 176位点处产生了1个全新的突变,以往流行株大多为亮氨酸(L),而本研究病例感染的乙型流感毒株HA1 176位点突变为谷氨酰胺(Q),该突变对乙型流感病毒感染特性和抗原特性的改变仍有待进一步研究。
| [1] |
周密, 李雷雷, 毛晨梅, 胡必杰. 今年我国流感流行的深度解析[J]. 中华医院感染学杂志, 2018, 28: 631-635. |
| [2] |
ROTA P A, WALLIS T R, HARMON M W, ROTA J S, KENDAL A P, NEROME K. Cocirculation of two distinct evolutionary lineages of influenza type B virus since 1983[J]. Virology, 1990, 175: 59-68. |
| [3] |
中国国家流感中心.中国流感流行情况概要(截至2018年2月25日)[EB/OL]. (2018-03-06)[2018-05-20]. http://www.chinaivdc.cn/cnic/zyzx/lgzb/201803/t20180306_159451.htm.
|
| [4] |
BUI C H T, CHAN R W Y, NG M M T, CHEUNG M C, NG K C, CHAN M P K, et al. Tropism of influenza B viruses in human respiratory tract explants and airway organoids[J/OL]. Eur Respir J, 2019, 54(2). pii: 1900008. doi: 10.1183/13993003.00008-2019.
|
| [5] |
FRANK H, WITTEKIND C, LIEBERT U G, SIEKMEYER M, SIEKMEYER W, SCHUSTER V, et al. Lethal influenza b myocarditis in a child and review of the literature for pediatric age groups[J]. Infection, 2010, 38: 231-235. |
| [6] |
[s.n.]. Recommended composition of influenza virus vaccines for use in the 2017-2018 northern hemisphere influenza season[J]. Wkly Epidemiol Rec, 2017, 92: 117-128. |
| [7] |
World Health Organization. Recommended composition of influenza virus vaccines for use in the 2018-2019 northern hemisphere influenza season)[EB/OL]. (2018-02-22)[2018-05-20]. https://www.who.int/influenza/vaccines/virus/recommendations/2018_19_north/en/.
|
| [8] |
CHEN J R, MA C, WONG C H. Vaccine design of hemagglutinin glycoprotein against influenza[J]. Trends Biotechnol, 2011, 29: 426-434. |
| [9] |
GHEBREHEWET S, MACPHERSON P, HO A. Influenza[J/OL]. BMJ, 2016, 355: i6258. doi: 10.1136/bmj.i6258.
|
| [10] |
CRUNKHORN S. Infectious disease: fighting influenza B[J/OL]. Nat Rev Drug Discov, 2017, 16: 828. doi: 10.1038/nrd.2017.234. https://www.nature.com/articles/nrd.2017.234
|
| [11] |
NEROME R, HIROMOTO Y, SUGITA S, TANABE N, ISHIDA M, MATSUMOTO M, et al. Evolutionary characteristics of influenza B virus since its first isolation in 1940:dynamic circulation of deletion and insertion mechanism[J]. Arch Virol, 1998, 143: 1569-1583. |
| [12] |
OSTERHAUS A D, RIMMELZWAAN G F, MARTINA B E, BESTEBROER T M, FOUCHIER R A. Influenza, virus in seals[J]. Science, 2000, 288: 1051-1053. |
| [13] |
KRYSTAL M, ELLIOTT R M, BENZ E W Jr, YOUNG J F, PALESE P. Evolution of influenza A and B viruses:conservation of structural features in the hemagglutinin genes[J]. Proc Natl Acad Sci USA, 1982, 79: 4800-4804. |
 2019, Vol. 40
2019, Vol. 40


