2. 同济大学附属上海市第十人民医院内分泌与代谢科, 上海 200072;
3. 同济大学附属上海市肺科医院胸外科, 上海 200433
2. Department of Endocrinology and Metabolism, Shanghai Tenth People's Hospital, Tongji University, Shanghai 200072, China;
3. Department of Thoracic Surgery, Shanghai Pulmonary Hospital, Tongji University, Shanghai 200433, China
当今世界肺癌是最主要的恶性肿瘤之一,预后差[1]。全球有94个国家的男性第一高发肿瘤是肺癌,其中17个国家的肺癌同时也是女性第一高发的恶性肿瘤[2]。美国癌症协会的数据显示,支气管肺癌在2017年的新发病例数为男性22.25万例、女性15.587万例,为第一高发恶性肿瘤[3]。
根据病理类型,肺癌分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),后者又可进一步分为腺癌、鳞状细胞癌、大细胞癌及其他特殊类型,其中以腺癌和鳞状细胞癌最常见。在所有的肺癌病理类型中,以SCLC的侵袭性最高,具有增殖快、分化程度低等特点,且临床上最容易出现早期远处转移,患者生存时间最短,预后最差。有报道称约40%的肺癌患者在诊断初期就伴随着远处转移[4],ⅣA期患者5年生存率为10%,ⅣB期为0[5]。在最新发布的美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版TNM分期中,对肺癌的M分期作了进一步修订,虽然与第7版的分期一样,也将就诊时具有远处转移的患者定义为M1,但进一步的分期更为细致,M1a仅代表肺内转移,不累及胸腔以外器官;M1b代表胸腔外单器官单灶受累;M1c代表胸腔外单器官多灶转移或多器官转移[6]。而第7版分期中只要具有胸腔外受累均定义为M1b。新版分期的修改旨在区分胸腔外单器官单灶转移与单器官多灶转移或多器官转移之间的预后差异。
有研究报道肺癌合并肝脏转移的患者生存时间短[7],局限在胸腔转移(M1a)的肺癌有较好的预后[8],但目前尚缺少大样本的相关研究。另外,在诊断时就合并远处转移的肺癌患者,其不同器官转移对临床预后的影响尚不明确[9]。本研究拟利用美国监测、流行病学及终点事件(surveillance, epidemiology, and end results,SEER)数据库筛选出大样本SCLC患者资料并进行统计分析,研究不同器官的远处转移对SCLC临床预后的影响。
1 资料和方法 1.1 资料来源本研究数据来源于2010—2013年SEER数据库[10]。排除标准:同时患有两种原发性肿瘤的患者;病理类型不明确或混合其他病理类型;临床信息或随访资料不完整的患者。最终筛选出10 347例SCLC患者纳入研究,中位随访时间为4(1,9)个月,中位年龄为67(60,74)岁。所纳入的患者在确诊时均有远处转移,均为M1期,进一步根据患者有无骨、脑、肝、肺转移及这4个器官中任意2个或2个以上器官转移进行分组:none组(有远处转移,但无上述4个器官转移)、骨转移组(上述4个大器官中仅有骨转移)、脑转移组(上述4个大器官中仅有脑转移)、肝转移组(上述4个大器官中仅有肝转移)、肺转移组(上述4个大器官中仅有肺内部转移)、多器官转移(multi-organ metastasis,MOM)组(上述4个器官中有任意2个或2个以上器官转移)。
1.2 统计学处理应用SPSS 18.0软件进行统计学分析。年龄和随访时间采用中位数(下四分位数,上四分位数)表示,计数资料用例数和百分数表示,组间比较采用χ2检验。不同远处转移肿瘤的生存分析采用Kaplan-Meier生存曲线法,以log-rank检验对组间差异进行分析。采用Cox回归分析研究不同器官远处转移对肿瘤特异性死亡的风险比(hazard ratio,HR),并对性别、年龄和肿瘤大小进行校正。双侧检验,检验水准(α)为0.05。
2 结果 2.1 患者的一般临床资料见表 1。MOM为最常见,占32.8%(3 396/10 347),其次为肝转移,占19.0%(1 971/10 347),骨转移占10.0%(1 033/10 347),脑转移占12.1%(1 251/10 347)。6组患者人种比例白色人种均占80%以上,除none组和肺转移组,其余4组均男性多于女性。各组患者年龄差别无统计学意义。肝转移组和MOM组随访时间短于其他4组。
|
|
表 1 10 347例SCLC患者的一般临床资料 |
2.2 不同器官远处转移对SCLC预后的影响
如表 2所示,肝转移组死亡率最高。将none组作为对照组,采用Cox回归分析,校正性别、年龄和肿瘤大小后肝转移组和MOM组死亡HR最高。将肝转移作为对照组,MOM组未增加死亡风险。进一步剔除MOM组中肝转移患者,未校正之前HR [95%置信区间(confidence interval,CI)]为0.88(0.80~0.97,P=0.011),但校正性别、年龄和肿瘤大小后,HR(95% CI)为0.95(0.85~1.07,P=0.39),由此可见,肝转移组与MOM组HR差异无统计学意义。在校正年龄、性别、肿瘤大小的基础上,增加人种的校正后,HR(95% CI)无明显改变。
|
|
表 2 不同器官远处转移对SCLC预后的影响 |
2.3 不同器官转移SCLC患者Kaplan-Meier生存分析
将SCLC特异性死亡作为终点事件,进行Kaplan-Meier生存分析,结果见图 1。随着时间的延长,6组患者生存率均下降,其中以肝转移组和MOM组下降最为明显,且两组之间差异无统计学意义(P=0.5);骨转移组次之,但低于脑转移组、肺转移组和none组;肺转移组和脑转移组具有相似的生存率(P=0.9),低于none组,但高于其他3组。
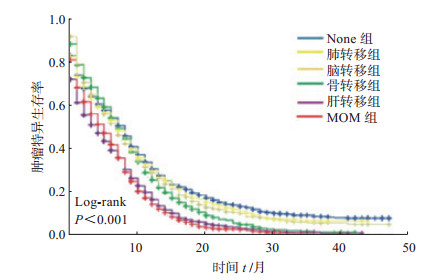
|
图 1 不同器官转移SCLC患者Kaplan-Meier生存分析 None组:与骨转移组比较P=0.004, 与脑转移组比较P=0.2, 与肝转移组比较P<0.001, 与肺转移组比较P=0.4, 与MOM组比较P<0.001;骨转移组:与脑转移组比较P=0.1, 与肝转移组比较P<0.001, 与肺转移组比较P=0.1, 与MOM组比较P<0.001;脑转移组:与肝转移组比较P<0.001, 与肺转移组比较P=0.9, 与MOM组比较P<0.001;肝转移组:与肺转移组比较P<0.001, 与MOM组比较P=0.5;肺转移组与MOM组比较P<0.001. None组:有远处转移,但无骨、脑、肝、肺4个器官转移; MOM组:多器官转移组(骨、脑、肝、肺这4个器官中有任意2个或2个以上器官转移). SCLC:小细胞肺癌 |
3 讨论
研究表明,肺癌、结肠癌、原发性肝癌等恶性肿瘤合并不同器官远处转移患者其临床预后也不同[11-13]。目前仍缺少SCLC远处器官转移对其预后影响的大样本研究,本研究采用SEER数据库,以SCLC特异性死亡为终点事件,分析了不同器官远处转移对SCLC患者临床预后的影响。影响肿瘤临床预后的因素有很多,如淋巴结转移、肿瘤大小、性别、年龄等[14],本研究采用Cox回归分析校正其他因素对SCLC病死率的影响,结果发现SCLC患者最常见类型为MOM,在重要的器官中以肝转移为最常见,肺内转移所占比例最少;肝转移和MOM具有相似的死亡HR,两组预后最差。
既往研究显示骨是肺癌最常见的远处转移部位[15-17]。D’Antonio等[16]报道,骨转移肺癌患者中位生存时间短于1年。Zhang和Gong[18]对168例肺癌合并骨转移患者进行了研究,发现中位生存时间为13个月,1年生存率为54.3%,2年生存率为12.9%。本研究中,骨转移组患者中位生存时间为7个月,这主要是由于本研究纳入的患者均为SCLC,SCLC是肺癌所有病例类型中分化最差、恶性程度最高、生存时间最短的病理类型,因此较Zhang和Gong[18]研究对象的中位生存时间更短。Zhang和Gong[18]还发现,多灶骨转移的死亡HR是单灶骨转移的1.72倍。本研究未进行这两者之间的比较,但根据AJCC第8版最新TNM分期,单灶骨转移定义为M1b,而多灶骨转移定义为M1c,目前普遍认为M1c期肿瘤预后不良,生存率低于M1b。本研究证实MOM是SCLC最常见的转移方式,在单个器官转移中肝脏为最常见的转移部位,肺内转移所占比例最少。这主要是因为既往研究多集中于NSCLC或者整体肺癌,其中SCLC所占比例为10%~20%,而本研究只纳入SCLC,故可以认为NSCLC最常见转移部位为骨转移,而SCLC则为MOM。
合并远处转移的肺癌患者预后不良[4, 19-20],这一结论已经成为普遍共识。但进一步研究认为多器官多灶转移相较于单器官转移临床预后显著下降,生存率显著降低[9, 21],本研究也得到类似结论。在单个器官转移中,将none组作为对照,在校正性别、年龄和肿瘤大小之后肺内转移组病死率与none组差异无统计学意义,骨转移组、脑转移组及肝转移组与之相比死亡风险增高。将none组作为对照,无论是否进行校正MOM组均具有最高的死亡HR。
近些年,肝脏转移相关研究越来越受到重视,因为肝转移预示着预后不良[7]。本研究中,将none组作为对照,校正年龄、性别和肿瘤大小之后,肝转移组死亡HR 高于骨转移和脑转移组。进一步比较肝转移组和MOM组,发现两者具有相似的死亡HR。将肝转移组作为对照,MOM组校正前后死亡HR 均无升高。因此,即使是肝脏单一转移的患者,也需要给予足够的治疗强度。本研究的结论与文献报道[12]一致。
综上所述,本研究样本量较大,根据其有无骨、脑、肝、肺或MOM转移,将SCLC患者分为6组,进行生存分析和死亡HR 分析。本研究结果证实,在M1期SCLC患者中,肺转移及无上述4个器官转移的患者预后相对较好,其次是骨转移和脑转移,MOM和肝脏转移具有最高的病死率和死亡HR,因此对于SCLC合并远处转移的患者不能一概而论,应根据其转移情况进行不同强度的治疗,对肝脏转移患者需引起高度重视。
| [1] |
JETT J R, SCOTT W J, RIVERA M P, SAUSE W T. American College of Chest Physicians Guidelines on treatment of stage ⅢB non-small cell lung cancer[J]. Chest, 2003, 123(1 Suppl): 221S-225S. |
| [2] |
BRAY F, JEMAL A, GREY N, FERLAY J, FORMAN D. Global cancer transitions according to the Human Development Index (2008—2030): a population-based study[J]. Lancet Oncol, 2012, 13: 790-801. DOI:10.1016/S1470-2045(12)70211-5 |
| [3] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67: 7-30. DOI:10.3322/caac.21387 |
| [4] |
MORGENSZTERN D, NG S H, GAO F, GOVINDAN R. Trends in stage distribution for patients with non-small cell lung cancer: a National Cancer Database survey[J]. J Thorac Oncol, 2010, 5: 29-33. DOI:10.1097/JTO.0b013e3181c5920c |
| [5] |
DETTERBECK F C, BOFFA D J, KIM A W, TANOUE L T. The eighth edition lung cancer stage classification[J]. Chest, 2017, 151: 193-203. DOI:10.1016/j.chest.2016.10.010 |
| [6] |
RAMI-PORTA R, ASAMURA H, TRAVIS W D, RUSCH V W. Lung cancer—major changes in the American Joint Committee on Cancer eighth edition cancer staging manual[J]. CA Cancer J Clin, 2017, 67: 138-155. DOI:10.3322/caac.21390 |
| [7] |
CHANG Y P, CHEN Y M, LAI C H, LIN C Y, FANG W F, HUANG C H, et al. The impact of de novo liver metastasis on clinical outcome in patients with advanced non-small-cell lung cancer[J/OL]. PLoS One, 2017, 12: e0178676. doi: 10.1371/journal.pone.0178676.
|
| [8] |
REN Y, DAI C, SHEN J, LIU Y, XIE D, ZHENG H, et al. The prognosis after contraindicated surgery of NSCLC patients with malignant pleural effusion (M1a) may be better than expected[J]. Oncotarget, 2016, 7: 26856-26865. |
| [9] |
EBERHARDT W E, MITCHELL A, CROWLEY J, KONDO H, KIM Y T, TURRISI A 3rd, et al. The IASLC lung cancer staging project: proposals for the revision of the M descriptors in the forthcoming eighth edition of the TNM classification of lung cancer[J]. J Thorac Oncol, 2015, 10: 1515-1522. DOI:10.1097/JTO.0000000000000673 |
| [10] |
ADAMO M, DICKIE, L, RUHL J. SEER program coding and staging manual 2016. National Cancer Institute, Bethesda, MD 20850-9765[Z/OL]. https://seer.cancer.gov/tools/codingmanuals/index.html.
|
| [11] |
WU W, HE X, ANDAYANI D, YANG L, YE J, LI Y, et al. Pattern of distant extrahepatic metastases in primary liver cancer: a SEER based study[J]. J Cancer, 2017, 8: 2312-2318. DOI:10.7150/jca.19056 |
| [12] |
REN Y, DAI C, ZHENG H, ZHOU F, SHE Y, JIANG G, et al. Prognostic effect of liver metastasis in lung cancer patients with distant metastasis[J]. Oncotarget, 2016, 7: 53245-53253. |
| [13] |
QIU M, HU J, YANG D, COSGROVE D P, XU R. Pattern of distant metastases in colorectal cancer: a SEER based study[J]. Oncotarget, 2015, 6: 38658-38666. |
| [14] |
DAI C, XIE H, KADEER X, SU H, XIE D, REN Y, et al. Relationship of lymph node micrometastasis and micropapillary component and their joint influence on prognosis of patients with stage Ⅰ lung adenocarcinoma[J]. Am J Surg Pathol, 2017, 41: 1212-1220. DOI:10.1097/PAS.0000000000000901 |
| [15] |
SUGIURA H, YAMADA K, SUGIURA T, HIDA T, MITSUDOMI T. Predictors of survival in patients with bone metastasis of lung cancer[J]. Clin Orthop Relat Res, 2008, 466: 729-736. DOI:10.1007/s11999-007-0051-0 |
| [16] |
D'ANTONIO C, PASSARO A, GORI B, DEL SIGNORE E, MIGLIORINO M R, RICCIARDI S, et al. Bone and brain metastasis in lung cancer: recent advances in therapeutic strategies[J]. Ther Adv Med Oncol, 2014, 6: 101-114. DOI:10.1177/1758834014521110 |
| [17] |
BRODOWICZ T, O'BYRNE K, MANEGOLD C. Bone matters in lung cancer[J]. Ann Oncol, 2012, 23: 2215-2222. DOI:10.1093/annonc/mds009 |
| [18] |
ZHANG L, GONG Z. Clinical characteristics and prognostic factors in bone metastases from lung cancer[J]. Med Sci Monit, 2017, 23: 4087-4094. DOI:10.12659/MSM.902971 |
| [19] |
NAKAZAWA K, KURISHIMA K, TAMURA T, KAGOHASHI K, ISHIKAWA H, SATOH H, et al. Specific organ metastases and survival in small cell lung cancer[J]. Oncol Lett, 2012, 4: 617-620. DOI:10.3892/ol.2012.792 |
| [20] |
WAQAR S N, WAQAR S H, TRINKAUS K, GADEA C A, ROBINSON C G, BRADLEY J, et al. Brain metastases at presentation in patients with non-small cell lung cancer[J]. Am J Clin Oncol, 2018, 41: 36-40. |
| [21] |
SÁNCHEZ DE COS ESCUIN J, ABAL ARCA J, MELCHOR IÑIGUEZ R, MIRAVET SORRIBES L, NÚÑEZ ARES A, HERNÁNDEZ HERNÁNDEZ J R, et al. Tumor, node and metastasis classification of lung cancer—M1a versus M1b—analysis of M descriptors and other prognostic factors[J]. Lung Cancer, 2014, 84: 182-189. DOI:10.1016/j.lungcan.2014.02.006 |
 2019, Vol. 40
2019, Vol. 40


