2. 海军军医大学(第二军医大学)基础医学院组织胚胎学教研室, 上海 200433
2. Department of Plastic Surgery, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China
随着海上事业的发展,海上作业人员的各种开放性损伤屡见不鲜。海水是一种复合的高渗碱性溶液,其化学成分主要是NaCl,还包括不同比例的KCl、CaCl2、MgCl2和MgSO4等;此外,海水中还含有大量微生物,尤其是革兰阴性菌[1]。研究表明,损伤组织受到海水长时间浸泡后,容易造成组织坏死范围增大、渗出物增多、炎症反应增强、组织修复延缓等病理变化,导致创面愈合困难,愈合时间延长[2-5]。
人脂肪干细胞(human adipose-derived stem cell,hADSC)是从人体脂肪组织中分离的多向分化潜能干细胞[6]。研究发现,hADSC可迁移到受损部位,分化为皮肤附属器官修复受损皮肤;还可旁分泌多种生长因子,如表皮生长因子(epidermal growth factor,EGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和碱性成纤维生长因子(basic fibroblast growth factor,bFGF)等,促进表皮生成和创面愈合[7-10]。上皮化效应是皮肤创面修复的重要组成部分,其中EGF是创面上皮化的重要生长因子[11]。本研究拟观察海水对表皮细胞增殖与迁移能力的影响及hADSC能否减轻海水的损伤作用,并从表皮生长因子受体(epidermal growth factor receptor,EGFR)/细胞外调节蛋白激酶(extracellular-regulated protein kinase,ERK)通路探讨相关机制,以期为减轻海水的损伤效应提供新的治疗策略。
1 材料和方法 1.1 细胞与试剂人永生化表皮细胞系HaCaT细胞购自美国模式培养物集存库,Ⅰ型胶原酶、胎牛血清(fetal bovine serum,FBS)、青霉素/链霉素双抗溶液、胰蛋白酶购自美国Gibco公司,低糖培养液、高糖培养液、磷酸盐缓冲液(phosphate buffer saline,PBS)购自美国HyClone公司,流式抗体CD29、CD105、CD45、人白细胞DR抗原(human leukocyte antigen DR,HLA-DR)购自美国BD公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国CST公司,PrimeScript RT reagent kit with gDNA Eraser、TB Green Premix Ex TaqⅡ购自日本TaKaRa公司,成骨诱导培养液与成脂诱导培养液套装均购自广州赛业生物有限公司,活细胞计数试剂盒(cell counting kit-8,CCK-8)购自上海碧云天生物技术有限公司,5-乙炔基-2’-脱氧尿苷(5-ethynyl-2’-deoxyuridine,EdU)细胞增殖检测试剂盒购自广州锐博生物技术有限公司,TRNzol总RNA提取试剂盒购自天根生化科技(北京)有限公司。PCR引物由苏州金唯智生物科技有限公司合成。
1.2 hADSC的分离与培养人体皮下脂肪标本取自海军军医大学(第二军医大学)长海医院5名健康女性的腹部吸脂术后组织。使用眼科剪将脂肪组织剪碎并用低糖培养液多次洗涤以除去大量脂滴,然后将洗涤后的脂肪组织置于含有Ⅰ型胶原酶(1 mg/mL)的低糖培养液中,于37 ℃水浴中温和搅拌消化40 min。最后,将样品用70 μm筛网过滤,300×g离心30 min后去上清。细胞沉淀使用含有10% FBS和1%青霉素/链霉素双抗溶液的低糖培养液重悬,并置于5% CO2细胞培养箱中培养。待细胞贴壁后,隔天更换含有10% FBS的新鲜低糖培养液,并进行传代培养[12]。本研究经海军军医大学(第二军医大学)长海医院伦理委员会审批,所有组织标本的使用均取得患者知情同意。
1.3 hADSC的特性鉴定 1.3.1 成骨(成脂)诱导与鉴定待第3代hADSC细胞生长至80%~90%融合度时,更换为成骨或成脂分化培养液诱导培养4周。hADSC诱导4周后,使用4%中性甲醛溶液固定30 min并用PBS洗涤2次。随后,成骨诱导细胞使用茜素红S染液染色5 min,成脂诱导细胞使用油红O染液染色30 min。染色结束后,使用PBS多次洗涤染色细胞以除去多余染料,在光学显微镜(日本Olympus公司)下观察并捕获图像,以观察和评估成骨分化或成脂分化的状态。
1.3.2 hADSC的流式鉴定用胰蛋白酶消化第3代hADSC并离心,使用PBS重悬细胞沉淀并进行细胞计数。取100 μL含有约1×106个细胞的PBS悬液,加入异硫氰酸荧光素(fluoresceine isothiocyanate,FITC)标记的CD29、CD105、CD45、HLA-DR抗体,室温避光孵育20 min后通过流式细胞仪(ImageStreamX MarkⅡ,美国Amnis公司)计算阳性细胞比例[13]。
1.4 人工海水的配制根据文献报道的方法[4]配制人工海水,主要指标:渗透压(1 250.00±11.52)mmol/L,pH值8.2,钠离子浓度(630.00±5.33)mmol/L,钾离子浓度(10.88±0.68)mmol/L,氯离子浓度(658.80±5.25)mmol/L。实验用人工海水需经0.22 μm过滤器过滤后使用。
1.5 细胞分组与培养方式将HaCaT细胞分为3组。对照组:用普通高糖培养液培养HaCaT细胞;海水组:用混有一定比例海水的高糖培养液培养HaCaT细胞;hADSC共培养组:用混有一定比例海水的高糖培养液培养细胞,将HaCaT细胞与hADSC分别在培养皿与Transwell小室中共培养[14],即将hADSC(1×105/孔)接种到Transwell小室的0.4 μm聚碳酸酯膜上,下室接种HaCaT细胞(1×104/孔),共培养2 d。
1.6 细胞增殖实验 1.6.1 CCK-8检测细胞增殖将HaCaT细胞以2 000/孔的密度接种在96孔板中。待培养12 h细胞贴壁后,再以含不同比例(体积分数为5%、10%、20%)海水的高糖培养液培养24、48或72 h。向处理后的细胞培养孔中加入10 μL CCK-8试剂,并置于5% CO2细胞培养箱中孵育2 h。最后,将培养皿置于酶标仪(美国Thermo Scientifc公司)上,于450 nm波长处检测光密度值。
1.6.2 EdU试剂盒检测细胞增殖[15]将HaCaT细胞以1×105/孔的密度接种至24孔板并正常培养至70%~80%融合度后,根据分组情况更换为对应的培养方式培养48 h。将EdU试剂盒A液以1 000:1的稀释比例添加到细胞培养液中并孵育2 h,孵育后丢弃细胞培养液并用PBS洗涤细胞,随后每孔加入500 μL多聚甲醛溶液固定30 min。固定完成后,每孔加入500 μL甘氨酸溶液(2 mg/mL)中和过量甲醛。然后,每孔加入0.5% Triton X-100渗透剂处理10 min并用PBS洗涤5 min。细胞荧光染色:将Apollo反应溶液加入培养皿中,在室温下避光孵育30 min;每孔再次加入0.5% Triton X-100渗透剂处理10 min;将Hoechst33342反应溶液加入培养皿中并在室温下避光孵育30 min。染色结束后,使用PBS清洗细胞2~3次,并于荧光显微镜(德国Zeiss公司)下拍照观察。
1.7 细胞划痕迁移实验[16]将HaCaT细胞以1×106/孔接种于6孔板中并正常培养细胞至80%~90%融合度。用10 μL无菌移液枪头尖端刮擦细胞,使之形成一道竖直划痕,用PBS洗涤细胞并根据分组情况更换对应的细胞培养方式。最后,使用倒置相差显微镜(德国Zeiss公司)于4个时间点(0、12、24和36 h)观察划痕修复状况并拍照,计算修复面积:修复面积(%)=(初始划痕面积-测量时残留划痕面积)/初始划痕面积×100%。
1.8 EGFR蛋白表达与ERK通路的激活状况检测使用蛋白质印迹法检测各组HaCaT细胞EGFR蛋白表达水平,实时定量PCR检测ERK通路mRNA的表达。将HaCaT细胞以1×105/孔接种于6孔板中,正常培养至70%~80%融合度后,根据分组情况更换为对应的培养方式培养48 h。
收集1×106个细胞,提取总蛋白与总RNA。蛋白质印迹法:经电泳与转膜后,置于5%小牛血清液中室温封闭2 h,加入一抗GAPDH(1:1 000)与EGFR(1:1 000)抗体4 ℃避光孵育过夜。使用TBST溶液洗膜3~4次,加入二抗(1:4 000)室温孵育2 h后采用电化学发光法显影,然后使用ImageJ软件分析条带蛋白表达量。
实时定量PCR:将RNA反转录为cDNA,并以cDNA为模板、以GAPDH为内参基因进行实时定量PCR。引物序列:GAPDH正义引物为5' -TGT GGG CAT CAA TGG ATT TGG-3' ,反义引物为5' -ACA CCA TGT ATT CCG GGT CAA T-3' ;ERK正义引物为5' -TAC ACC AAC CTC TCG TAC ATC G-3' ,反义引物为5' -CAT GTC TGA AGC GCA GTA AGA TT-3' 。反应体系为20 μL。反应条件:95 ℃预变性30 s,95℃ 10 s、60 ℃ 10 s、72 ℃ 10 s重复40个循环。以目的基因与GAPDH表达量的比值来校准表达量。
1.9 统计学处理采用GraphPad Prism 7.0软件和SPSS 15.0软件进行统计学分析。所有数据均以x±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。检验水准(α)为0.05。
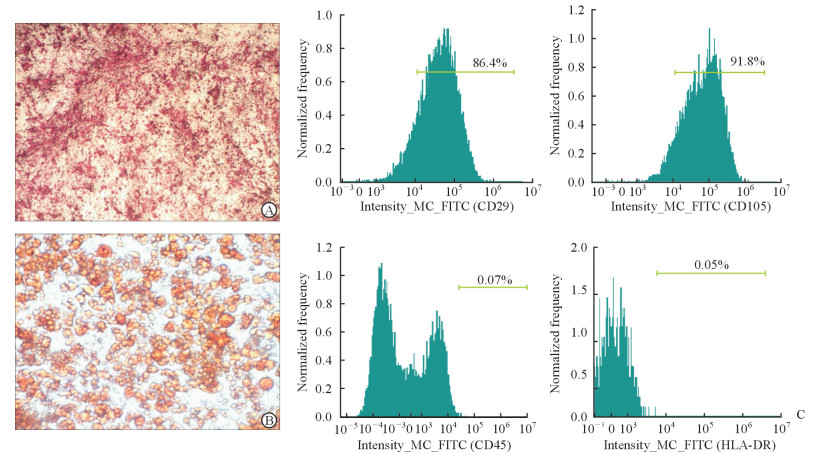
2 结果 2.1 hADSC特性鉴定将分离培养的hADSC进行成骨分化或成脂分化培养4周后,茜素红S染色可见成骨细胞特有的钙结节,证实hADSC具有成骨分化的能力(图 1A);油红O染色可见脂肪细胞特有的饱满脂滴,证实hADSC具有成脂分化的能力(图 1B)。流式干细胞表面标志物检测结果显示CD29、CD105表面标志物呈强阳性,但CD45、HLA-DR表面标志物呈阴性(图 1C)。上述结果证实我们分离制备的hADSC符合行业内通常评价标准,可以用于研究[13]。
|
图 1 hADSC特性鉴定 Fig 1 Characterization of hADSCs A: Alizarin red S staining; B: Oil red O staining; C: hADSC surface marker detected by flow cytometry. hADSC: Human adipose-derived stem cell; HLA-DR: Human leukocyte antigen DR. Original magnification: ×200 (A, B) |
2.2 海水对HaCaT细胞增殖的影响
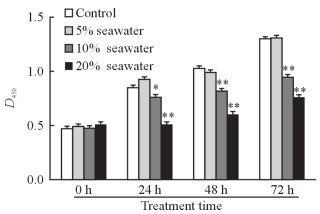
将人工海水以不同比例(体积分数为5%、10%、20%)混入细胞培养液中,通过CCK-8细胞增殖实验检测HaCaT细胞的增殖活力,结果显示在5%海水组中,HaCaT细胞的增殖活力与未添加海水的对照组比较差异无统计学意义;然而在10%与20%海水组中,细胞增殖活力受到抑制,与未添加海水的对照组比较差异均有统计学意义(P均<0.05),并且随着培养时间的延长,抑制效应持续存在(图 2)。选择10%海水作为后续实验条件。
|
图 2 海水对HaCaT细胞增殖的影响 Fig 2 Effect of seawater on proliferation of HaCaT cells *P < 0.05, **P < 0.01 vs control group. n=3, x±s |
2.3 hADSC共培养对海水浸泡的HaCaT细胞增殖影响
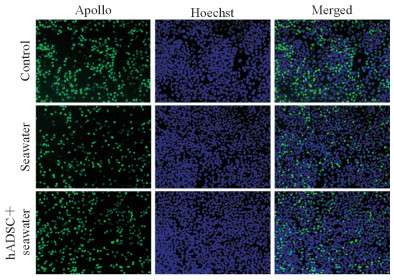
通过EdU细胞增殖实验观察hADSC共培养对海水浸泡细胞增殖的影响,结果(图 3)显示在10%海水组中,HaCaT细胞增殖受到抑制,细胞的增殖活力与未添加海水的对照组比较差异有统计学意义[(26.0±0.9)% vs(37.4±1.3)%,P<0.01];而hADSC共培养组HaCaT细胞增殖活力并未受到明显抑制,细胞的增殖活力高于海水组且差异有统计学意义[(36.3±2.3)% vs(26.0±0.9)%,P<0.01]。
|
图 3 hADSC共培养对海水浸泡HaCaT细胞增殖的影响 Fig 3 Effect of co-culture with hADSCs on proliferation of HaCaT cells cultured with seawater hADSC: Human adipose-derived stem cell; EdU: 5-ethynyl-2'-deoxyuridine. Original magnification: ×100 |
2.4 hADSC共培养对海水浸泡的HaCaT细胞迁移的影响
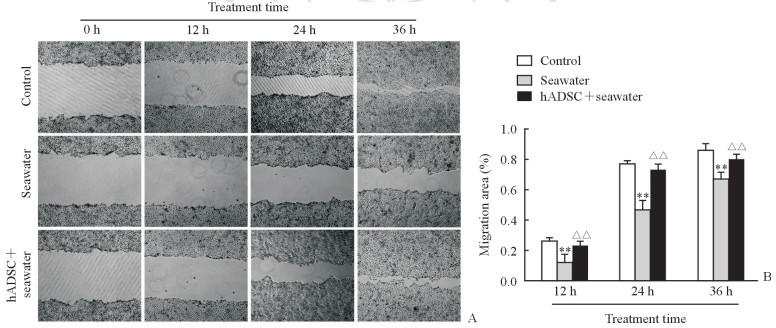
细胞划痕实验结果显示,与不添加海水的对照组相比,10%海水组HaCaT细胞迁移能力在12 h即显示出划痕闭合延缓,并持续至36 h,修复面积与对照组相比差异有统计学意义(P<0.01);而在同一观测时间点,hADSC共培养组细胞的迁移能力相较于海水组显示出较高的愈合效率,修复面积与海水组相比差异有统计学意义(P<0.01)。在36 h观测时间点,对照组与hADSC共培养组细胞划痕几乎完全愈合,而海水组仍留有较大的划痕区域(图 4)。
|
图 4 hADSC共培养对海水浸泡HaCaT细胞迁移能力的影响 Fig 4 Effect of co-culture with hADSCs on migration of HaCaT cells cultured with seawater A: Three sets of scratch repairs at different time points; B: Migration area analysis results. hADSC: Human adipose-derived stem cell. Original magnification: ×50 (A). **P < 0.01 vs control group; △△P < 0.01 vs seawater group. n=3, x±s |
2.5 hADSC共培养通过EGFR/ERK通路干预海水浸泡HaCaT细胞的增殖与迁移
蛋白质印迹分析结果显示,10%海水组HaCaT细胞EGFR蛋白表达量低于对照组及hADSC共培养组,差异有统计学意义(P<0.01);而对照组与hADSC共培养组EGFR蛋白表达量差异无统计学意义(P>0.05,图 5A)。实时定量PCR结果显示,10%海水组HaCaT细胞ERK mRNA表达量低于对照组及hADSC共培养组,差异有统计学意义(P<0.01);而对照组与hADSC共培养组ERK mRNA表达量差异无统计学意义(P>0.05,图 5B)。
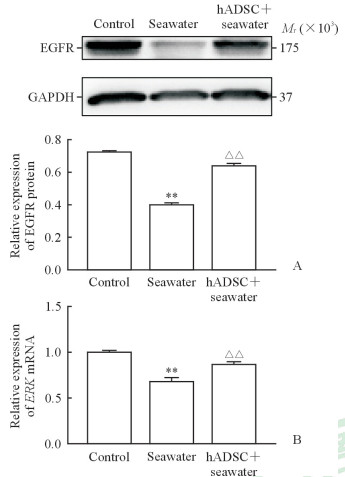
|
图 5
hADSC共培养通过EGFR/ERK通路干预海水浸泡HaCaT细胞的增殖与迁移
Fig 5
Co-culture with hADSCs interfering proliferation and migration of HaCaT cells cultured with seawater via EGFR/ERK pathway
A: EGFR protein expression detected by Western blotting; B: ERK mRNA expression detected by real-time quantitative PCR. hADSC: Human adipose-derived stem cell; EGFR: Epidermal growth factor receptor; ERK: Extracellular-regulated protein kinase. **P < 0.01 vs control group; △△P < 0.01 vs seawater group. n=3, x±s |
3 讨论
既往动物实验发现,创伤合并海水浸泡后,可导致伤口愈合时间明显延长,形成慢性创面[3]。海水浸泡后的创面组织细胞严重变性坏死,加重创面损伤[17];创面局部炎症反应增强,局部炎症期延长,使创面修复延缓[18];此外,大量研究表明,海水浸泡可导致创面中VEGF表达减少,创面新生血管内皮细胞和内皮祖细胞增殖受到抑制,创面新生血管化受到阻碍,造成创面愈合延缓[19-21]。但目前尚未见关于海水是否影响表皮细胞增殖与迁移的研究报道。本研究将人表皮细胞系HaCaT细胞作为创面上皮化的代表细胞,观察海水对其增殖与迁移的影响。真实环境下,创面最表面应该接触100%海水,随组织层次深入,海水渗入的浓度可能递减,本研究结果显示10%的海水已经对细胞的增殖能力具有较大的影响。
干细胞疗法是组织再生工程的重要组成部分。已有研究表明,hADSC可通过自身分化、旁分泌和抗氧化凋亡等多种机制促进皮肤创面(尤其是慢性皮肤创面)的修复[22-24]。因此,我们将HaCaT细胞与hADSC在含10%海水的培养液中共培养,探讨hADSC对海水浸泡的HaCaT细胞增殖与迁移能力的影响。结果显示hADSC共培养组HaCaT细胞增殖和迁移能力相较于海水组明显增强,差异有统计学意义(P<0.01)。
Morino-Koga等[11]研究表明EGF的表达可激活ERK信号通路并促进细胞增殖。同时,EGF是皮肤创面再上皮化最重要的生长因子。本研究通过蛋白质印迹法和实时定量PCR比较了对照组、海水组和hADSC共培养组3组HaCaT细胞EGFR/ERK通路的激活情况,结果显示海水组HaCaT细胞EGFR/ERK通路的激活水平低于对照组及hADSC共培养组HaCaT细胞,而对照组与hADSC共培养组HaCaT细胞EGFR/ERK通路的激活水平无明显差异。上述结果提示海水通过阻碍EGFR/ERK通路的激活,抑制HaCaT细胞的增殖与迁移,而hADSC可通过激活上述通路蛋白的表达,减少海水对HaCaT细胞增殖与迁移的不利影响,促进HaCaT细胞的增殖与迁移。Chen等[25]通过抗体阵列技术比较了干细胞和干细胞外泌体中细胞因子的组成,结果显示干细胞外泌体相较于干细胞可显著富集EGF。因此,我们猜测在共培养体系中,hADSC可能分泌富含多种生长因子的外泌体,从而上调细胞EGFR的表达,进而促进HaCaT细胞的增殖和迁移。
本研究从表皮再生(创面再上皮化)的角度对海水浸泡加重创面损伤的机制及hADSC促进海水浸泡创面愈合的机制进行探讨,发现海水可通过阻碍EGFR/ERK通路的激活,抑制表皮细胞的增殖与迁移能力,而hADSC却可激活EGFR/ERK通路,降低海水对表皮细胞的抑制效应。本研究结果有助于进一步探索海水浸泡创面产生的内在机制,也为海水浸泡皮肤创面的再生提供了新的治疗思路。
| [1] |
MA J, WANG Y, WU Q, CHEN X, WANG J, YANG L. Seawater immersion aggravates burn-associated lung injury and inflammatory and oxidative-stress responses[J]. Burns, 2017, 43: 1011-1020. DOI:10.1016/j.burns.2017.01.028 |
| [2] |
陈璧, 丁国斌, 唐建兵, 董茂龙. 纳米烧(烫)伤敷料对海水浸泡兔软组织伤愈合的实验研究[J]. 中华航海医学与高气压医学杂志, 2002, 9: 147-151. DOI:10.3760/cma.j.issn.1009-6906.2002.03.007 |
| [3] |
宁浩勇, 孟宇宏, 王大鹏, 刘肖, 康筱玲, 虞积耀. 创伤合并海水浸泡后愈合过程的病理学观察[J]. 中国比较医学杂志, 2009, 19: 32-35. |
| [4] |
薛小军, 张文华, 周松, 李冉冉, 张行健, 陈文有, 等. 伤后早期应用乌司他丁对海水浸泡兔腹部开放伤的干预效果[J]. 解放军医学杂志, 2013, 25: 35-38. |
| [5] |
宁浩勇, 孟宇宏, 王大鹏, 刘肖, 杨兴东, 尚立群, 等. 海水浸泡对伤口愈合时间影响的动物实验观察[J]. 中华航海医学与高气压医学杂志, 2008, 15: 84-86. DOI:10.3760/cma.j.issn.1009-6906.2008.02.006 |
| [6] |
EKE G, MANGIR N, HASIRCI N, MACNEIL S, HASIRCI V. Development of a UV crosslinked biodegradable hydrogel containing adipose derived stem cells to promote vascularization for skin wounds and tissue engineering[J]. Biomaterials, 2017, 129: 188-198. DOI:10.1016/j.biomaterials.2017.03.021 |
| [7] |
BERTOZZI N, SIMONACCI F, GRIECO M P, GRIGNAFFINI E, RAPOSIO E. The biological and clinical basis for the use of adipose-derived stem cells in the field of wound healing[J]. Ann Med Surg (Lond), 2017, 20: 41-48. DOI:10.1016/j.amsu.2017.06.058 |
| [8] |
HASSAN W U, GREISER U, WANG W. Role of adipose-derived stem cells in wound healing[J]. Wound Repair Regen, 2014, 22: 313-325. DOI:10.1111/wrr.12173 |
| [9] |
TARTARINI D, MELE E. Adult stem cell therapies for wound healing: biomaterials and computational models[J/OL]. Front Bioeng Biotechnol, 2015, 3: 206. doi: 10.3389/fbioe.2015.00206.
|
| [10] |
KIM W S, HAN J, HWANG S J, SUNG J H. An update on niche composition, signaling and functional regulation of the adipose-derived stem cells[J]. Expert Opin Biol Ther, 2014, 14: 1091-1102. DOI:10.1517/14712598.2014.907785 |
| [11] |
MORINO-KOGA S, UCHI H, MITOMA C, WU Z, KIYOMATSU M, FUYUNO Y, et al. 6-Formylindolo[3, 2-b]carbazole accelerates skin wound healing via activation of ERK, but not Aryl hydrocarbon receptor[J]. J Invest Dermatol, 2017, 137: 2217-2226. DOI:10.1016/j.jid.2016.10.050 |
| [12] |
LIN Y C, GRAHOVAC T, OH S J, IERACI M, RUBIN J P, MARRA K G. Evaluation of a multi-layer adipose-derived stem cell sheet in a full-thickness wound healing model[J]. Acta Biomater, 2013, 9: 5243-5250. DOI:10.1016/j.actbio.2012.09.028 |
| [13] |
ZHANG W, BAI X, ZHAO B, LI Y, ZHANG Y, LI Z, et al. Cell-free therapy based on adipose tissue stem cell-derived exosomes promotes wound healing via the PI3K/Akt signaling pathway[J]. Exp Cell Res, 2018, 370: 333-342. DOI:10.1016/j.yexcr.2018.06.035 |
| [14] |
KIM W S, PARK B S, SUNG J H, YANG J M, PARK S B, KWAK S J, et al. Wound healing effect of adipose-derived stem cells:a critical role of secretory factors on human dermal fibroblasts[J]. J Dermatol Sci, 2007, 48: 15-24. DOI:10.1016/j.jdermsci.2007.05.018 |
| [15] |
MA A Y, XIE S W, ZHOU J Y, ZHU Y. Nomegestrol acetate suppresses human endometrial cancer RL95-2 cells proliferation in vitro and in vivo possibly related to upregulating expression of SUFU and Wnt7a[J/OL]. Int J Mol Sci, 2017, 18. pii: E1337. doi: 10.3390/ijms18071337.
|
| [16] |
ZHANG L, XU P, WANG X, ZHANG M, YAN Y, CHEN Y, et al. Activin B regulates adipose-derived mesenchymal stem cells to promote skin wound healing via activation of the MAPK signaling pathway[J]. Int J Biochem Cell Biol, 2017, 87: 69-76. DOI:10.1016/j.biocel.2017.04.004 |
| [17] |
马军, 王甲汉, 李志清, 易朝辉. 大鼠烫伤合并海水浸泡后创面病理学改变的特点[J]. 南方医科大学学报, 2009, 29: 1297-1299. DOI:10.3321/j.issn:1673-4254.2009.06.031 |
| [18] |
赵晓明, 王远征, 郝光辉, 刘红, 肖云贵, 叶海军. 海水浸泡对模拟海训皮肤擦伤大鼠炎症因子的影响[J]. 临床军医杂志, 2013, 41: 219-221. DOI:10.3969/j.issn.1671-3826.2013.03.01 |
| [19] |
王培, 管云枫, 徐添颖, 缪朝玉. G-CSF对大鼠烧伤合并海水浸泡后内皮祖细胞的影响[J]. 东南国防医药, 2013, 15: 1-3. DOI:10.3969/j.issn.1672-271X.2013.01.001 |
| [20] |
王培, 管云枫, 徐添颖, 缪朝玉. 地塞米松对大鼠烧伤合并海水浸泡后内皮祖细胞数目的影响[J]. 西南军医, 2012, 14: 566-569. DOI:10.3969/j.issn.1672-7193.2012.04.002 |
| [21] |
张爱群, 孙富国, 徐忠华, 徐振辕, 王昭英, 陈录庭. VEGF与b-FGF在海水浸泡大鼠烧伤皮肤组织中的表达[J]. 天津医药, 2011, 39: 1171-1172. DOI:10.3969/j.issn.0253-9896.2011.12.031 |
| [22] |
OWCZARCZYK-SACZONEK A, WOCIÓR A, PLACEK W, MAKSYMOWICZ W, WOJTKIEWICZ J. The use of adipose-derived stem cells in selected skin diseases (vitiligo, alopecia, and nonhealing wounds)[J/OL]. Stem Cells Int, 2017, 2017: 4740709. doi: 10.1155/2017/4740709.
|
| [23] |
KASAP Ş, BARUTÇU A, GÜÇ H, YAZGAN Ş, KIVANÇ M, VATANSEVER H S. Effects of keratinocytes differentiated from embryonic and adipogenic stem cells on wound healing in a diabetic mouse model[J]. Wounds, 2017, 29: 297-305. |
| [24] |
CHANG Y W, WU Y C, HUANG S H, WANG H D, KUO Y R, LEE S S. Autologous and not allogeneic adipose-derived stem cells improve acute burn wound healing[J/OL]. PLoS One, 2018, 13: e0197744. doi: 10.1371/journal.pone.0197744.
|
| [25] |
CHEN L, XIANG B, WANG X, XIANG C. Exosomes derived from human menstrual blood-derived stem cells alleviate fulminant hepatic failure[J/OL]. Stem Cell Res Ther, 2017, 8: 9. doi: 10.1186/s13287-016-0453-6.
|
 2019, Vol. 40
2019, Vol. 40


