2. 海门市人民医院内分泌科, 海门 226100
2. Department of Endocrinology, Haimen People's Hospital, Haimen 226100, Jiangsu, China
在2型糖尿病早期,患者表现为胰岛素抵抗增加,胰岛素分泌功能代偿性增加,胰岛β细胞功能及肠促胰素效应缓慢下降[1]。因此,对于2型糖尿病早期患者的治疗应当以改善胰岛素抵抗为主。2型糖尿病患者口服降糖药物治疗失败后,加用基础胰岛素是临床常用的控制血糖方法,可使约2/3的患者糖化血红蛋白(glycated hemoglobin,HbA1c)达标(<7%)[2-4];然而,使用基础胰岛素所致的体质量增加和低血糖风险限制了其临床接受度[5-6],需要寻找更好的治疗方案。既往研究显示,对于超重或肥胖的2型糖尿病患者,吡格列酮联合二甲双胍治疗15个月能改善患者的HbA1c、空腹血糖及餐后2 h血糖及高胰岛素正常葡萄糖钳夹试验中的胰岛素敏感性,并且该联合方案的疗效优于单用吡格列酮、单用二甲双胍或磺脲类促泌剂联合二甲双胍治疗的效果[7]。但吡格列酮联合二甲双胍的治疗方案在疗效及不良反应方面与加用基础胰岛素相比是否有优势,目前尚缺乏相关报道。本研究比较了在血糖控制不佳的超重或肥胖的2型糖尿病患者中吡格列酮联合二甲双胍与基础胰岛素的疗效,并对2种情况下患者的代谢指标予以评估。
1 资料和方法 1.1 研究对象本研究采用开放、随机、平行分组对照的研究方法。纳入2017年8月至2018年3月在同济大学附属第十人民医院门诊就诊的血糖控制不佳的超重或肥胖的2型糖尿病患者(诊断标准采用世界卫生组织制定的标准[8])。纳入标准:(1)年龄为25~70岁,体质量指数(body mass index,BMI)≥25 kg/m2;(2)降糖药物治疗后HbA1c控制差(>8%);(3)受试者自愿加入本研究,并签署知情同意书,依从性好,配合随访。排除标准:(1)糖尿病病程>10年;(2)空腹C肽<1 ng/mL,餐后2 h C肽<3 ng/mL;(3)近3个月内使用过二甲双胍或吡格列酮或胰岛素治疗的患者;(4)1型糖尿病或继发性糖尿病;(5)糖尿病急性并发症;(6)伴严重慢性并发症(如增殖期视网膜病变),尿微量白蛋白/肌酐比值(albumin-creatinine ratio,ACR)≥300 mg/g,或近1年内曾发生脑血管意外或急性冠状动脉综合征者;(7)血压持续高于180/110 mmHg(1 mmHg=0.133 kPa);(8)血肌酐清除率<50 mL/min,丙氨酸转氨酶≥2.5倍正常值上限,总胆红素≥1.5倍正常值上限;(9)血红蛋白<100 g/L或需要定期接受输血治疗;(10)妊娠、哺乳、不愿在研究期间避孕的育龄妇女;(11)使用可能影响研究目的的药物;(12)慢性心功能不全,纽约心脏协会心功能分级Ⅲ级以上;(13)恶性肿瘤病史。本研究通过同济大学附属第十人民医院伦理委员会审批。
1.2 研究分组利用随机数字表法,按1:1将纳入的患者分为两组:吡格列酮二甲双胍组、基础胰岛素组。
1.3 干预方法吡格列酮二甲双胍组:患者在原有治疗药物的基础上,加用吡格列酮二甲双胍(商品名:卡双平,吡格列酮15 mg/二甲双胍500 mg),每次1片,每天2次,治疗6个月。基础胰岛素组:患者在原有治疗药物的基础上,加用甘精胰岛素治疗6个月,并根据患者空腹血糖水平调整基础胰岛素剂量。具体调整方案:以空腹血糖<7.2 mmol/L为目标,每2周调整1次胰岛素剂量。若最低空腹血糖<5.0 mmol/L,胰岛素剂量减2 U;最低空腹血糖为5.0~7.2 mmol/L,胰岛素剂量维持不变;最低空腹血糖为7.3~8.1 mmol/L,胰岛素剂量加2 U;最低空腹血糖为8.2~10.0 mmol/L,胰岛素剂量加4 U;最低空腹血糖>10.0 mmol/L,胰岛素剂量加6 U。研究者根据患者的实际情况平衡血糖达标和低血糖风险,并进行剂量调整。所有患者均接受糖尿病教育及生活方式指导,并于基线和治疗3个月、6个月时进行随访。
1.4 观察指标采用瑞士罗氏cobas C701全自动生化仪,利用己糖激酶法测定血糖,免疫比浊法测定总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)。采用瑞士罗氏cobas E601全自动电化学发光仪检测胰岛素、C肽。用东曹(上海)生物科技有限公司离子交换高效液相色谱仪检测HbA1c。采用法国ECHOSENS公司FibroScan® 502检测肝脂肪变性,脂肪变性程度使用受控衰减参数(controlled attenuation parameter,CAP)值表示。
研究的主要终点为患者治疗前后的HbA1c、空腹血糖、餐后2 h血糖、空腹胰岛素、餐后2 h胰岛素、空腹C肽、餐后2 h C肽的变化,次要终点为患者治疗前后BMI、TC、TG、HDL-C、LDL-C、CAP值的变化。
1.5 安全性指标所有受试者在临床研究期间发生的任何不良事件。(1)低血糖事件:有自觉症状、有低血糖反应且血糖低于正常值下限,严重低血糖(血糖水平<2.8 mmol/L);随访期间,如患者有低血糖症状,需及时检测血糖并减少或停用胰岛素,记录低血糖次数、症状及自我血糖监测的血糖数值。(2)高血糖补救方案:治疗12周后,1周内连续2次空腹血糖>11.1 mmol/L时,联系研究者并返回研究中心,由研究者分析导致血糖控制不佳的原因,若判断为研究药物控糖效果不佳所致则退出研究,并完成相应访视的实验室检查。(3)其他不良事件:包括水肿、胃肠道反应、生命体征异常、心血管事件、实验室检查中出现的异常等。
1.6 统计学处理使用SPSS 19.0软件进行统计学分析,使用GraphPad Prism 5.0软件绘图。呈正态分布的计量资料以x±s表示,组间比较采用独立样本t检验或单因素方差分析;呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,经对数转换校正为正态分布后采用独立样本t检验或单因素方差分析进行比较。计数资料以例数和百分数表示,组间比较采用χ2检验。所有检验均为双侧检验,检验水准(α)为0.05。
2 结果 2.1 两组基线资料比较根据纳入和排除标准,161例患者进入筛选,最终153例血糖控制不佳的超重或肥胖的2型糖尿病患者纳入研究,其中男74例、女79例,平均年龄为(53.5±9.8)岁。吡格列酮二甲双胍组77例,男39例、女38例,平均年龄为(54.3±9.6)岁,平均BMI为(24.7±1.2)kg/m2;基础胰岛素组76例,男35例、女41例,平均年龄为(52.7±8.0)岁,平均BMI为(25.0±1.5)kg/m2。两组患者的性别、年龄、BMI、HbA1c、空腹血糖、餐后2 h血糖、空腹胰岛素、餐后2 h胰岛素、空腹C肽、餐后2 h C肽、TC、TG、HDL-C、LDL-C、CAP值、基础疾病(高血压、血脂紊乱、心血管疾病、脑血管疾病)和用药情况的差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 两组血糖控制不佳的超重或肥胖的2型糖尿病患者的基线资料 Tab 1 Baseline characteristics of type 2 diabetes mellitus patients with poor blood glucose control and overweight or obesity in two groups |
2.2 两组降糖效果观察结果
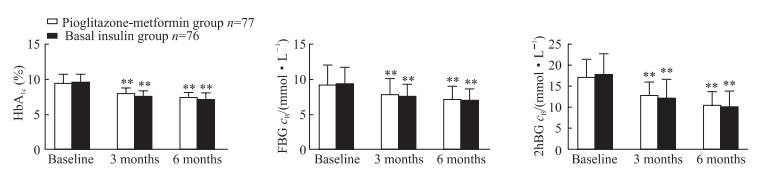
见图 1,治疗3个月、6个月时,吡格列酮二甲双胍组与基础胰岛素组患者的HbA1c、空腹血糖、餐后2 h血糖均较基线水平下降,差异均有统计学意义(P均<0.01),但两组间差异均无统计学意义(P均>0.05)。提示口服其他降糖药治疗后血糖控制不佳的超重或肥胖2型糖尿病患者加用吡格列酮联合二甲双胍的降糖效果与加用基础胰岛素相同。
|
图 1 两组血糖控制不佳的超重或肥胖的2型糖尿病患者治疗前后HbA1c及血糖的变化 Fig 1 HbA1c and blood glucose levels of type 2 diabetes mellitus patients with poor blood glucose control and overweight or obesity in two groups HbA1c: Glycated hemoglobin; FBG: Fast blood glucose; 2hBG: 2 h-postprandial blood glucose. **P < 0.01 vs the same group at baseline. x±s |
2.3 两组胰岛素水平观察结果
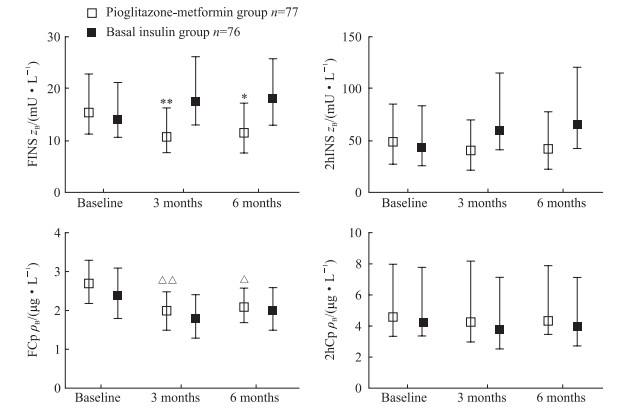
由图 2可见,治疗3个月、6个月时,吡格列酮二甲双胍组空腹胰岛素及空腹C肽均较基线水平下降,其中空腹C肽与基线水平相比差异有统计学意义(P=0.003、0.022),而餐后2 h胰岛素及餐后2 h C肽与基线时相比均无明显变化;治疗3个月、6个月时,基础胰岛素组空腹及餐后2 h胰岛素较基线时相比均呈轻度上升趋势,但差异均无统计学意义,空腹及餐后2 h C肽水平较基线无明显变化。与基础胰岛素组相比,吡格列酮二甲双胍组在治疗3个月及6个月时空腹胰岛素水平下降[10.7(7.5,16.1)mU/L vs 17.6(12.9,26.1)mU/L,11.4(7.7,17.2)mU/L vs 18.2(13.1,25.7)mU/L],差异均有统计学意义(P=0.001、0.035)。提示吡格列酮二甲双胍治疗能减少自身胰岛素分泌,增加外周胰岛素敏感性;而基础胰岛素治疗对胰岛素敏感性改善无明显效果。
|
图 2 两组血糖控制不佳的超重或肥胖的2型糖尿病患者治疗前后胰岛素及C肽的变化 Fig 2 Insulin and C-peptide levels of type 2 diabetes mellitus patients with poor blood glucose control and overweight or obesity in two groups FINS: Fast insulin; 2hINS: 2 h-postprandial insulin; FCp: Fast C-peptide; 2hCp: 2 h-postprandial C-peptide. *P < 0.05, **P < 0.01 vs basal insulin group at the same follow-up time; △P < 0.05, △△P < 0.01 vs the same group at baseline. Median (lower quartile, upper quartile) |
2.4 两组体质量变化观察结果
在治疗3个月、6个月时,吡格列酮二甲双胍组BMI较基线时相比均下降[(23.7±1.1)kg/m2、(23.5±1.3)kg/m2 vs(24.7±1.2)kg/m2],也均低于基础胰岛素组[(25.3±1.8)kg/m2、(25.5±1.7)kg/m2],差异均有统计学意义(P均<0.01)。提示相比基础胰岛素,吡格列酮二甲双胍可降低患者体质量。
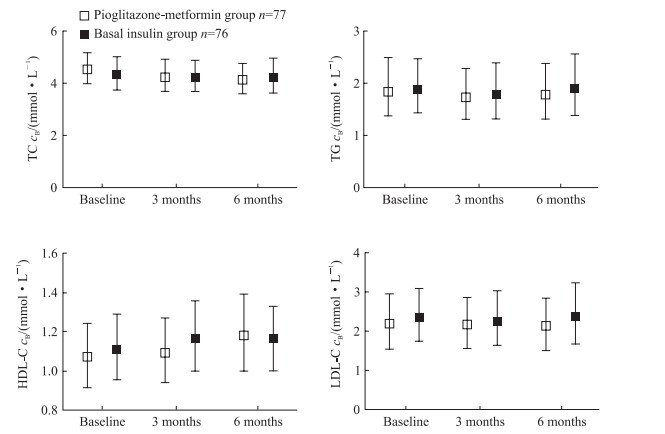
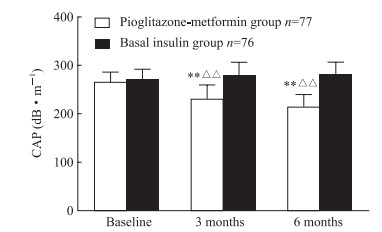
2.5 两组血脂及肝脂肪变性观察结果由图 3可见,经过6个月的治疗,吡格列酮二甲双胍组和基础胰岛素组血脂变化均不明显。由图 4可见,在治疗3个月、6个月时,吡格列酮二甲双胍组肝脂肪变性程度下降,与基线水平相比差异均有统计学意义(P均<0.01),与基础胰岛素组治疗3个月和6个月时相比差异亦均有统计学意义(P均<0.01)。提示相比基础胰岛素,吡格列酮二甲双胍可改善肝脂肪变性。
|
图 3 两组血糖控制不佳的超重或肥胖的2型糖尿病患者治疗前后血脂的变化 Fig 3 Blood lipid profile of type 2 diabetes mellitus patients with poor blood glucose control and overweight or obesity in two groups TC: Total cholesterol; TG: Triglyceride; HDL-C: High density lipoprotein-cholesterol; LDL-C: Low density lipoprotein-cholesterol. Median (lower quartile, upper quartile) |
|
图 4 两组血糖控制不佳的超重或肥胖的2型糖尿病患者治疗前后肝脂肪变性程度的变化 Fig 4 Fatty liver changes of type 2 diabetes mellitus patients with poor blood glucose control and overweight or obesity in two groups CAP: Controlled attenuation parameter. **P < 0.01 vs basal insulin group at the same follow-up time; △△P < 0.01 vs the same group at baseline. x±s |
2.6 其他不良事件观察结果
治疗期间,吡格列酮二甲双胍组2例(2.6%)患者发生低血糖,低于基础胰岛素组(15例,19.7%),差异有统计学意义(χ2=11.376,P < 0.01)。吡格列酮二甲双胍组4例(5.2%)患者发生水肿,6例(7.8%)发生胃肠道反应,发生率均略高于基础胰岛素组(各1例,1.3%),但差异均无统计学意义(χ2=1.821,P=0.367;χ2=3.675,P=0.116)。
3 讨论本研究在血糖控制不佳的超重或肥胖的2型糖尿病患者中比较了加用吡格列酮二甲双胍和基础胰岛素的疗效和二者对代谢指标的影响,结果显示对于胰岛功能尚可的患者,加用吡格列酮二甲双胍的降糖效果并不劣于加用基础胰岛素。然而,加用吡格列酮二甲双胍的患者还有额外获益,如自身胰岛素分泌减少、体质量下降及肝脂肪变性改善。
众所周知,对口服药物控制血糖不达标的2型糖尿病患者加用胰岛素能起到良好的降糖效果,然而使用胰岛素后常发生体质量增加。流行病学研究显示,我国2型糖尿病患者中合并腹型肥胖的患者比例高达45.4%[9]。而肥胖引发的胰岛素抵抗则是促使2型糖尿病及其合并症发生、发展的重要原因[10-11]。英国糖尿病前瞻性研究(United Kingdom Prospective Diabetes Study,UKPDS)显示,胰岛素治疗平均增加体质量4.0 kg,高于口服降糖药物[5]。因此,对于肥胖合并多种代谢紊乱的2型糖尿病患者,胰岛素或许并不是最佳选择。
本研究结果显示,对血糖控制欠佳的超重或肥胖的2型糖尿病患者,加用吡格列酮二甲双胍和加用基础胰岛素能达到相似的疗效。吡格列酮和二甲双胍是具有独立增敏作用的两种降糖药物[12]。吡格列酮是过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的配体,可作用于脂肪细胞促使其分化,减少脂肪分解,调节循环脂肪因子的表达,从而增强外周组织的胰岛素敏感性[13]。研究显示,吡格列酮可使HbA1c平均降低1.0%~1.5%[14]。二甲双胍则作用于肝脏和肌肉组织,减少糖异生,增加脂肪酸氧化,降低极低密度脂蛋白合成,达到缓解脂肪肝和增强肝脏胰岛素敏感性的作用[15]。研究显示,二甲双胍可使HbA1c平均降低1.0%~1.5%[7, 16]。因此,吡格列酮联合二甲双胍在增强胰岛素敏感性方面可以起机制互补、双管齐下的作用。研究显示,对一线二甲双胍单药治疗血糖控制不佳的2型糖尿病患者,联合吡格列酮可进一步增加胰岛素敏感性达33.8%,空腹血糖进一步下降2.09 mmol/L,HbA1c进一步下降0.83%[17]。本研究结果显示,对血糖控制欠佳的超重或肥胖的2型糖尿病患者,加用吡格列酮二甲双胍治疗3~6个月能使HbA1c下降,与加用基础胰岛素疗效相似;另外,加用吡格列酮二甲双胍治疗的患者的胰岛素水平低于加用基础胰岛素的患者,提示在改善胰岛素抵抗方面,加用吡格列酮二甲双胍优于基础胰岛素。
对血糖控制欠佳的超重或肥胖的2型糖尿病患者,尽管加用吡格列酮二甲双胍与加用基础胰岛素疗效相似,但加用吡格列酮二甲双胍治疗后患者有更多的代谢获益。2型糖尿病患者常合并多重代谢紊乱,包括腹型肥胖、血脂紊乱、非酒精性脂肪肝病等。既往报道吡格列酮和二甲双胍均对血脂紊乱有一定的改善作用[18-20],但在本研究中,加用吡格列酮二甲双胍的患者血脂改善并不明显,因此吡格列酮二甲双胍能否改善血脂仍需要进一步研究。此外,既往研究显示,吡格列酮还能促进内脏脂肪向皮下脂肪转移[21]及改善非酒精性脂肪肝病[22-23]。Miyazaki等[24]研究报道,吡格列酮治疗16周后,患者内脏脂肪面积[治疗前(144±13)cm2,治疗后(131±16)cm2,P < 0.05]及内脏脂肪/皮下脂肪面积比(治疗前0.59±0.08,治疗后0.44±0.06,P < 0.01)下降。Belfort等[22]研究显示,吡格列酮治疗6个月能显著降低非酒精性脂肪肝病患者的肝脏脂肪含量。对于非酒精性脂肪肝炎患者,吡格列酮治疗12个月可减少患者肝细胞损伤,减少Mallory小体和肝脏纤维化程度[23]。本研究发现,吡格列酮二甲双胍治疗3~6个月后,患者肝脂肪变性程度改善,FibroScan®测得的CAP值较基线下降,且低于基础胰岛素组。
对于使用基础胰岛素时临床医师及患者较多担心的体质量增加和低血糖问题,吡格列酮二甲双胍组也有优势。虽然吡格列酮在一定程度上有增加体质量的作用,但既往研究报道吡格列酮联合二甲双胍并不会显著增加患者的体质量[14, 25]。本研究结果显示,加用吡格列酮二甲双胍有降低体质量的作用,这可能与我们适当的糖尿病教育及生活方式指导有关。在本研究中,吡格列酮二甲双胍治疗期间低血糖发生率也低于基础胰岛素组(P < 0.01);而在吡格列酮二甲双胍治疗期间常担心的其他不良反应如水肿、胃肠道反应等的发生率虽略高于基础胰岛素组,但差异均无统计学意义。因此,从不良反应角度来看,对血糖控制欠佳的超重或肥胖的2型糖尿病患者,加用吡格列酮二甲双胍优于加用基础胰岛素。
综上所述,对于胰岛功能尚可、合并超重或肥胖的2型糖尿病患者,在血糖控制不佳的情况下,加用吡格列酮二甲双胍可以在达到与加用基础胰岛素相似降糖效果的同时,获得包括体质量、高胰岛素血症、脂肪肝改善等多重代谢获益及较低的低血糖发生率。
| [1] |
KENDALL D M, CUDDIHY R M, BERGENSTAL R M. Clinical application of incretin-based therapy:therapeutic potential, patient selection and clinical use[J]. Eur J Intern Med, 2009, 20(Suppl 2): S329-S339. |
| [2] |
WALLIA A, MOLITCH M E. Insulin therapy for type 2 diabetes mellitus[J]. JAMA, 2014, 311: 2315-2325. DOI:10.1001/jama.2014.5951 |
| [3] |
RIDDLE M C, ROSENSTOCK J, GERICH J, Insulin Glargine 4002 Study Investigators. The treat-to-target trial:randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients[J]. Diabetes Care, 2003, 26: 3080-3086. DOI:10.2337/diacare.26.11.3080 |
| [4] |
HERMANSEN K, DAVIES M, DEREZINSKI T, MARTINEZ RAVN G, CLAUSON P, HOME P. A 26-week, randomized, parallel, treat-to-target trial comparing insulin detemir with NPH insulin as add-on therapy to oral glucose-lowering drugs in insulin-naive people with type 2 diabetes[J]. Diabetes Care, 2006, 29: 1269-1274. DOI:10.2337/dc05-1365 |
| [5] |
Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group[J]. Lancet, 1998, 352: 837-853. DOI:10.1016/S0140-6736(98)07019-6 |
| [6] |
Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group[J]. Lancet, 1998, 352: 854-865. DOI:10.1016/S0140-6736(98)07037-8 |
| [7] |
DEROSA G, MAFFIOLI P, SALVADEO S A, FERRARI I, GRAVINA A, MEREU R, et al. Direct comparison among oral hypoglycemic agents and their association with insulin resistance evaluated by euglycemic hyperinsulinemic clamp:the 60's study[J]. Metabolism, 2009, 58: 1059-1066. DOI:10.1016/j.metabol.2009.03.007 |
| [8] |
ALBERTI K G, ZIMMET P Z. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1:diagnosis and classification of diabetes mellitus provisional report of a WHO consultation[J]. Diabet Med, 1998, 15: 539-553. DOI:10.1002/(SICI)1096-9136(199807)15:7<539::AID-DIA668>3.0.CO;2-S |
| [9] |
HOU X, LU J, WENG J, JI L, SHAN Z, LIU J, et al. Impact of waist circumference and body mass index on risk of cardiometabolic disorder and cardiovascular disease in Chinese adults: a national diabetes and metabolic disorders survey[J/OL]. PLoS One, 2013, 8: e57319. doi: 10.1371/journal.pone.0057319.
|
| [10] |
YE J. Mechanisms of insulin resistance in obesity[J]. Front Med, 2013, 7: 14-24. DOI:10.1007/s11684-013-0262-6 |
| [11] |
AN Y, ZHANG P, WANG J, GONG Q, GREGG E W, YANG W, et al. Cardiovascular and all-cause mortality over a 23-year period among Chinese with newly diagnosed diabetes in the Da Qing IGT and Diabetes Study[J]. Diabetes Care, 2015, 38: 1365-1371. DOI:10.2337/dc14-2498 |
| [12] |
CHENG A Y, FANTUS I G. Oral antihyperglycemic therapy for type 2 diabetes mellitus[J]. CMAJ, 2005, 172: 213-226. DOI:10.1503/cmaj.1031414 |
| [13] |
ALDHAHI W, HAMDY O. Adipokines, inflammation, and the endothelium in diabetes[J]. Curr Diab Rep, 2003, 3: 293-298. DOI:10.1007/s11892-003-0020-2 |
| [14] |
ARONOFF S, ROSENBLATT S, BRAITHWAITE S, EGAN J W, MATHISEN A L, SCHNEIDER R L. Pioglitazone hydrochloride monotherapy improves glycemic control in the treatment of patients with type 2 diabetes:a 6-month randomized placebo-controlled dose-response study. The Pioglitazone 001 Study Group[J]. Diabetes Care, 2000, 23: 1605-1611. DOI:10.2337/diacare.23.11.1605 |
| [15] |
ZHOU G, MYERS R, LI Y, CHEN Y, SHEN X, FENYK-MELODY J, et al. Role of AMP-activated protein kinase in mechanism of metformin action[J]. J Clin Invest, 2001, 108: 1167-1174. DOI:10.1172/JCI13505 |
| [16] |
GARBER A J, DUNCAN T G, GOODMAN A M, MILLS D J, ROHLF J L. Efficacy of metformin in type Ⅱ diabetes:results of a double-blind, placebo-controlled, dose-response trial[J]. Am J Med, 1997, 103: 491-497. DOI:10.1016/S0002-9343(97)00254-4 |
| [17] |
EINHORN D, RENDELL M, ROSENZWEIG J, EGAN J W, MATHISEN A L, SCHNEIDER R L. Pioglitazone hydrochloride in combination with metformin in the treatment of type 2 diabetes mellitus:a randomized, placebo-controlled study. The Pioglitazone 027 Study Group[J]. Clin Ther, 2000, 22: 1395-1409. DOI:10.1016/S0149-2918(00)83039-8 |
| [18] |
ABBASI F, KAMATH V, RIZVI A A, CARANTONI M, CHEN Y D, REAVEN G M. Results of a placebo-controlled study of the metabolic effects of the addition of metformin to sulfonylurea-treated patients. Evidence for a central role of adipose tissue[J]. Diabetes Care, 1997, 20: 1863-1869. DOI:10.2337/diacare.20.12.1863 |
| [19] |
LANDIN K, TENGBORN L, SMITH U. Treating insulin resistance in hypertension with metformin reduces both blood pressure and metabolic risk factors[J]. J Intern Med, 1991, 229: 181-187. DOI:10.1111/j.1365-2796.1991.tb00328.x |
| [20] |
HERZ M, JOHNS D, REVIRIEGO J, GROSSMAN L D, GODIN C, DURAN S, et al. A randomized, double-blind, placebo-controlled, clinical trial of the effects of pioglitazone on glycemic control and dyslipidemia in oral antihyperglycemic medication-naive patients with type 2 diabetes mellitus[J]. Clin Ther, 2003, 25: 1074-1095. DOI:10.1016/S0149-2918(03)80068-1 |
| [21] |
BAYS H, MANDARINO L, DEFRONZO R A. Role of the adipocyte, free fatty acids, and ectopic fat in pathogenesis of type 2 diabetes mellitus:peroxisomal proliferator-activated receptor agonists provide a rational therapeutic approach[J]. J Clin Endocrinol Metab, 2004, 89: 463-478. DOI:10.1210/jc.2003-030723 |
| [22] |
BELFORT R, HARRISON S A, BROWN K, DARLAND C, FINCH J, HARDIES J, et al. A placebo-controlled trial of pioglitazone in subjects with nonalcoholic steatohepatitis[J]. N Engl J Med, 2006, 355: 2297-2307. DOI:10.1056/NEJMoa060326 |
| [23] |
AITHAL G P, THOMAS J A, KAYE P V, LAWSON A, RYDER S D, SPENDLOVE I, et al. Randomized, placebo-controlled trial of pioglitazone in nondiabetic subjects with nonalcoholic steatohepatitis[J]. Gastroenterology, 2008, 135: 1176-1184. DOI:10.1053/j.gastro.2008.06.047 |
| [24] |
MIYAZAKI Y, MAHANKALI A, MATSUDA M, MAHANKALI S, HARDIES J, CUSI K, et al. Effect of pioglitazone on abdominal fat distribution and insulin sensitivity in type 2 diabetic patients[J]. J Clin Endocrinol Metab, 2002, 87: 2784-2791. DOI:10.1210/jcem.87.6.8567 |
| [25] |
KAKU K. Efficacy and safety of therapy with metformin plus pioglitazone in the treatment of patients with type 2 diabetes:a double-blind, placebo-controlled, clinical trial[J]. Curr Med Res Opin, 2009, 25: 1111-1119. DOI:10.1185/03007990902820816 |
 2019, Vol. 40
2019, Vol. 40


