宫颈癌是恶性程度极高的妇科恶性肿瘤之一,其发病率在发展中国家位列妇科恶性肿瘤之首,在女性恶性肿瘤中仅次于乳腺癌位居第4位[1]。宫颈癌的早期治疗效果良好,患者5年生存率可超过90%;而中晚期治疗效果欠佳,死亡率高,患者5年生存率仅约为50%[2]。因此,宫颈癌的早期诊断和治疗对提高其疗效及降低死亡率尤为重要。近年来对宫颈癌发病机制的深入研究发现,宫颈癌的发生、发展、侵袭及转移涉及多基因的异常表达,其中包括活化的蛋白激酶C受体1(receptor for activated C kinase 1,RACK1)、低氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)和血管内皮生长因子(vascular endothelial growth factor,VEGF)等基因[3-5]。本研究通过免疫组织化学染色ABC法检测85例宫颈癌组织及其对应癌旁组织中RACK1、HIF-1α和VEGF蛋白的表达情况,拟分析这3种蛋白表达与宫颈癌患者临床病理特征的关系及这3种蛋白表达之间的相关性,探讨RACK1、HIF-1α和VEGF蛋白表达在宫颈癌诊疗中的临床意义。
1 资料和方法 1.1 一般资料选取2014年6月至2018年6月于我院行手术切除并经病理确诊的85例宫颈癌组织及对应癌旁组织标本。患者年龄为28~75岁,平均(50.5±10.1)岁,其中≤50岁者32例、>50岁者53例;肿瘤直径≤4 cm者64例、>4 cm者21例;肿瘤浸润深度≤1/2肌层者25例、>1/2肌层者60例;病理分级Ⅰ级者10例、Ⅱ级者17例、Ⅲ级者58例;淋巴结转移阴性者46例、阳性者39例。本研究通过我院伦理委员会审批。
1.2 免疫组织化学染色取得宫颈癌组织及癌旁组织样本后,立即置于10%甲醛溶液中固定过夜,经梯度乙醇脱水,浸二甲苯和石蜡,然后包埋,切成3套4 μm厚白片,存放于4 ℃冰箱中备染。采用免疫组织化学染色ABC法检测宫颈癌组织及其癌旁组织中RACK1、HIF-1α、VEGF蛋白的表达,按试剂盒说明书步骤操作。RACK1兔抗人单克隆抗体购自英国Abcam公司,HIF-1α鼠抗人单克隆抗体购自美国Santa Cruz公司,VEGF兔抗人单克隆抗体购自英国Abcam公司,免疫组织化学染色ABC试剂盒购自美国Vectorlabs公司。用已知阳性组织作阳性对照,抗体稀释液作阴性对照。
1.3 免疫组织化学染色结果判定免疫组织化学染色结束后,在显微镜下观察各抗体的染色质量、定位、强度和范围,由2名具有中级以上职称的病理医师分别独立对病理切片进行半定量评分。RACK1染色主要定位于细胞膜和细胞质,HIF-1α、VEGF染色主要定位于细胞核和细胞质。免疫组织化学染色强度分为4个等级:无着色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分;染色面积分为4个等级:阳性细胞占0~5%计0分,6%~25%计1分,26%~50%计2分,50%以上计3分[3]。以染色强度与染色面积的乘积作为染色的最后得分,0~1分为阴性,2~5分为弱阳性,6~8分为中阳性,9分为强阳性;弱阳性、中阳性和强阳性的数目之和为各抗体染色阳性数量[3]。抗体的阳性率(%)=阳性样本总数量/待测样本总数[3]。
1.4 统计学处理应用SPSS 19.0软件进行统计学分析。计数资料以例数和百分数表示,组间比较采用χ2检验;RACK1、HIF-1α和VEGF蛋白表达的相关性采用Spearman相关分析。检验水准(α)为0.05。
2 结果 2.1 免疫组织化学染色结果免疫组织化学染色结果(图 1)显示,RACK-1蛋白和HIF-1α蛋白在宫颈癌组织中多为中、强阳性表达,在癌旁组织中多为弱、中阳性表达;VEGF蛋白在宫颈癌组织和癌旁组织中多为中、强阳性表达。癌旁组织中RACK1蛋白表达呈阳性的共有21例,阳性率为24.7%(21/85),而其在宫颈癌组织中的阳性率为81.2%(69/85)。癌旁组织中HIF-1α蛋白表达呈阳性的仅有3例,阳性率为3.5%(3/85),而其在宫颈癌组织中的阳性率为63.5%(54/85)。癌旁组织中VEGF蛋白表达呈阳性的有13例,阳性率为15.3%(13/85),而其在宫颈癌组织中的阳性率高达89.4%(76/85)。RACK1、HIF-1α、VEGF蛋白在宫颈癌组织和癌旁组织中的阳性表达差异均有统计学意义(χ2=10.456,P<0.05;χ2=28.767,P<0.05;χ2=32.692,P<0.05)。
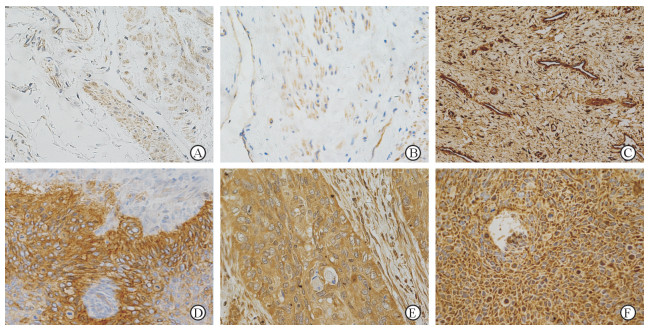
|
图 1 RACK1、HIF-1α、VEGF蛋白在宫颈癌组织及对应癌旁组织中的表达 Fig 1 Expression of RACK1, HIF-1α, and VEGF in cervical cancer and corresponding paracancerous tissues A-C: Paracanceruos tissues; D-F: Cervical cancer tissues. A: Weakly to moderately positive expression of RACK1; B: Weakly to moderately positive expression of HIF-1α; C: Moderately to strongly positive expression of VEGF; D: Moderately to strongly positive expression of RACK1; E: Moderately to strongly positive expression of HIF-1α; F: Moderately to strongly positive expression of VEGF. RACK1: Receptor for activated C kinase 1; HIF-1α: Hypoxia-inducible factor 1α; VEGF: Vascular endothelial growth factor. Immunohistochemical staining ABC method. Original magnification: ×400 |
2.2 宫颈癌组织中RACK1、HIF-1α和VEGF蛋白的表达与患者临床病理特征的关系
RACK1、HIF-1α、VEGF蛋白在宫颈癌组织中的表达与患者临床病理特征关系的分析结果显示,宫颈癌组织中RACK1蛋白的表达与肿瘤浸润深度、病理分级及淋巴结是否转移有关(P均<0.05);HIF-1α和VEGF蛋白的表达与肿瘤直径、浸润深度、病理分级及淋巴结是否转移有关(P均<0.05)。RACK1、HIF-1α、VEGF蛋白表达均与患者年龄无关(P均>0.05)。见表 1。
|
|
表 1 宫颈癌组织中RACK1、HIF-1α和VEGF蛋白表达与患者临床病理特征的关系 Tab 1 Relationship between expression of RACK1, HIF-1α and VEGF in cervical cancer tissues and patient clinicopathological features |
2.3 宫颈癌组织中RACK1、HIF-1α和VEGF蛋白表达的相关性分析
宫颈癌组织中RACK1、HIF-1α、VEGF蛋白表达的Spearman相关分析结果显示,RACK1、HIF-1α、VEGF蛋白的表达两两之间呈正相关关系(RACK1 vs HIF-1α:r=0.523,P=0.043 9;RACK1 vs VEGF:r=0.428,P=0.033 7;HIF-1α vs VEGF:r=0.689,P=0.024 5),提示这3种蛋白可能在宫颈癌的发生和发展中起协同作用。
3 讨论宫颈癌严重危害着广大女性的身体健康,其发生率和死亡率均居妇科肿瘤前列[1]。宫颈癌较易发生局部侵袭和淋巴结转移,伴有盆腔转移的宫颈癌患者术后复发率超过50%[2, 6]。因此,宫颈癌的早期的诊断和治疗十分重要。
RACK1是一种高度保守的胞质内游离支架蛋白,其为蛋白激酶CβⅡ(protein kinase CβⅡ,PKCβⅡ)受体。近年的研究表明,RACK1蛋白的异常表达与肺癌、胃癌和胶质瘤等多种恶性肿瘤的发生和预后有关[7-10]。本研究结果表明,RACK1在宫颈癌组织中高表达,阳性率为81.2%(69/85),与肿瘤的浸润深度、病理分级及淋巴结是否转移有关(P均<0.05),提示其可作为宫颈癌发生、侵袭、转移的重要指标。
HIF-1α是一种在缺氧状态下具有活性且稳定的转录因子,其可作为肿瘤内缺氧的一项指标[11-12]。文献报道,HIF-1α在肝癌、宫颈癌、甲状腺癌等多种肿瘤组织中异常表达,并且与肿瘤的生长、侵袭、转移和预后相关[12-14]。本研究结果表明,HIF-1α在宫颈癌组织中的表达高于癌旁组织,阳性率为63.5%(54/85),且与肿瘤直径、浸润深度、病理分级及淋巴结是否转移有关(P均<0.05),提示HIF-1α在宫颈癌的生长、侵袭和转移中起重要作用。
VEGF是血管新生过程中一种重要的因子,能够促进内皮细胞分裂增殖、增加血管内皮通透性、刺激新生血管形成,从而促进肿瘤的生长、侵袭和转移[15]。研究显示VEGF的高表达与肿瘤的恶性程度和患者的不良预后密切相关[16]。本研究结果表明,VEGF在宫颈癌组织中的表达高于癌旁组织,阳性率为89.4%(76/85),且与肿瘤直径、浸润深度、病理分级及淋巴结是否转移有关(P均<0.05),说明VEGF与宫颈癌发生、生长、侵袭和转移关系密切。
关于肿瘤组织中RACK1的表达与HIF-1α和VEGF的关系鲜有报道。有文献表明RACK1蛋白在新生血管中高表达[17],而HIF-1α和VEGF蛋白在肿瘤新生血管形成时也同样高表达[12, 18],这3种蛋白可能在促进肿瘤新生血管的生长方面发挥各自作用。一般认为肿瘤的快速生长和肿瘤细胞的增殖特性使肿瘤组织处于低氧缺血状态,此时容易产生大量的HIF-1α,从而激活包括VEGF在内的众多靶基因和蛋白的表达,诱导肿瘤新生血管形成,提高肿瘤组织内部能量转运能力,从而使肿瘤组织适应低氧环境,促进其生长、侵袭和转移[18-19]。本研究结果表明宫颈癌组织中高表达的RACK1、HIF-1α、VEGF蛋白两两之间呈正相关关系(RACK1 vs HIF-1α:r=0.523,P=0.043 9;RACK1 vs VEGF:r=0.428,P=0.033 7;HIF-1α vs VEGF:r=0.689,P=0.024 5),由此我们推测,宫颈癌组织在快速生长和发展的低氧状态下,HIF-1α被激活并表达增加,从而刺激VEGF的高表达,或可能激活RACK1,并通过一系列的信号通路活化,共同作用促进肿瘤新生血管形成,提高宫颈癌细胞的血液运输和交换能力以适应低氧环境,最终促进宫颈癌细胞的生长、侵袭和转移。
综上所述,RACK1、HIF-1α、VEGF与宫颈癌的发生、发展、侵袭和转移关系密切,在宫颈癌的临床诊断和治疗过程中可作为监测肿瘤生长、侵袭和转移的重要参考指标,也为宫颈癌的精准基因治疗提供了可能的新靶点和新思路。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
LAI J C, CHOU Y J, HUANG N, TSAI J J, HUANG S M, YANG Y C, et al. Survival analysis of stageⅡA1 andⅡA2 cervical cancer patients[J]. Taiwan J Obstet Gynecol, 2013, 52: 33-38. DOI:10.1016/j.tjog.2013.01.006 |
| [3] |
张巍. 宫颈癌患者Twist、RACK-1蛋白检测的临床意义[J]. 中国民康医学, 2018, 30: 96-97. |
| [4] |
李云, 暴金玲, 尹国武. 宫颈癌组织中HIF-α、p53及Beclin1的表达水平探讨[J]. 中国妇幼健康研究, 2018, 29: 181-184. DOI:10.3969/j.issn.1673-5293.2018.02.013 |
| [5] |
林伍梅, 李艳芳, 刘富元. Ⅰb~Ⅱa期宫颈癌组织中HIF1α、VEGF的表达变化及其与MVD的关系[J]. 山东医药, 2010, 50: 95-96. |
| [6] |
ARBYN M, CASTELLSAGUÉ X, DE SANJOSÉ S, BRUNI L, SARAIYA M, BRAY F, et al. Worldwide burden of cervical cancer in 2008[J]. Ann Oncol, 2011, 22: 2675-2686. DOI:10.1093/annonc/mdr015 |
| [7] |
DUFF D, LONG A. Roles for RACK1 in cancer cell migration and invasion[J]. Cell Signal, 2017, 35: 250-255. DOI:10.1016/j.cellsig.2017.03.005 |
| [8] |
彭仁君. RACK1在胶质瘤中的表达及其功能的实验研究[D].长沙: 中南大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10533-1014403299.htm
|
| [9] |
FEI L, MA Y, ZHANG M, LIU X, LUO Y, WANG C, et al. RACK1 promotes lung cancer cell growth via an MCM7/RACK1/Akt signaling complex[J]. Oncotarget, 2017, 8: 40501-40513. |
| [10] |
王娜娜. RACK1在食管鳞癌预后及进展中的作用及与上皮间质转化的相关性研究[D].济南: 山东大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10422-1015368752.htm
|
| [11] |
SEMENZA G L. HIF-1, O2, and the 3 PHDs:how animal cells signal hypoxia to the nucleus[J]. Cell, 2001, 107: 1-3. DOI:10.1016/S0092-8674(01)00518-9 |
| [12] |
WANG M, ZHAO X, ZHU D, LIU T, LIANG X, LIU F, et al. HIF-1α promoted vasculogenic mimicry formation in hepatocellular carcinoma through LOXL2 up-regulation in hypoxic tumor microenvironment[J/OL]. J Exp Clin Cancer Res, 2017, 36: 60. doi: 10.1186/s13046-017-0533-1.
|
| [13] |
VUKOVIC V, HAUGLAND H K, NICKLEE T, MORRISON A J, HEDLEY D W. Hypoxia-inducible factor-α is an intrinsic marker for hypoxia in cervical cancer xenograft[J]. Cancer Res, 2001, 61: 7394-7398. |
| [14] |
LODEWIJK L, VAN DIEST P, VAN DER GROEP P, TER HOEVE N, SCHEPERS A, MORREAU J, et al. Expression of HIF-1α in medullary thyroid cancer identifies a subgroup with poor prognosis[J]. Oncotarget, 2017, 8: 28650-28659. |
| [15] |
KUEHN R, LELKES P I, BLOECHLE C, NIENDORF A, IZBICKI J R. Angiongesis, angiogenic growth factor, and cell adhesion molecules are upregulated in chronic pancreatic diseases:angiogenesis in chronic pancreatics and in pancreatic cancer[J]. Pancreas, 1999, 18: 96-103. DOI:10.1097/00006676-199901000-00012 |
| [16] |
GUYOT M, HILMI C, AMBROSETTI D, MERLANO M, LO NIGRO C, DURIVAULT J, et al. Targeting the pro-angiogenic forms of VEGF or inhibiting their expression as anti-cancer strategies[J]. Oncotarget, 2017, 8: 9174-9188. |
| [17] |
BERNS H, HUMAR R, HENGERER B, KIEFER F N, BATTEGAY E J. RACK1 is up-regulated in angiogenesis and human carcinomas[J]. FASEB J, 2000, 14: 2549-2558. DOI:10.1096/fj.99-1038com |
| [18] |
ZHANG Y, LIU Y, ZOU J, YAN L, DU W, ZHANG Y, et al. Tetrahydrocurcumin induces mesenchymal-epithelial transition and suppresses angiogenesis by targeting HIF-1α and autophagy in human osteosarcoma[J]. Oncotarget, 2017, 8: 91134-91149. |
| [19] |
曹文庆, 赵峰霞, 赵玉哲, 张静. VEGF与Notch1在乳腺癌浸润和转移中的作用及其相关性[J]. 肿瘤基础与临床, 2012, 25: 480-483. |
 2019, Vol. 40
2019, Vol. 40


