苦黄注射液源于《伤寒论》的茵陈蒿汤(茵陈、大黄、山栀),是公认的治疗湿热黄疸明方。邹良才老中医改良茵陈蒿汤而得苦黄注射液。苦黄注射液由苦参、大黄、茵陈、柴胡、大青叶组成,具有清热利湿、疏肝退黄的作用,主治湿热型黄疸,也用于黄疸病毒性肝炎。苦黄注射液退黄降酶、利胆保肝的作用已在临床得到证实[1-2]。经分析,苦黄注射液除含有已列入质量标准中作为定量测定的大黄蒽醌和苦参碱等成分外,还含有丰富的多糖类物质和赖氨酸、亮氨酸、苏氨酸等19种人体需要的氨基酸,以及锌、镁、酮、磷等微量元素[2]。苦黄注射液化学成分复杂,其改善肝炎、退黄的有效成分及相应的作用机制尚不清楚,因此研究苦黄注射液的有效活性成分、作用靶点及其保肝退黄的作用机制具有重要的科学意义。
网络药理学是研究多靶点干预疾病网络以期达到理想药效的理论,基于网络药理学的分析方法特别适合复杂生物系统的相互作用研究,为探寻中药作用机制提供了一个全新的视角和解决方案[3-4]。施岚尔等[5]采用网络药理学方法快速筛选大黄黄连泻心汤中治疗2型糖尿病的活性成分,并构建了药物-靶标-疾病网络,初步探索了大黄黄连泻心汤治疗2型糖尿病的作用机制。吴嘉瑞等[6]利用数据库筛选出“金银花-连翘”药对的所有化学成分,并预测了其潜在作用靶点,在构建的“药物分子-靶点-疾病”网络中还预测了该药对可能相关疾病的范围,初步验证了该药对的作用机制。综上可见,基于网络药理学的预测分析可以深入挖掘中药药效的物质基础,并理解其作用机制。
本研究通过检索中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)及相关文献收集苦黄注射液活性成分,并在此基础上利用药物靶点分析平台预测苦黄注射液可能的作用靶点,采用Cytoscape 3.6.1软件构建苦黄注射液改善肝炎及退黄作用的活性成分-作用靶点网络,对这些靶点进行蛋白-蛋白相互作用分析,利用生物学信息注释数据库(database for annotation, visualization and integrated discovery,DAVID)进行基因功能和信号通路分析,探讨苦黄注射液保肝退黄的可能机制。
1 材料和方法 1.1 苦黄注射液中活性成分的筛选通过检索TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)及相关文献,分别收集苦黄注射液中柴胡、苦参、茵陈、大黄、大青叶中主要的化学成分,建立苦黄注射液化学成分数据库。在此基础上,考察化学成分的口服生物利用度(oral bioavailability,OB)、药物相似性(drug-likeness,DL)、化合物含量及相关生物功能,通过大量文献筛选苦黄注射液中有效的活性成分。
1.2 活性成分潜在作用靶点的预测主要通过化合物与蛋白互作数据库(STITCH,http://stitch.embl.de)进行分析,输入活性成分的英文名称,选择“人类”物种进行搜索。将搜索得到的靶点结果以TSV格式保存,筛选结合得分>0.7的靶点,靶点名称以靶点基因名称为准,以便后续靶点网络的构建、蛋白相互作用网络构建、基因功能和信号通路分析等。
1.3 苦黄注射液“活性成分-作用靶点”网络的构建根据苦黄注射液中主要有效成分预测的靶点,建立活性成分-作用靶点之间的相互对应关系。将活性成分和作用靶点作为网络中的节点(node),两者之间的相互作用作为网络中的连接(edge),制成Excel表格,导入Cytoscape 3.6.1软件中构建苦黄注射液“活性成分-作用靶点”网络。
1.4 蛋白质相互关系网络的构建蛋白质相互作用数据库(STRING,http://string-bd.org)是包含已知和预测的蛋白质-蛋白质相互作用的数据库, 其中收集了大量的蛋白质相互作用关系。将苦黄注射液的蛋白靶点导入STRING数据库,获取蛋白间的相互作用关系,将结果保存成TSV格式,保留文件中节点1、节点2和结合得分信息并导入Cytoscape 3.6.1软件绘制相互作用网络,对网络进行分析,保存结果。使用Cytoscape 3.6.1软件中的Generate style from statistics工具设置节点大小和颜色反映Degree的大小、边的粗细反映结合得分的大小,获得苦黄注射液作用靶点蛋白-蛋白相互作用网络图。
1.5 基因功能和信号通路分析利用DAVID数据库(https://david.ncifcrf.gov)为基因和蛋白提供系统综合的生物功能注释信息,以对差异基因进行功能和通路富集分析。将苦黄注射液的作用靶点导入DAVID数据库,选择标识符为标准的基因名称,列表类型设置为基因列表,限定物种为人,对苦黄注射液作用靶点进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析,保存结果,并按照涉及的靶点数目多少进行排序,筛选排名靠前的生物过程或信号通路,采用GraphPad Prism 5.0软件绘图。基因本体(gene ontology,GO)富集分析指在某一功能层次上统计蛋白或基因的数目组成的一个有向无环图,包括生物过程、分子功能和细胞组分3个分支。使用Cytoscape 3.6.1软件BinGO插件对苦黄注射液中活性成分作用靶点进行GO分析,阈值设置为P < 0.05,筛选靠前的生物过程,并采用GraphPad Prism 5.0软件绘图。
2 结果 2.1 苦黄注射液中活性成分的筛选通过检索TCMSP及相关文献,分别从柴胡、苦参、大黄、茵陈、大青叶中收集到349、113、92、53和45个主要的化学成分。对收集到的化学成分,以OB>30%、DL>5%以及相关文献参考作为筛选标准,共得到活性成分16个,其中柴胡7个(α-波菜甾醇、豆甾醇、黄芩苷、异鼠李素、曲克芦丁、檞皮素、山奈酚),苦参5个(贯叶金丝桃素、槲皮素、苦参碱、木犀草素、芒柄花素),茵陈4个(β-谷甾醇、异鼠李素、槲皮素、芫花素),大青叶3个(β-谷甾醇、芸苔葡糖硫苷、靛玉红),大黄2个(β-谷甾醇、芦荟大黄素)。
2.2 潜在靶点的预测筛选共得到85个蛋白靶点。通过与GeneCard数据库(http://www.genecards.org/)和在线人类孟德尔遗传数据系统(online Mendelian inheritance in man,OMIM;https://omim.org/)中肝炎及黄疸有关的基因进行比对,筛选出17个可能与苦黄注射液改善肝炎及退黄作用相关的作用靶点,分别为肿瘤坏死因子(tumor necrosis factor,TNF)、溶质载体有机阴离子转运蛋白家族成员1B1(solute carrier organic anion transporter family member 1B1,SLCO1B1)、Toll样受体2(Toll-like receptor 2,TLR2)、血红素加氧酶1(heme oxygenase 1,HMOX1)、丝裂原活化蛋白激酶8(mitogen-activated protein kinase 8,MAPK8)、细胞周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1)、细胞色素P450家族3亚家族A成员4(cytochrome P450 family 3 subfamily A member 4,CYP3A4)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、载脂蛋白E(apolipoprotein E,APOE)、ATP结合盒式亚家族B成员11(ATP-binding cassette subfamily B member 11,ABCB11)、核受体亚家族1组Ⅰ成员2(nuclear receptor subfamily 1 group Ⅰ member 2,NR1Ⅰ2)、UDP葡糖醛酸基转移酶家族1成员(UDP glucuronosyltransferase family 1 member,UGT1)A9、UGT1A1、UGT1A10、UGT1A3、UGT1A7、UGT1A8。
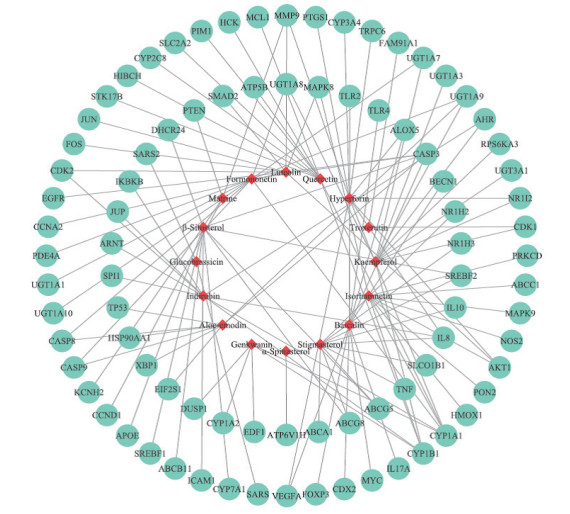
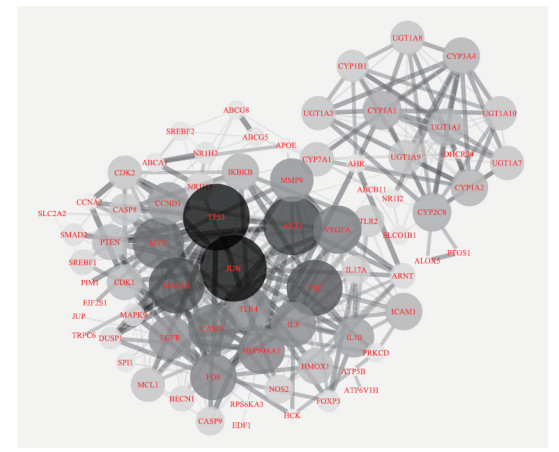
2.3 苦黄注射液“活性成分-作用靶点”网络及蛋白质相互关系网络的构建由图 1可得异鼠李素、木犀草素可共同作用于靶点MAPK8,山奈酚、芒柄花素、芦荟大黄素可共同作用于靶点UGT1A9,而β-谷甾醇可同时作用于靶点ABCG5、ABCG8、SREBF2、DHCR24、APOE、CASP3、SREBF1、ABCB11。同一靶点可对应不同的活性成分,不同靶点也可对应相同的活性成分,充分体现了苦黄注射多成分、多靶点的作用特点。将蛋白靶点导入STRING数据库获取蛋白间的相互作用关系,构建的蛋白质相互关系网络见图 2。
|
图 1 苦黄注射液的“活性成分-作用靶点”网络图 Fig 1 Component-target network of Kuhuang injection The red diamonds represent the main active components of Kuhuang injection, the green circles represent the potential targets of Kuhuang injection, and the lines represent the correlation between the active components and the potentail targets |
|
图 2 苦黄注射液靶点蛋白相互作用网络 Fig 2 Protein interaction network of Kuhuang injection The size and the color of the node represent the value of the degree, the larger node and the darker color represent the gradual increase of degree value. The lines represent the correlation among the proteins, the thicker the line, the larger the combined score |
2.4 基因功能分析
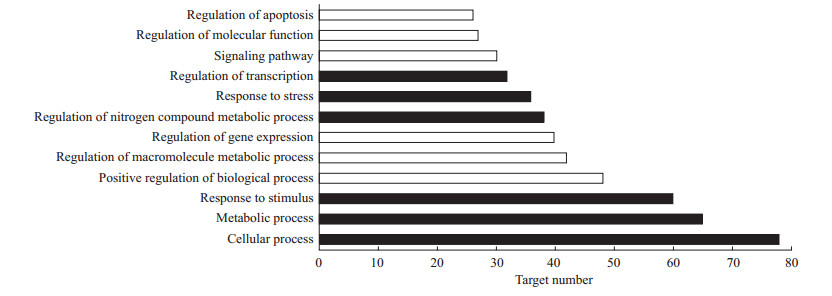
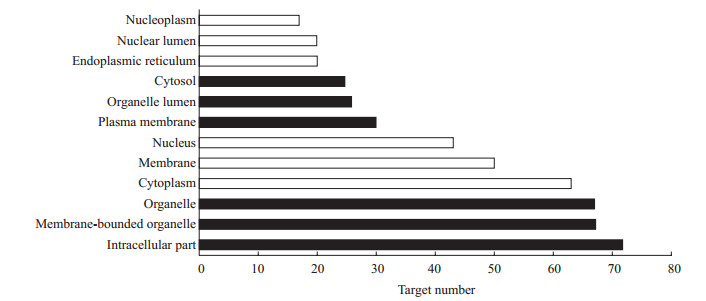
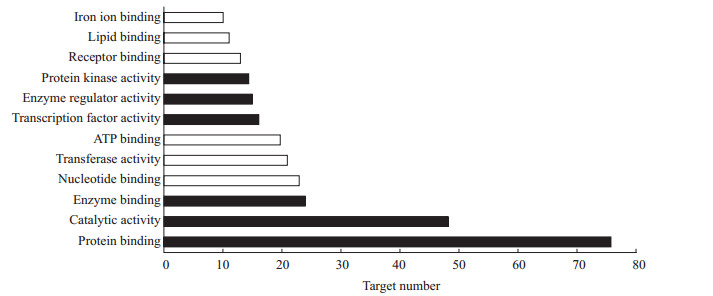
结果详见图 3~5。其中生物过程分析(图 3)中排名靠前的有细胞过程(78个靶点)、代谢过程(65个靶点)、对刺激应答(60个靶点)、生物过程正调节(48个靶点)、高分子代谢过程调节(42个靶点)、基因表达调控调节(40个靶点),细胞组分分析(图 4)中排名靠前的有细胞内部分(72个靶点)、膜状细胞器(67个靶点)、细胞器(67个靶点)、细胞质(63个靶点)、膜(50个靶点)、细胞核(43个靶点),分子功能分析(图 5)中排名靠前的有蛋白结合活性(76个靶点)、催化活性(48个靶点)、酶结合活性(24个靶点)、核苷酸结合活性(23个靶点)。
|
图 3 苦黄注射液主要活性成分潜在作用靶点基因本体(GO)富集分析的生物过程结果 Fig 3 Enriched gene ontology (GO) terms for biological process of potential targets from main active components of Kuhuang injection |
|
图 4 苦黄注射液主要活性成分潜在作用靶点基因本体(GO)富集分析的细胞组分结果 Fig 4 Enriched gene ontology (GO) terms for cellular component of potential targets from main active components of Kuhuang injection |
|
图 5 苦黄注射液主要活性成分潜在作用靶点基因本体(GO)富集分析的分子功能结果 Fig 5 Enriched gene ontology (GO) terms for molecular function of potential targets from main active components of Kuhuang injection ATP: Adenosine triphosphate |
2.5 信号通路分析
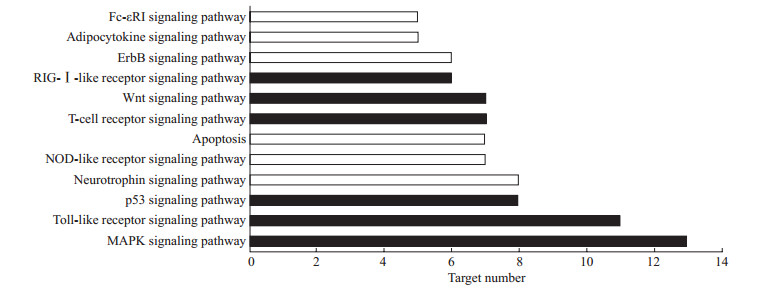
如图 6所示,排名靠前的是MAPK(13个靶点)、Toll样受体(11个靶点)、p53(8个靶点)和神经营养因子(8个靶点)等信号通路。
|
图 6 苦黄注射液主要活性成分潜在作用靶点KEGG富集分析的通路结果 Fig 6 Enriched KEGG pathways of potential targets from main active components of Kuhuang injection KEGG: Kyoto encyclopedia of genes and genomes; RIG: Retinoic acid-inducible gene; NOD: Nucleotide oligomerization domain; MAPK: Mitogen-activated protein kinase |
3 讨论
苦黄注射液是由茵陈蒿汤去山栀加苦参、大黄、大青叶和柴胡而得,主要用于治疗各种黄疸型肝炎,经证实该药能使大多数肝炎患者症状改善,异常肝功能好转,尤其是退黄作用显著[7-9],但其保肝退黄机制尚不清楚。
本研究结果显示通过检索TCMSP数据库共收集到苦黄注射液中16种主要的活性成分。中医学上柴胡主要用于镇静、止痛、抗菌消炎、保肝利胆、抗病毒等[10],成分主要有柴胡皂苷及挥发油等,具有多种生物活性[11]。柴胡中的柴胡皂苷对胆碱酯酶有抑制作用,能发挥拟胆碱样作用,调节消化系统和神经系统的功能[12],还可以保护肝细胞[13]。苦参的主要化学成分为生物碱和黄酮类化合物,生物碱多达20余种,以苦参碱和氧化苦参碱为主,这2种成分均对肝脏有保护作用[14]。茵陈功能为清热利湿、退黄疸,具有利胆、保肝的作用,可用于治疗黄疸型肝炎、胆囊炎等[15],其主要活性物质6,7-二甲基香豆素及茵陈色原酮、对羟基苯乙酮及绿原酸均有利胆作用,有文献报道茵陈色原酮和6,7-二甲基香豆素是其退黄的主要药效成分[16]。大青叶具有利胆的作用,能够促进胆汁的排泄、缓解疼痛[17]。大黄具有利胆退黄、保肝护肝的作用[18-19],其化学成分以结合状态的蒽醌类化合物为主,其中结合性蒽醌类衍生物双蒽酮苷类(如番泻苷A、B、C、D、E、F)致泻作用强。
本研究结果表明,苦黄注射液活性成分作用于85个蛋白靶点,成分靶点网络显示了苦黄注射液多成分、多靶点的保肝作用特点。蛋白作用网络显示了苦黄注射液靶蛋白间存在着相互关系,是复杂交互的网络,并不单独起作用。靶点的GO分析结果表明,苦黄注射液保肝作用涉及细胞过程、代谢过程、对刺激应答的生物过程,涉及细胞膜、细胞器、细胞质等细胞组分,有蛋白结合、核苷酸结合、酶结合以及催化活性等分子功能,是一个复杂的过程。KEGG靶点通路分析结果显示,苦黄注射液保肝退黄的靶点主要涉及MAPK、Toll样受体、p53、神经营养因子等信号通路。
本研究中,对苦黄注射液活性成分筛选得到17个与肝炎以及黄疸相关的蛋白靶点,其中SLCO1B1基因编码肝脏特异性的有机阴离子转运体,与胆红素肝摄取有关[20],并与亚洲人群胆红素水平有关[21]。HMOX1可将血红素裂解成胆绿素,在胆绿素还原酶的存在下转化成胆红素,利用锡-原卟啉(SnPP)抑制HMOX1活性,对包括新生儿在内的正常人和动物自发产生或实验诱导的高胆红素血症均能降低其血清胆红素水平[22]。UDP葡糖醛酸基转移酶家族(UGT1A1、UGT1A3、UGT1A7、UGT1A8、UGT1A9、UGT1A10)编码UDP葡糖醛酸基转移酶,可将小的亲脂性分子(如类固醇、胆红素、激素和药物)转化为水溶性可排泄的代谢物。苦黄注射液的活性成分可能通过以上靶点相互作用,实现其退黄作用。
苦黄注射液活性成分筛选得到的蛋白靶点中,TNF属于肿瘤坏死因子超家族,该细胞因子参与多种生物过程的调节,包括细胞增殖、分化、凋亡、脂质代谢和凝血过程。有报道显示,TNF的遗传变异与乙型肝炎病毒的清除有关[23]。MAPK8是MAPK家族的成员。MAPK充当多种生化信号的整合点,并且参与多种细胞过程(增殖、分化、转录调节和发育),MAPK信号通路与抗肝炎作用有关[24]。p53为肿瘤抑制因子,其表达与胆囊腺癌的发生、进展、转移、侵袭、预后密切相关[25]。研究表明,丹参酮ⅡA可以通过下调p53基因减少细胞的凋亡,通过减轻肝脏的炎症反应、抑制肝细胞凋亡的机制实现对肝脏保护作用[26]。TLR2在病原体识别和先天免疫的激活中起基础作用。Toll样受体介导的信号通路可导致固有免疫细胞活化,在肝脏炎症免疫和肝癌的发生过程中起重要作用[27]。苦黄注射液的活性成分可能通过以上靶点及信号通路实现其改善肝炎患者症状的作用。
综上所述,网络药理学分析显示苦黄注射液的16种活性成分作用于85个蛋白靶点,其中与肝炎及黄疸相关的蛋白靶点有17个,苦黄注射液可能通过SLCO1B1、HMOX1、UGT1A1、UGT1A3、UGT1A7、UGT1A8、UGT1A9和UGT1A10等靶点相互作用,实现其退黄作用,并通过TNF、MAPK8、p53和TLR2等靶点及相关的MAPK、Toll样受体、p53、神经营养因子等信号通路改善肝炎患者症状。本研究表明其作用机制涉及多种过程、分子和通路,体现了苦黄注射液多成分、多靶点、多途径的作用特点。本研究为苦黄注射液退黄保肝作用分子机制的进一步研究奠定了基础,同时也为研究其他复方中药提供了思路和方法。
| [1] |
李永康. 苦黄注射液的药理与临床[J]. 中国药房, 1993, 4: 40-41. |
| [2] |
王瑞云, 陈钟英, 夏培源, 李永康. 苦黄注射液的研制及临床应用[J]. 南京医科大学学报, 1995, 15: 499-501. |
| [3] |
XIONG J, RAYNER S, LUO K, LI Y, CHEN S. Genome wide prediction of protein function via a generic knowledge discovery approach based on evidence integration[J/OL]. BMC Bioinformatics, 2006, 7: 268. doi: 10.1186/1471-2105-7-268.
|
| [4] |
解静, 高杉, 李琳, 徐一兰, 高树明, 于春泉. 网络药理学在中药领域中的研究进展与应用策略[J]. 中草药, 2019, 50: 2257-2265. DOI:10.7501/j.issn.0253-2670.2019.10.001 |
| [5] |
施岚尔, 聂课朝, 张文婧, 郑美思, 林志勤, 朱章志. 基于网络药理学探讨大黄黄连泻心汤治疗2型糖尿病作用机制[J]. 中国实验方剂学杂志, 2019, 25: 160-166. |
| [6] |
吴嘉瑞, 金燕萍, 王凯欢, 刘鑫馗, 张丹, 张冰. 基于网络药理学的"金银花-连翘"药对作用机制分析[J]. 中国实验方剂学杂志, 2017, 23: 179-183. |
| [7] |
王瑞云, 陈钟英, 夏培源, 李永康. 苦黄注射液的研制及临床应用[J]. 南京医科大学学报, 1995, 15: 499-501. |
| [8] |
谢梅林, 陈葆荃, 顾振纶, 李永康, 纪德宝, 杨雪中. 苦黄注射液利胆作用研究[J]. 中成药, 1996, 18: 36-37. |
| [9] |
李永康. 苦黄注射液[J]. 中药新药杂志, 1993, 2: 30. |
| [10] |
张爱华, 郭姗姗. 柴胡的临床运用及药理研究[J]. 中医研究, 2019, 32: 7-9. |
| [11] |
杨军, 李承晏. 柴胡皂甙d的药理毒理作用及药代学研究进展[J]. 湖北医药学院学报, 2018, 37: 194-198. |
| [12] |
彭丽华. 柴胡皂苷对阻塞性黄疸肝细胞保护机制分析[J]. 中国中医药现代远程教育, 2011, 9: 56. |
| [13] |
尚立芝, 季书, 王琦, 潘晓丽. 柴胡疏肝散的抗肝纤维化作用研究[J]. 中药药理与临床, 2014, 30: 8-11. |
| [14] |
杨静波, 李宏杰. 苦参碱和氧化苦参碱对肝癌细胞增殖和凋亡的影响[J]. 中国临床药理学杂志, 2018, 34: 1067-1069. |
| [15] |
温扬智, 张刚. 茵陈蒿及其复方在急性肝胆疾病中的应用[J]. 中国中医急症, 2002, 11: 228-229. DOI:10.3969/j.issn.1004-745X.2002.03.077 |
| [16] |
郑雪花. 大青叶的化学成分与药理作用[J]. 怀化学院学报(自然科学), 2007, 26: 55-57. |
| [17] |
张希恩, 王利华. 大黄保肝利胆作用的药理与临床[J]. 中医药研究, 1995(4): 56-59. |
| [18] |
宋献美, 王雪银, 李宁宁, 崔伟锋, 梁瑞峰. 大黄总蒽醌对免疫性肝纤维化大鼠的保护作用及机制探讨[J]. 现代预防医学, 2018, 45: 2818-2822. |
| [19] |
霍晓乾, 谷宇, 张燕玲. 基于网络药理学的大黄利胆片的作用机制研究[J]. 中国中药杂志, 2018, 43: 2770-2776. |
| [20] |
ABE T, KAKYO M, TOKUI T, NAKAGOMI R, NISHIO T, NAKAI D, et al. Identification of a novel gene family encoding human liver-specific organic anion transporter LST-1[J]. J Biol Chem, 1999, 274: 17159-17163. DOI:10.1074/jbc.274.24.17159 |
| [21] |
KÖNIG J, CUI Y, NIES A T, KEPPLER D. A novel human organic anion transporting polypeptide localized to the basolateral hepatocyte membrane[J]. Am J Physiol Gastrointest Liver Physiol, 2000, 278: G156-G164. DOI:10.1152/ajpgi.2000.278.1.G156 |
| [22] |
夏振炜, 俞善昌, 李云珠, 陈舜年, 申庆祥, 奚正德, 等. 新生儿黄疸防治的实验研究[J]. 中华医学杂志, 1997, 77: 126-129. |
| [23] |
KIM Y J, LEE H S, YOON J H, KIM C Y, PARK M H, KIM L H, et al. Association of TNF-α promoter polymorphisms with the clearance of hepatitis B virus infection[J]. Hum Mol Genet, 2003, 12: 2541-2546. DOI:10.1093/hmg/ddg262 |
| [24] |
HARIKRISHNAN H, JANTAN I, HAQUE M A, KUMOLOSASI E. Anti-inflammatory effects of Phyllanthus amarus Schum. & Thonn. through inhibition of NF-κB, MAPK, and PI3K-Akt signaling pathways in LPS-induced human macrophages[J/OL]. BMC Complement Altern Med, 2018, 18: 224. doi: 10.1186/s12906-018-2289-3.
|
| [25] |
LIU Y, ZHANG Y, BAUTISTA D, TANG S, ZHOU J, LI C, et al. Trans-arterial p53-gene-embolization with gelatin sponge microparticles for hepatocellular carcinoma with BCLC stage B:single-center experience[J]. Cell Biochem Biophys, 2015, 71: 99-104. DOI:10.1007/s12013-014-0167-2 |
| [26] |
唐小利, 李双杰. 丹参酮ⅡA对急性重症肝炎小鼠p53的影响[J]. 四川医学, 2014, 35: 298-300. |
| [27] |
SEKI E, PARK E, FUJIMOTO J. Toll-like receptor signaling in liver regeneration, fibrosis and carcinogenesis[J]. Hepatol Res, 2011, 41: 597-610. DOI:10.1111/j.1872-034X.2011.00822.x |
 2019, Vol. 40
2019, Vol. 40


