临床上在进行胸部肿瘤(如乳腺癌、肺癌、霍奇金病、食管癌、贲门癌、胸腺瘤等)的放射治疗时,位于纵隔的心脏不可避免会受到照射损伤,即发生放射性心脏损伤(radiation-induced heart damage,RIHD)[1]。随着胸部肿瘤放射治疗的广泛应用,RIHD发生率已达20%~68%[2-3],成为严重的放射治疗不良反应,2015年Cella等[4]指出RIHD已经与传统的放射性肺纤维化损伤同等重要。然而,RIHD病因机制尚不明确,缺乏有效干预措施。动物实验研究发现机体组织受到电离辐射后早期会产生活性氧,氧化应激引起心脏局部产生无菌性炎症反应[5],因此RIHD被认为是一个渐进的炎症反应和纤维化综合作用的病理发展过程[6]。目前,RIHD动物模型种类涉及犬、大鼠、小鼠、兔等,照射造模的剂量差异较大,照射方法也存在单次照射和多次照射、心脏局部照射和动物全身照射等差异[7]。本研究在梳理已有动物实验模型的基础上,筛选优化大鼠造模条件,构建RIHD“炎性-纤维化”损伤动物模型,为进一步研究RIHD的发生机制和干预措施奠定基础。
1 材料和方法 1.1 实验动物、试剂和仪器无特定病原体级雄性Wistar大鼠220只,体质量(180±10)g,来源于甘肃中医药大学科研实验动物中心[实验动物生产许可证号:SCXK(甘)2011-0001]。肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、Ⅰ型胶原蛋白α1链(collagen typeⅠα1 chain,Col1a1)、Ⅲ型胶原蛋白α1链(collagen type Ⅲ α1 chain,Col3a1)、核因子κB(nuclear factor κB,NF-κB)p50和转化生长因子β1(transforming growth factor β1,TGF-β1)抗体购自美国Gene Tex公司,NF-κB p65抗体购自英国Abcam公司;大鼠心肌肌钙蛋白(cardiac troponin,cTn)和肌酸激酶同工酶MB(creatine kinase isoenzyme MB,CK-MB)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自上海酶联生物科技有限公司。X线辐照仪(型号:X-RAD 225)为美国Precision X-Ray公司产品,PowerPoc Basic凝胶电泳仪为美国Bio-Rad公司产品,Azure Biosystems C300化学发光成像系统为美国Azure Biosystems公司产品。
1.2 照射方法和造模条件筛选用X线辐照仪单次照射动物。照射参数:缘皮间距(source-to-skin distance,SSD)30.0 cm,0.3 mm铜管滤器,电压225 kV,电流13.30 mA,剂量率6.1 Gy/min,照射剂量设置为4、6、8、12、16、18、20、25、30 Gy。照射前将大鼠经腹腔注射10%水合氯醛(3 mL/kg)麻醉,固定于消毒清洁木板上,暴露胸前壁,观察心脏搏动最明显处,使心脏位于照射野中心。照射结束后将大鼠分笼放置于室温26~28 ℃下直至清醒,以免麻醉后体温过低死亡。
将70只大鼠随机分为7组(每组10只),分别以0、4、6、8、12、16、18 Gy剂量进行全身照射,观察动物存活情况,照射后1周处死存活大鼠取心脏标本进行病理学观察,筛选动物全身照射的最大耐受剂量。然后将50只大鼠随机分为5组(每组10只),以全射照射的最大耐受剂量为依据,选择16、18、20、25、30 Gy剂量分别对5组大鼠进行心脏局部照射(铜管全身防护,只照射心脏),照射后1周处死大鼠取心脏标本进行病理学观察,筛选引起心脏显著损伤的局部照射剂量。
1.3 动物模型的评价将100只大鼠随机分为对照组(只进行麻醉不照射)和模型组(麻醉后以筛选出的局部照射剂量照射),每组分别于照射后1 d、1周、2周、4周、6周各取10只大鼠,麻醉后开胸经心脏取血,然后处死动物取心脏标本。分别解剖心房和心室,在心室和心房各取一小块厚度≤0.5 cm的组织,分别放于1.5 mL的冻存管中,迅速置于液氮中,-80 ℃保存备用。其余心脏组织放入10%甲醛溶液中固定备用。
1.3.1 大鼠一般生长情况观察观察大鼠活动、皮毛改变、饮食、体质量变化等一般情况。
1.3.2 心脏病理损伤评分将10%甲醛溶液固定的心脏组织经石蜡包埋、切片后行H-E染色,光镜下观察心肌组织结构,参照Rona等[8]的标准结合周明东[9]的方法进行病理评分,评价射线对心脏的炎性损害情况。病理变化按由轻到重的程度分别记为1、2、3、4分,无病变为0分,每张切片随机取6个高倍镜视野进行评分,取平均值。
1.3.3 Masson染色采用Masson染色观察胶原的增生情况,评估心肌纤维化程度。在光学显微镜下观察并拍照,采用Image Pro Plus 6.0图像分析系统计算心肌组织中胶原容积分数(collagen volume fraction,CVF),CVF=心肌间质胶原面积/视野总面积。每组取8个切片,每张切片取6个高倍镜视野,取平均值。
1.3.4 心肌酶检测大鼠血液标本经肝素抗凝处理后,立即离心获得血浆,使用双抗体夹心ELISA检测血浆中CK-MB和cTn的水平,评价X线对心脏功能的损害。
1.3.5 炎性-纤维化因子检测(1)免疫组织化学染色:将心肌组织石蜡切片常规脱蜡、水化、通透,进行免疫组织化学染色,观察炎性因子NF-κB p65、NF-κB p50、TNF-α及纤维化因子TGF-β1、Ⅰ型胶原蛋白(collagen type Ⅰ,ColⅠ)、Ⅲ型胶原蛋白(collagen type Ⅲ,ColⅢ)的表达情况。应用Image Pro Plus 6.0图像分析系统测定并分析蛋白的相对表达量(平均光密度值=光密度/面积)。(2)蛋白质印迹法:提取心肌组织蛋白,测定蛋白浓度,将蛋白变性后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜后进行免疫反应,利用化学发光法显示蛋白条带,最后用ImageJ2x软件测定蛋白表达的灰度值并进行分析。
1.4 统计学处理应用SPSS 13.0软件进行统计学分析。实验数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用Student-Newman-Keuls检验。检验水准(α)为0.05。
2 结果 2.1 动物造模条件的筛选结果 2.1.1 小剂量X线全身照射分别以0、4、6、8、12、16、18 Gy的剂量对大鼠进行X线全身照射,照射后1 h内6 Gy和8 Gy剂量组大鼠分别死亡1只,可能是麻醉过量所致;照射后第2天各组大鼠均无死亡;照射后第3天16 Gy和18 Gy剂量组大鼠全部死亡;至照射后1周,全身照射剂量低于16 Gy的各组大鼠均未发生照射相关的死亡,病理结果显示大鼠心脏结构基本正常。上述结果表明低于16 Gy的全身照射对大鼠心脏损伤作用较轻;16、18 Gy剂量的全身照射对动物整体有明显的损伤,动物已经不能耐受。故认为大鼠全身照射耐受剂量应低于16 Gy。
2.1.2 大剂量心脏局部照射分别以16、18、20、25、30 Gy的剂量对大鼠进行心脏局部照射后,各组动物均无死亡。大鼠心脏病理结果显示,16 Gy剂量组大鼠心脏有血管增生扩张、血管浸润和炎性渗出表现,说明该剂量即可引起心脏炎性损伤;18 Gy和20 Gy剂量组大鼠心脏血管浸润加重,心内膜下水肿渗出显著,但心肌纤维排列整齐,结构尚未受到破坏;25 Gy和30 Gy剂量组大鼠心脏毛细血管增生扩张,炎症细胞渗出,心肌纤维断裂、排列紊乱,心肌结构破坏显著,心内膜、乳头肌和心室瓣膜充血水肿、渗出增多,甚至有心肌细胞溶解的表现。因此,本研究选择25 Gy心脏局部照射进行动物造模。
2.2 RIHD模型评价结果 2.2.1 大鼠一般生长情况各组大鼠均未见死亡。对照组大鼠饮食、活动、体质量增长正常,皮毛柔顺亮泽。模型组大鼠在照射后第1天基本没有进食、饮水和活动行为,体质量低于对照组;第2、第3天逐渐开始进食、饮水,行动迟缓;1周左右进食、饮水和活动行为基本恢复,但不如对照组大鼠活跃,体质量亦低于对照组,受照射的心前区发生脱毛现象;2周时大鼠体质量增加,受照射的心前区脱毛严重,照射区对应的背部也出现脱毛(射线对穿损伤背部皮毛);4周时大鼠心前区放射性皮毛损伤仍然很显著,但背部皮毛缺损面积减小,出现新生较短的绒毛;6周时模型组体质量基本恢复至对照组水平,皮毛损伤已经不明显。
2.2.2 心脏病理损伤评分对照组大鼠心肌细胞排列整齐,细胞核蓝染,细胞质呈淡红色;模型组大鼠心肌细胞水肿明显、排列紊乱,心肌细胞核轻度固缩、染色加深,出现少量异型细胞核,可见炎性渗出(图 1A)。对照组大鼠各时间点心肌病理损伤评分均<0.5;模型组大鼠各时间点心肌病理损伤评分均高于相应时间点的对照组大鼠,差异均有统计学意义(P均<0.01,图 1B)。
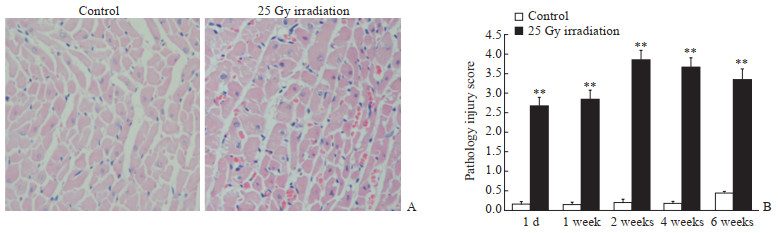
|
图 1 RIHD大鼠心肌病理变化及病理评分 Fig 1 Myocardial pathological changes and pathology injury scores of RIHD rats A: H-E staining was performed 1 week after irradiation; B: Pathology injury score was obtained at day 1, and week 1, 2, 4 and 6 after irradiation. RIHD: Radiation-induced heart damage. Original magnification: ×200 (A). **P < 0.01 vs control group. n=10, x±s |
2.2.3 心肌胶原定量检测结果
Masson染色结果见图 2,胶原纤维呈蓝色,细胞质、肌纤维及红细胞呈红色,细胞核呈蓝褐色。模型1 d组大鼠心肌有大量的肌纤维和少量的胶原纤维;模型1周、2周、4周、6周组胶原纤维显著增多,各组CVF与模型1 d组比较差异均有统计学意义(P均<0.01)。
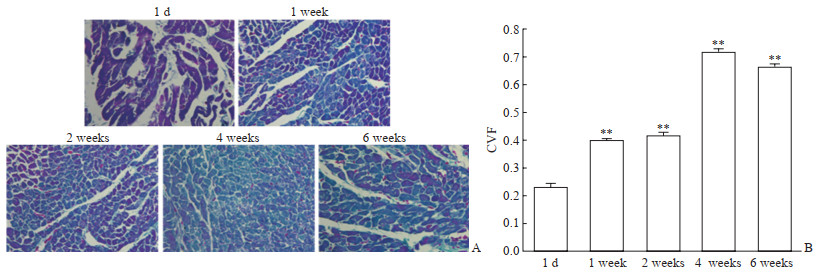
|
图 2 RIHD大鼠心肌胶原染色和CVF变化 Fig 2 Myocardial collagen staining and CVF changes of RIHD rats A: Masson staining of myocardium at day 1, and week 1, 2, 4 and 6 after irradiation with 25 Gy X ray showing the changes of myocardial collagen of RIHD; B: CVF in myocardial tissues of RIHD rats. RIHD: Radiation-induced heart damage; CVF: Collagen volume fraction. Original magnification: ×400 (A). **P < 0.01 vs 1 d. n=10, x±s |
2.2.4 心肌酶检测结果
ELISA检测结果(图 3)显示,模型组大鼠血浆CK-MB浓度均高于各观察时点相应对照组,差异均有统计学意义(P均<0.05)。模型组大鼠血浆CK-MB浓度在X线照射后1 d增加最显著,与照射前相比增加了60.86%(P<0.05);随后增幅呈减小趋势,1、2、4、6周组与照射前相比增幅分别为39.32%、31.42%、35.63%、22.92%,差异均有统计学意义(P均<0.05)。模型组大鼠血浆cTn浓度均高于各观察时点相应对照组,其中1 d、2周和4周组与相应对照组相比差异均有统计学意义(P均<0.05)。模型组大鼠血浆cTn浓度在X线照射后1 d增加最显著,与照射前相比增加了31.92%(P<0.05);随后明显降低,6周时基本恢复至照射前水平。
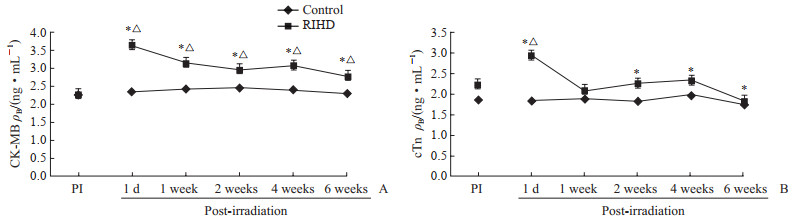
|
图 3 RIHD大鼠血浆CK-MB和cTn浓度变化 Fig 3 Changes of plasma CK-MB and cTn concentrations in RIHD rats A: Changes of plasma CK-MB; B: Changes of plasma cTn. RIHD: Radiation-induced heart damage; CK-MB: Creatine kinase isoenzyme MB; cTn: Cardiac troponin; PI: Pre-irradiation. *P < 0.05 vs control group at the same time point; △P < 0.05 vs PI of RIHD group. n=10, x±s |
2.2.5 炎性-纤维化因子检测结果
大鼠心肌组织免疫组织化学染色结果(图 4、表 1)显示,炎性因子NF-κB p65、NF-κB p50、TNF-α均在细胞质中表达,模型1 d、1周、2周、4周组大鼠心肌NF-κB p65、NF-κB p50、TNF-α表达量与照射前相比均增加,差异均有统计学意义(P均<0.01)。
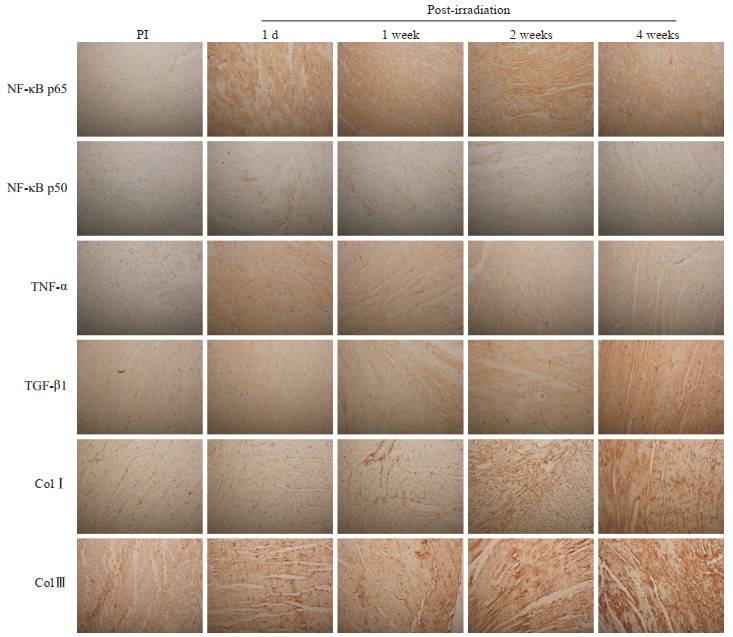
|
图 4 免疫组织化学染色检测RIHD大鼠心肌炎性因子和纤维化因子表达 Fig 4 Immunohistochemistry staining of inflammatory and fibrotic factors in myocardial tissues of RIHD rats RIHD: Radiation-induced heart damage; PI: Pre-irradiation; NF-κB: Nuclear factor κB; TNF-α: Tumor necrosis factor α; TGF-β1: Transforming growth factor β1; ColⅠ: Collagen type Ⅰ; Col Ⅲ: Collagen type Ⅲ. Original magnification: ×400 |
|
|
表 1 RIHD大鼠心肌炎性因子和纤维化因子免疫组织化学染色检测平均光密度值 Tab 1 Average optical density of inflammatory and fibrotic factors in myocardial tissues of RIHD rats deteced by immunohistochemistry staining |
纤维化因子ColⅠ和ColⅢ均在细胞质中表达,TGF-β1主要在细胞质中表达、细胞核也有部分表达,模型1 d、1周、2周、4周组大鼠心肌TGF-β1、ColⅠ、Col Ⅲ表达量与照射前相比均增加,除模型1 d组Col Ⅲ表达量差异无统计学意义外,余者差异均有统计学意义(P均<0.05)。
炎性因子NF-κB p65、NF-κB p50、TNF-α表达最高值均出现在照射后1 d,取此组进行蛋白质印迹检测,结果显示模型1 d组NF-κB p65、NF-κB p50、TNF-α相对表达量与对照组相比分别增高15.8、6.5、8.9倍(图 5A)。纤维化因子TGF-β1、ColⅠ和Col Ⅲ表达高值均出现在照射后第4周,取此组进行蛋白质印迹检测,结果显示模型4周组TGF-β1、ColⅠ、Col Ⅲ相对表达量与对照组相比分别增高8.8、9.0、18.9倍(图 5B)。
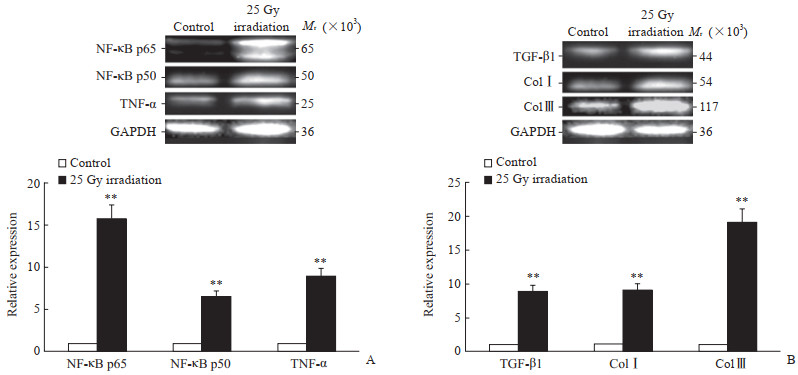
|
图 5 蛋白质印迹法检测RIHD大鼠心肌炎性因子和纤维化因子表达 Fig 5 Expression of inflammatory and fibrotic factors in myocardial tissue of RIHD rats detected by Western blotting A: Expression of inflammatory factors at day 1 after irradiation; B: Expression of fibrotic factors at week 4 after irradiation. RIHD: Radiation-induced heart damage; NF-κB: Nuclear factor κB; TNF-α: Tumor necrosis factor α; TGF-β1: Transforming growth factor β1; ColⅠ: Collagen type Ⅰ; Col Ⅲ: Collagen type Ⅲ; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. **P < 0.01 vs control group |
3 讨论 3.1 RIHD动物模型造模条件筛选
RIHD可发生于多种动物,目前用于RIHD研究的模型动物有大鼠[10]、小鼠[11]、犬[12]、兔[13]、恒河猴[14]等,动物实验学中通常多认为大鼠适合心肌病研究[15]。本研究发现大鼠心脏损伤的病理改变包括心肌退行性变化和纤维化,这符合RIHD的炎性-纤维化病理改变特点;此外,预实验表明小鼠整体对射线耐受差(或其他生物系统对射线比较敏感,而心脏病理改变不明显)、死亡率较高,提示小鼠可能更适合其他生物系统的放射性损伤研究。因此,本研究选择大鼠为RIHD造模对象。
在RIHD动物模型研究中,不同研究所选择的照射剂量差异较大。DeBo等[14]发现6.5~8.4 Gy的单次全身剂量可对恒河猴产生长期效应,包括心肌纤维化、左心室直径减小和全身炎症反应等;但大多数研究采用的照射剂量在10 Gy以上,最高达到50 Gy[16]、60 Gy[17],其中以15 Gy、18 Gy、20 Gy、25 Gy、30 Gy照射剂量造模的研究较多[7]。动物照射剂量差别较大,与照射野大小有关:全身性照射时多器官组织均受到射线的损伤,动物不能耐受而死亡,故造模照射剂量较小;只进行心前区心脏局部照射时,动物全身受射线影响较小,能够耐受较大的照射剂量[12, 18]。相比于其他脏器,心脏对射线不敏感,因此对比全身性大面积小剂量照射,这种大剂量心脏局部照射对心脏的损伤更加显著,更适合于动物RIHD研究中的模型构建。
我们在实验中系统全面地进行了第一阶段0、4、6、8、12、16、18 Gy全身照射,筛选出动物全身照射的最大耐受剂量是16 Gy,然后以该剂量为依据进行第二阶段16、18、20、25、30 Gy心脏局部照射,筛选引起心脏显著损伤的局部照射剂量。病理结果显示以≥16 Gy的射线局部照射大鼠心脏可引起心脏炎性损伤,而以≥16 Gy的射线进行全身照射可导致大鼠全部死亡。提示16 Gy可能是引起射线不敏感器官——大鼠心脏损伤的最低剂量;随着照射剂量的不断增加,心脏病理损伤持续加重,射线剂量增至25 Gy即能引起心脏比较严重的炎性损伤和心肌结构破坏,此时大鼠并未发生死亡。故我们认为照射剂量至少为25 Gy的心脏局部照射是RIHD大鼠模型的构建条件。
3.2 RIHD动物模型的评价病理形态观察几乎是所有RIHD动物模型首选的评估方法[7]。本研究中对照组大鼠心肌结构基本正常,病理评分较低,而模型组病理损伤评分随照射后时间延长而升高,说明虽然单次照射结束但是病理损伤持续存在且呈加重趋势,这可能与射线损伤的迟发效应有关。Masson染色CVF也有类似的变化趋势,纤维化随时间推移有渐进性进展的特点。这些结果证明25 Gy单次照射可用于射线急性损伤和迟发损伤研究。
心肌酶CK-MB和cTn在临床和基础研究中常被作为心脏损伤的标志物。本研究中,RIHD模型大鼠经X线照射后,CK-MB和cTn发生病理性增高,且在照射后早期即发生并在照射后1 d达到高峰,这种增高状态可持续至照射后4~6周,提示射线能较早引起心脏急性损伤并持续存在较长时间;但随时间推移CK-MB和cTn逐渐降低,这可能与损伤后CK-MB和cTn的自我恢复有关。正常情况下,外周血液中cTn极微量或检测不出,但是本研究结果显示对照组大鼠cTn超过1.5 ng/mL,这可能与动物取血过程中的麻醉和使用抗凝剂肝素有关:麻醉可降低动物的整体代谢率,对心脏的影响表现为心率、心脏收缩力量下降,心脏排血量降低,心脏供血减少,使心肌细胞缺血、缺氧而发生坏死,影响血浆cTn水平;抗凝剂肝素带有负电荷,而cTn带有较多正电荷,两者可结合形成复合物影响抗原-抗体反应,进而影响cTn的ELISA检测。此外,由于CK-MB和cTn的病理性增高发生于射线照射后早期的心脏急性损伤时期,在进行药物干预尤其是中药干预时,因其起效慢,加上CK-MB和cTn这2个病理性损伤指标会在1周左右逐渐降低,所以我们建议RIHD动物实验中仅以CK-MB和cTn作为射线损伤心脏的造模指标,不宜作为中药干预的判效指标。
RIHD被认为是渐进性的炎症反应和纤维化综合作用的结果[6]。早期以急性炎症为主,后期以进行性纤维化为特征;随着受照剂量的增加,炎症反应和纤维化程度加重,病变时间提前[19]。研究显示,射线照射心脏可启动NF-κB炎症反应调控通路[20-22],同时TNF-α等炎性介质高表达引起心肌细胞水肿、炎症细胞浸润[23],随后TGF-β1、胶原分子在基因和蛋白水平表达上调[24-25],成纤维细胞增多,胶原纤维增多,导致心肌纤维化改变。本研究使用免疫组织化学和蛋白质印迹分析方法观察RIHD大鼠炎性因子(NF-κB p65、NF-κB p50、TNF-α)和纤维化因子(ColⅠ、Col Ⅲ、TGF-β1)随时间的变化情况,客观评价放射性心脏损伤大鼠模型中的炎性-纤维化病理改变的特点。结果发现照射造模后较早时间(1 d)NF-κB p65和NF-κB p50即出现表达峰值,这与刘丽娜[22]的研究结果一致,提示放射线照射早期即启动NF-κB炎症反应调控通路,引起心肌细胞炎症。我们在前期研究中曾应用PCR芯片技术观察到,X线照射心脏纤维化的效应细胞(心肌成纤维细胞)能使NF-κB mRNA表达高于对照组[25-26]。上述研究结果皆表明NF-κB类分子能较早提示射线的炎性损伤,可以作为RIHD动物模型炎性分子的病理指标。本研究还发现X线照射后早期大鼠心肌组织中TNF-α蛋白表达升高,有研究显示在应激状态下心脏组织TNF-α表达水平可反映心肌细胞受损的严重程度[27],检测TNF-α对于射线损伤心脏引起炎症反应的评估很有意义,因此我们认为TNF-α也应该作为RIHD动物模型的炎性分子病理指标。NF-κB p65、NF-κB p50和TNF-α的高表达从照射后第1天开始出现,一直到照射后4周也没有明显的下降趋势,说明25 Gy单次照射后的射线炎性损伤效应持续存在,结合病理评分结果,表明本实验筛选出的造模剂量和单次局部照射造模方法可构建炎性损伤相对稳定的RIHD模型。
RIHD纤维化病变实际上是胶原合成与降解失衡的渐进性纤维化过程,主要表现为心肌成纤维细胞增多、心肌胶原合成增加和胶原成分改变[28]。心肌成纤维细胞可合成和分泌TGF-β1,TGF-β1通过与其受体结合进而刺激受照射组织使之发生上皮增生、成纤维细胞增殖、胶原沉积和纤维组织形成,参与了纤维化的全过程[29]。目前,TGF-β1被认为是纤维化过程中起关键作用的细胞因子之一,在放射性损伤早期,TGF-β1 mRNA的表达较组织学的变化更明显,能较早提示组织纤维化的发生。我们在前期研究中已经证实TGF-β1参与放射性心脏损伤,并且通过PCR芯片技术观察到X线诱导TGF-β1高表达的促纤维化效应与Smad2、Smad3、TIMP1等分子的异常表达有关[25]。本研究以纤维化的关键性因子TGF-β1和心肌胶原主要分子ColⅠ、Col Ⅲ为代表性病理分子指标反映RIHD的纤维化病理改变,结果表明25 Gy射线单次照射后这些纤维化分子表达呈渐进性升高的趋势,与Masson染色CVF的变化基本一致,提示随着照射后时间的推移,纤维化病理不断进展。表明25 Gy单次心脏局部照射造模方法可构建进展性的RIHD纤维化模型,TGF-β1、ColⅠ和ColⅢ 3个分子可有效反映该病理过程。
3.3 本造模方法的优越性与以往类似研究的动物模型相比,本研究采用的造模方法有如下优势:(1)造模动物明确为大鼠,其受照射后心脏的炎性-纤维化病理损伤和生理功能变化接近临床放射治疗后患者的心脏损伤变化,还具有经济与便于繁殖、饲养和取材的特点;(2)单次25 Gy照射可以满足RIHD的渐进性炎性-纤维化病理改变特点,单次照射在大规模动物实验中简单易行,节省人力、物力、财力,优于小剂量多次照射;(3)心脏是射线不敏感器官,因此对比全身性大面积小剂量照射,大剂量心脏局部照射对心脏的损伤更加显著,更适合于动物RIHD研究中的模型构建;(4)应用炎性病理观察、CVF纤维化定量、心肌酶学损伤性变化、炎性因子和纤维化因子检测等方法可全面动态反映RIHD的急性损伤和迟发效应。
综上所述,25 Gy心脏局部单次照射可有效引起大鼠RIHD,构建稳定的动物模型;病理形态学观察和Masson染色CVF能动态反映RIHD模型大鼠早期炎性病理变化和随着时间渐进性的纤维化病理进程;炎性因子NF-κB p65、NF-κB p50、TNF-α的早期持续高表达和纤维化因子TGF-β1、ColⅠ、ColⅢ的渐进性升高可评价RIHD炎性-纤维化动物模型的急性损伤和迟发效应。该模型具有动物选择明确、造模方法简单易行、指标检测系统全面等优点,为进行相关机制和干预等研究提供了实验基础。但本研究未从大体解剖和心脏功能方面对该模型进行评价,仍有待完善补充,进一步明确该RIHD模型的可靠性。
| [1] |
顾文栋, 冯炎. 放射线诱发心脏损伤的病理学机制[J]. 中华放射肿瘤学杂志, 2004, 13: 110-112. DOI:10.3760/j.issn:1004-4221.2004.02.020 |
| [2] |
SOMJEN D, KNOLL E, VAYA J, STERN N, TAMIR S. Estrogen-like activity of licorice root constituents:glabridin and glabrene, in vascular tissues in vitro and in vivo[J]. J Steroid Biochem Mol Biol, 2004, 91: 147-155. DOI:10.1016/j.jsbmb.2004.04.003 |
| [3] |
陈金梅, 张纬建, 林育毅, 洪金省, 郭飞宝. 三维适形放疗与调强放疗在不同肺叶非小细胞肺癌中的剂量学研究[J]. 肿瘤基础与临床, 2011, 24: 499-502. DOI:10.3969/j.issn.1673-5412.2011.06.013 |
| [4] |
CELLA L, D'AVINO V, PALMA G, CONSON M, LIUZZI R, PICARDI M, et al. Modeling the risk of radiation-induced lung fibrosis:irradiated heart tissue is as important as irradiated lung[J]. Radiother Oncol, 2015, 117: 36-43. DOI:10.1016/j.radonc.2015.07.051 |
| [5] |
HATOUM O A, OTTERSON M F, KOPELMAN D, MIURA H, SUKHOTNIK I, LARSEN B T, et al. Radiation induces endothelial dysfunction in murine intestinal arterioles via enhanced production of reactive oxygen species[J]. Arterioscler Thromb Vasc Biol, 2006, 26: 287-294. DOI:10.1161/01.ATV.0000198399.40584.8c |
| [6] |
DARBY S C, CUTTER D J, BOERMA M, CONSTINE L S, FAJARDO L F, KODAMA K, et al. Radiation-related heart disease:current knowledge and future prospects[J]. Int J Radiat Oncol Biol Phys, 2010, 76: 656-665. DOI:10.1016/j.ijrobp.2009.09.064 |
| [7] |
顾静, 吴红彦, 张雪燕, 刘润, 李海龙, 郭超. 放射性心脏损伤动物实验研究进展[J]. 中国实验动物学报, 2018, 26: 667-671. DOI:10.3969/j.issn.1005-4847.2018.05.021 |
| [8] |
RONA G, CHAPPEL CI, BALAZS T, GAUDRY R. An infarct-like myocardial lesion and other toxic manifestations produced by isoproterenol in the rat[J]. AMA Arch Pathol, 1959, 67: 443-455. |
| [9] |
周明东.神经调节蛋白用于心血管疾病治疗的方法和组合物: 200610139361.X[P]. 2007-08-01.
|
| [10] |
ZHOU Q, HU W, FEI X, HUANG X, CHEN X, ZHAO D, et al. Recombinant human neuregulin-1β is protective against radiation-induced myocardial cell injury[J]. Mol Med Rep, 2016, 14: 325-330. DOI:10.3892/mmr.2016.5207 |
| [11] |
WALASZCZYK A, SZOŁTYSEK K, JELONEK K, POLAŃSKA J, DÖRR W, HAAGEN J, et al. Heart irradiation reduces microvascular density and accumulation of HSPA1 in mice[J]. Strahlenther Onkol, 2018, 194: 235-242. DOI:10.1007/s00066-017-1220-z |
| [12] |
SONG J, YAN R, WU Z, LI J, YAN M, HAO X, et al. 13N-ammonia PET/CT detection of myocardial perfusion abnormalities in Beagle dogs after local heart irradiation[J]. J Nucl Med, 2017, 58: 605-610. DOI:10.2967/jnumed.116.179697 |
| [13] |
郭建锋, 黄敏, 郑凯, 徐隽, 茹怡, 吴传峰, 等. 兔单次照射后早期心脏放射性损伤的组织学研究[J]. 南通大学学报(医学版), 2012, 32: 107-109. DOI:10.3969/j.issn.1674-7887.2012.02.006 |
| [14] |
DEBO R J, LEES C J, DUGAN G O, CAUDELL D L, MICHALSON K T, HANBURY D B, et al. Late effects of total-body γ irradiation on cardiac structure and function in male rhesus macaques[J]. Radiat Res, 2016, 186: 55-64. DOI:10.1667/RR14357.1 |
| [15] |
孙敬方. 动物实验方法学[M]. 北京: 人民卫生出版社, 2001: 119-121.
|
| [16] |
KISCSATÁRI L, SÁRKÖZY M, KŐVÁRI B, VARGA Z, GÖMÖRI K, MORVAY N, et al. High-dose radiation induced heart damage in a rat model[J]. In Vivo, 2016, 30: 623-631. |
| [17] |
白蕴红, 王德文. 大鼠放射性心脏损伤的病理学观察[J]. 中华放射医学与防护杂志, 1994, 14: 329-330. |
| [18] |
武瑞凤, 苏晋生, 宋建波. 核磁研究犬心放射性损伤早期改变[J]. 实用医学影像杂志, 2015, 16: 215-217. |
| [19] |
符天晓, 周菊英, 焦旸. C57BL/6小鼠放射性心脏损伤动物模型的建立及血清标志物的探讨[J]. 安徽医科大学学报, 2015, 50: 922-925. |
| [20] |
SUBRAMANIAN V, SEEMANN I, MERL-PHAM J, HAUCK S M, STEWART F A, ATKINSON M J, et al. Role of TGF β and PPAR α signaling pathways in radiation response of locally exposed heart:integrated global transcriptomics and proteomics analysis[J]. J Proteome Res, 2017, 16: 307-318. DOI:10.1021/acs.jproteome.6b00795 |
| [21] |
叶江枫, 蒙育林, 杜志强. 放射性心脏损伤初期核因子κB的变化及氨溴索的影响[J]. 中华临床医师杂志(电子版), 2007, 1: 387-389. DOI:10.3969/j.issn.1674-0785.2007.05.013 |
| [22] |
刘丽娜. PDTC阻断炎症通路减轻大鼠放射性心脏损伤的机制研究[D].石家庄: 河北医科大学, 2016. http://www.scholarmate.com/indexhtml/detail/eKqsS8kAkjxRFpTq1Hgurg%3D%3D,4,zh_cn.html
|
| [23] |
周游, 李浪, 陈绘颖, 王江友, 刘涛, 苏强. 大鼠放射性心脏损伤后肿瘤坏死因子α表达的变化及阿托伐他汀对其的影响[J]. 中华老年心脑血管病杂志, 2014, 16: 751-753. DOI:10.3969/j.issn.1009-0126.2014.07.021 |
| [24] |
刘慧, 熊迈, 戎铁华, 崔念基, 夏云飞, 邓玲, 等. 大鼠心脏组织TGF-β1 mRNA表达水平与放射性损伤关系的实验研究[J]. 癌症, 2008, 27: 18-24. |
| [25] |
GU J, LIU K, LI H, WANG X, YANG K. Astragalus saponin attenuates the expression of fibrosis-related molecules in irradiated cardiac fibroblasts[J]. Acta Biochim Biophys Sin (Shanghai), 2014, 46: 492-501. DOI:10.1093/abbs/gmu021 |
| [26] |
HAN W, LI H, CAI J, GLEAVES L A, POLOSUKHIN V V, SEGAL B H, et al. NADPH oxidase limits lipopolysaccharide-induced lung inflammation and injury in mice through reduction-oxidation regulation of NF-κB activity[J]. J Immunol, 2013, 190: 4786-4794. DOI:10.4049/jimmunol.1201809 |
| [27] |
DRABEK T, JANATA A, WILSON C D, STEZOSKI J, JANESKO-FELDMAN K, TISHERMAN S A, et al. Minocycline attenuates brain tissue levels of TNF-α produced by neurons after prolonged hypothermic cardiac arrest in rats[J]. Resuscitation, 2014, 85: 284-291. DOI:10.1016/j.resuscitation.2013.10.015 |
| [28] |
BRILLA C G. Renin-angiotensin-aldosterone system and myocardial fibrosis[J]. Cardiovasc Res, 2000, 47: 1-3. DOI:10.1016/S0008-6363(00)00092-4 |
| [29] |
BUJAK M, FRANGOGIANNIS N G. The role of TGF-β signaling in myocardial infarction and cardiac remodeling[J]. Cardiovasc Res, 2007, 74: 184-195. DOI:10.1016/j.cardiores.2006.10.002 |
 2019, Vol. 40
2019, Vol. 40


