2. 复旦大学药学院药剂学教研室, 上海 201203
2. Department of Pharmaceutics, School of Pharmacy, Fudan University, Shanghai 201203, China
目前,仿制药质量已成为国家、医药企业和医疗机构的关注重点。开展仿制药质量一致性评价、全面提高仿制药质量是《国家药品安全“十二五”规划》的重要任务,是提高药品质量的有效手段,对提升制药行业整体水平、保障公众用药安全具有重要意义[1]。仿制药与原研药的质量一致性不仅要求体外检验指标具有一致性,还要求体内安全性和有效性具有一致性。
糖尿病是由体内胰岛素分泌绝对或相对不足导致的以高血糖为特征的内分泌代谢性疾病[2]。国际糖尿病联盟(International Diabetes Federation,IDF)在第7版《IDF全球糖尿病概览》中估测:2015年全球20~79岁成人糖尿病患病率为8.8%,患者人数达4.15亿;预计到2040年全球将有6.42亿糖尿病患者[3]。格列齐特(gliclazide)为第2代磺酰脲类降糖药,具有口服吸收快、降血糖活性高的特点,且其引发低血糖、粒细胞减少及心血管不良反应的发生率较低,兼具降血糖和改善凝血功能双重作用。格列齐特不仅可以改善糖尿病患者的代谢,还可改善或延缓糖尿病血管并发症的发生,在国内外已广泛应用于临床,成为目前治疗2型糖尿病最常用的药物之一[4-5]。格列齐特缓释片现已上市,由法国施维雅(Serveir)公司研发。本研究以自制格列齐特缓释片为受试制剂、市售格列齐特缓释片(商品名:达美康)为参比制剂进行比格犬体内药动学研究,验证自制格列齐特缓释片是否具有缓释特征,评价仿制制剂与原研制剂是否生物等效,并考察自制格列齐特缓释片的体内外释放行为,为仿制制剂与原研制剂的一致性评价提供参考。
1 仪器和试药 1.1 仪器设备Shimadzu LC-20AB高效液相色谱仪、Shimadzu SPD-20A紫外检测器(日本岛津公司);HW-2000色谱工作站2.16版(上海千谱软件有限公司);ZRS-8智能溶出试验仪(天津大学精密仪器厂);Simplicity水纯化系统(美国Millipore公司);XW-80A旋涡混合器(上海医科大学仪器厂);TGL-16G台式离心机(上海安亭科学仪器厂);BS224S型电子天平(精密度为0.000 1 g,德国Sartorius公司)。
1.2 药品与试剂格列齐特对照品(中国药品生物制品检定所,批号:100269-200402);格列吡嗪对照品(中国药品生物制品检定所,批号:100281-200001);格列齐特原料药(山东科源制药股份有限公司,含量为99.0%,批号:0604034);羟丙甲基纤维素(HPMC K100LV、HPMC E50,英国卡乐康公司);微晶纤维素(MCC Celldone 102CG,国际特品有限公司,批号:60102);微粉硅胶[Aerosil 200,赢创德固赛(中国)投资有限公司];硬脂酸镁(国际特品有限公司,批号:60509);肝素钠(上海第一生化药业有限公司);格列齐特缓释片(达美康,法国施维雅制药有限公司,批号:6G0459);甲醇、乙腈(色谱纯,美国Tedia公司);其他试剂均为分析纯。
2 方法和结果 2.1 自制格列齐特缓释片的制备称取30 g格列齐特原料药与75 g HPMC K100LV、15 g HPMCE50、78 g MCC Celldone 102 CG等辅料,在双锥混合器中混合均匀,加入润湿剂90%乙醇适量制软材,过30目筛制粒,于60 ℃烘干,过24目筛整粒,加入润滑剂微粉硅胶和硬脂酸镁混匀,采用9 mm的圆形冲模于单冲压片机上压片。每片含药30 mg,平均片重200 mg,硬度8~10 kg。片剂处方有较好的压缩成形性,所制得的缓释片表面光洁,片重差异、脆碎度、硬度、体外释放等指标均符合质量标准。
2.2 色谱条件Merck C8色谱柱(250 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:甲醇-0.2%冰醋酸(体积比62:38);流速:1 mL/min;检测波长:229 nm;进样量:10 μL。
2.3 体外释放度的测定取自制格列齐特缓释片和达美康各6片,置于pH 7.4的磷酸盐缓冲液中,温度37 ℃,采用转篮法测定溶出度,转速为100 r/min。分别于0.25、0.5、1、2、4、6、9、12、24 h时取样10 mL,过0.8 µm滤膜,续滤液行HPLC测定,计算累积释放率。自制格列齐特缓释片和达美康在pH 7.4的磷酸盐缓冲液中于12 h内均表现出明显的缓释行为,符合达美康质量标准中对释放度的要求,即2 h限度为17%~31%、4 h限度为35%~55%,12 h限度为85%以上。此外,自制格列齐特缓释片与达美康的释放行为表现出良好的相似性(相似因子f2>50[6]),其f2为62.94。见图 1。
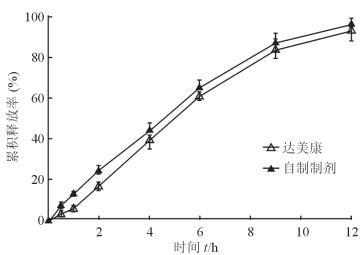
|
图 1 自制格列齐特缓释片和达美康的口服体外释放曲线 n=6, x±s |
2.4 给药方案与血样采集[7-8]
6条比格犬[上海交通大学农学院教学实验实习场提供,动物生产许可证号:SCXK(沪)2017-0007]随机分为两组,采用自身对照交叉方式给药。禁食12 h后,分别口服给予自制格列齐特缓释片和达美康,给药剂量为30 mg。于给药前和给药后0.5、1、2、4、6、8、10、12、24、36、48、60 h抽取前肢静脉血各3 mL,肝素抗凝,900×g离心10 min后分离血浆,于-20 ℃贮存,待作血药浓度分析。经洗净期2周后交叉服药,同时间点取血,同法处理。
2.5 血浆样品预处理取血浆样品0.5 mL加入内标(20 μg/mL格列吡嗪甲醇溶液)50 μL和盐酸溶液(0.4 mol/L)0.1 mL,加入乙酸乙酯2.5 mL,振荡混匀2 min,离心(1 350×g)5 min,取上清液2 mL,氮气吹干,残留物加0.08 mL乙腈溶解,取10 μL行HPLC测定。记录色谱图,计算格列齐特与内标的峰面积之比,采用内标法进行定量分析。
2.6 方法学评价 2.6.1 方法专属性取比格犬空白血浆,分别配制空白血浆、空白血浆加内标液、空白血浆加一定浓度格列齐特溶液(含内标)及给药后的血浆样品,处理后进样行HPLC测定。格列齐特和内标格列吡嗪的保留时间分别为7.8 min和6.2 min。在上述色谱条件下,格列齐特和内标的峰形均较好,且分离度较好,内源物质基本无干扰,见图 2。

|
图 2 比格犬血浆内格列齐特的高效液相色谱图谱 A:空白血浆; B:空白血浆加内标; C:空白血浆加格列齐特与内标; D:血浆样品. 1:内标格列吡嗪; 2:格列齐特 |
2.6.2 最低检测限
在上述条件下,以信噪比S/N=3计算得该方法的最低检测限为10 ng/mL。
2.6.3 线性关系准确量取0.5 mL空白血浆共6份,分别加入内标液50 μL,再依次加入0.1、0.5、1、2、4、8 μg/mL的格列齐特标准溶液,得不同浓度标准血浆。按2.5项下方法处理含药血浆,取10 μL行HPLC测定,记录色谱图。以样品峰面积(As)与内标峰面积(Ai)的比值对血浆浓度(ρ, μg/mL)进行线性回归,得到标准曲线:As/Ai=0.214 1ρ+0.067(R2=0. 999 9),表明格列齐特在0.5~8.0 μg/mL范围内线性关系良好。
2.6.4 精密度取高、中、低浓度(0.5、2、8 μg/mL)的含药血浆各3份,分别于1 d内和3 d内不同时间点按2.5项下方法处理,取10 μL行HPLC测定,记录色谱图。根据标准曲线计算血浆样品中格列齐特的浓度并计算日内和日间相对标准偏差(relative standard deviation,RSD),即得日内精密度和日间精密度。结果显示,高、中、低浓度含药血浆日内精密度的RSD分别为2.64%、1.27%、0.96%,日间精密度的RSD分别为9.35%、2.36%、4.96%,均符合试验要求。
2.6.5 方法回收率取高、中、低浓度(0.5、2、8 μg/mL)的含药血浆各3份,按2.5项下方法处理后取10 μL行HPLC测定,记录色谱图,根据标准曲线计算血浆样品中格列齐特的浓度,计算相对回收率(方法回收率)。结果显示,在线性范围内血浆样品的方法回收率为82.53%~103.11%,符合试验要求。
2.6.6 提取回收率取高、中、低浓度(0.5、2、8 μg/mL)的含药血浆各3份,按2.5项下方法处理后取10 μL行HPLC测定,记录色谱图。另取浓度分别为0.5、2、8 μg/mL的格列齐特对照品乙腈溶液,取10 μL行HPLC测定,记录色谱图并绘制标准曲线。计算绝对回收率(提取回收率),结果显示,在线性范围内提取回收率为76.86%~78.94%,符合试验要求。
2.7 血药浓度测定结果及药动学参数采用中国药理学会药理学委员会编制的3p87药动学程序进行血药浓度数据处理。达峰浓度Cmax和达峰时间Tmax为实测值,其他参数采用统计矩模型计算。采用Student t检验行统计学分析,检验水准(α)为0.05。自制格列齐特缓释片和达美康的比格犬体内血药浓度-时间曲线图见图 3,所得药动学参数结果见表 1。自制格列齐特缓释片和达美康都表现出明显的缓释趋势,平均滞留时间(mean retention time,MRT)分别达(15.46±3.24)h和(15.95±3.04)h,消除半衰期T1/2e分别达(9.92±3.36)h和(7.31±1.51)h。t检验结果表明,自制格列齐特缓释片和达美康的各药动学参数差异均无统计学意义(P均>0.05)。
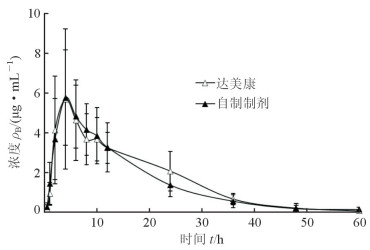
|
图 3 达美康和自制格列齐特缓释片口服给药后的平均血药浓度-时间曲线图 n=6, x±s |
|
|
表 1 达美康和自制格列齐特缓释片的比格犬体内药动学参数 |
2.8 生物利用度
以血药浓度-时间曲线下面积(area under curve,AUC)计算自制格列齐特缓释片对达美康的相对生物利用度(Fr),计算公式如下:Fr=AUC自制格列齐特缓释片/AUC达美康,得自制格列齐特缓释片的相对生物利用度为93.77%,两者具有生物等效性。
2.9 体内外相关性采用Wagner-Nelson法[9-10]计算缓释片在犬体内的吸收分数(F),计算公式为F=(Ct+AUC0-t · K)/[K · AUC0-∞],式中Ct为t时的血药浓度,K为消除速率常数,AUC采用梯形法计算。将F值与其体外累积释药率(X)作线性回归,进行缓释片体内外相关性研究。结果显示,自制格列齐特缓释片的回归方程为F=0.984 3X+17.072(r=0.894);达美康的回归方程为F=0.821 5X+7.469 6(r=0.912),相关系数均大于临界值(r0.05, 7=0.754),即自制格列齐特缓释片和达美康在比格犬体内的药物吸收率与体外释药率均相关。
3 讨论本研究在血样处理中,考虑到格列齐特属弱酸性药物,血浆pH对提取率有一定影响,酸性环境下提取率应高于碱性环境,因此本研究选用了酸性环境进行提取。此外,选用乙酸乙酯作为萃取剂,此法重现性好、易操作,且毒性相对较小,优于既往研究中使用的正己烷、苯、乙醚、氯仿等[11-13]提取溶剂。
制剂体内药动学研究对制剂质量评价具有重大意义。由本实验结果可知,自制格列齐特缓释片的消除半衰期达(9.92±3.36)h,Tmax达(4.33±1.51)h,具有明显的缓释特征,且各药动学参数与市售制剂达美康差异均无统计学意义,相对生物利用度为93.77%,自制格列齐特缓释片与达美康具有生物等效性。上述结果表明自制格列齐特缓释片达到了缓释的设计目的,并符合仿制药的要求。
根据美国食品药品监督管理局药品评价和研究中心的定义,药品体内外相关性是指用以描述某一制剂(通常是缓控释制剂)的体外特征与体内反应(如血浆药物浓度或吸收的药物总量)之间相关关系的一种预测性数学模型。体内外相关性反映制剂体外释放曲线与体内血药浓度-时间曲线之间的关系。只有体内外特征具有相关性,才能通过制剂的体外释放曲线预测其体内情况。本研究分析了自制格列齐特缓释片和达美康在所建立的体外释放条件中的释放行为与其在比格犬体内吸收分数间的相关性。结果显示,自制格列齐特缓释片和达美康的体外释放与犬体内吸收分数相关性好,即本研究所采用的体外释放测定方法测得的药物释放行为可以较好地反映药物的体内吸收行为,可用该方法进行制剂的质量控制,为仿制制剂与原研制剂之间的一致性评价提供了实验基础。
| [1] |
国务院办公厅. 国务院办公厅关于开展仿制药质量和疗效一致性评价的意见[J]. 中国药物评价, 2016, 33: 68-69. DOI:10.3969/j.issn.2095-3593.2016.02.002 |
| [2] |
曹金香. 糖尿病的预防及治疗[J]. 世界最新医学信息文摘, 2015, 15: 142-143. |
| [3] |
International Diabetes Federation. IDF diabetes atlas-7th edition[EB/OL]. (2015-12-01)[2019-05-16]. https://diabetesatlas.org/resources/2017-atlas.html.
|
| [4] |
YANG Y, ZHAO Z, WANG Y, YANG L, LIU D, YANG X, et al. A novel asymmetric membrane osmotic pump capsule with in situ formed delivery orifices for controlled release of gliclazide solid dispersion system[J]. Int J Pharm, 2016, 506(1/2): 340-350. |
| [5] |
VATSAVAI L K, KILARI E K. Influence of curcumin on the pharmacodynamics and pharmacokinetics of gliclazide in animal models[J]. J Exp Pharmacol, 2016, 8: 69-76. DOI:10.2147/JEP.S117042 |
| [6] |
国家食品药品监督管理总局.普通口服固体制剂溶出曲线测定与比较指导原则[S/OL]. (2016-03-18)[2017-05-15].http://news.sda.gov.cn/WS01/CL0087/147583.html.
|
| [7] |
高国义, 刘志东, 解江纯. 格列齐特渗透泵片在Beagle犬体内的药动学[J]. 中国新药与临床杂志, 2009, 28: 518-522. |
| [8] |
WANG C Y, ZHANG W, XIANG B R, YU L, MA P C. Liquid chromatography-mass spectrometry method for the determination of gliclazide in human plasma and application to a pharmacokinetic study of gliclazide sustained release tablets[J]. Arzneimittelforschung, 2008, 58: 653-658. |
| [9] |
曾梅, 钟萌, 冯悦, 罗见春, 张奇娆, 张景勍. 阳离子阿奇霉素微类脂体体内外相关性[J]. 中国药理学通报, 2017, 33: 1713-1717. DOI:10.3969/j.issn.1001-1978.2017.12.017 |
| [10] |
TANG M, HU P, HUANG S, ZHENG Q, YU H, HE Y. Development of an extended-release formulation for apremilast and a level a in vitro-in vivo correlation study in Beagle dogs[J]. Chem Pharm Bull, 2016, 64: 1607-1615. DOI:10.1248/cpb.c16-00519 |
| [11] |
刘史佳, 张军, 居文政, 刘芳, 谈恒山. 格列齐特片在健康人体内的药代动力学及生物等效性研究[J]. 中国药物与临床, 2006, 6: 279-281. DOI:10.3969/j.issn.1671-2560.2006.04.012 |
| [12] |
孙建国, 高凌, 王广基, 吴子梅, 霍朝阳, 闫亚新. 格列齐特的人体药代动力学及其相对生物利用度研究[J]. 中国药科大学学报, 1998, 29: 217-220. DOI:10.3321/j.issn:1000-5048.1998.03.016 |
| [13] |
邱相君, 黄成坷, 钱昕, 胡国新, 代宗顺. 格列齐特的人体生物等效性研究[J]. 医药导报, 2006, 25: 874-876. DOI:10.3870/j.issn.1004-0781.2006.09.008 |
 2019, Vol. 40
2019, Vol. 40


