成骨细胞所致的骨形成与破骨细胞引起的骨吸收之间的动态平衡是维持骨骼功能的关键[1],当前者弱于后者时,骨代谢失去平衡,骨质减少,进而导致骨质疏松[2]。目前,抗骨质疏松药物研发已成为热点领域。啤酒花(Humulus lupulus L.)是新疆特色资源植物,其未成熟的带花果穗具有抗抑郁、抑菌、抗癌等功效[3-5]。苦味酸是啤酒花中的主要活性成分,可分为α-酸(如葎草酮)和β-酸(如蛇麻酮)两大类,总含量约占啤酒花的5%~20%[6]。现代药理研究表明,苦味酸具有抗炎及免疫调节的作用[7],能够减少骨关节炎的发生[8]。此外,苦味酸的植物雌激素样作用提示其具有对抗骨丢失的潜力[9]。本研究观察啤酒花中2种主要苦味酸类成分蛇麻酮和葎草酮对成骨细胞和破骨细胞的干预作用,并初步探讨其作用机制。
1 材料和方法 1.1 实验动物与试剂新生24 h的Wistar大鼠,购自上海斯莱克实验动物有限公司[实验动物质量合格证号:2013001831722;实验动物使用许可证号:SYXK(沪)2017-0004]。所有动物实验均符合实验动物伦理学要求。蛇麻酮、葎草酮单体化合物(纯度≥98%)购自武汉天植生物技术有限公司;胎牛血清购自美国Gibco公司;抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)检测试剂盒购自美国Sigma-Aldrich公司;骨桥蛋白(osteopontin,OPN)、骨涎蛋白(bone sialoprotein,BSP)、骨形成蛋白2(bone morphogenetic protein 2,BMP-2)、组织蛋白酶K(cathepsin K,CK)、基质金属蛋白酶9(matrix metalloprotein 9,MMP-9)抗体购自英国Abcam公司;β-actin抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体及抗兔IgG二抗购自美国Cell Signaling Technology公司;α-MEM培养基购自天津灏洋生物制品科技有限责任公司;Ⅰ型胶原酶、四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)、胰蛋白酶购自上海博光生物科技有限公司;骨钙素(osteocalcin,OCN)检测试剂盒购自南京建成生物工程研究所;电化学发光(electrochemiluminescence,ECL)显色试剂购自上海天能科技有限公司。
1.2 原代成骨细胞分离及培养取5只新生大鼠的颅盖骨,采用二次消化法[10]分离得到原代成骨细胞。用含10%胎牛血清的α-MEM培养液培养细胞,用胰蛋白酶进行消化传代。成骨细胞培养至第3~4代时可用于相关指标检测。
1.3 大鼠成骨细胞检测 1.3.1 细胞增殖将第3代大鼠成骨细胞按照1×104/mL的密度接种于96孔板,每孔100 μL。24 h后分别更换为含10-15、10-14、10-13 mol/L蛇麻酮、葎草酮的培养液,并设置对照组。48 h后采用MTT法检测成骨细胞的增殖情况。
1.3.2 碱性磷酸酶(alkaline phosphatase,ALP)活性将第3代大鼠成骨细胞按照2×104/mL的密度接种于24孔板,每孔500 μL。24 h后分别更换为含10-15、10-14、10-13 mol/L蛇麻酮、葎草酮的培养液,并设置对照组,培养过程中每2 d更换1次含药培养液。第8天用细胞裂解液裂解细胞,冰上裂解30 min后,收集细胞裂解液,于4 ℃、13 800×g离心5 min。用对硝基苯磷酸二钠法测定细胞ALP活性[11]。
1.3.3 矿化能力将第3代大鼠成骨细胞按照2×104/mL的密度接种于24孔板,每孔500 μL。24 h后更换为骨结节诱导液(50 μg/mL抗坏血酸,10 mmol/L β-甘油磷酸钠),培养过程中每2 d更换1次诱导液。第19天加入含10-15、10-14、10-13 mol/L蛇麻酮、葎草酮的培养液,并设置对照组,每2 d更换1次含药培养液,共给药3次。给药结束后用4%多聚甲醛固定细胞,茜素红染液(pH=8.3)染色并拍照。用10%氯化十六烷基吡啶溶解骨结节,吸取50 μL溶解液于96孔板,于570 nm处测定光密度(D)值。
1.3.4 OCN水平将第3代大鼠成骨细胞按照1×105/mL的密度接种于24孔板,每孔500 μL。24 h后分别更换为含10-15、10-14、10-13 mol/L蛇麻酮、葎草酮的培养液,并设置对照组。药物作用48 h后,收集细胞上清液,于4 ℃、13 800×g离心5 min,按试剂盒说明书检测OCN水平。
1.4 细胞因子诱导培养大鼠破骨细胞取新生大鼠四肢胫骨,剔除血管和结缔组织,用培养液将骨髓腔内的细胞悉数冲洗出。合并冲洗液,于13 800×g离心5 min。弃去上清后用磷酸盐缓冲液冲洗3次,即得新鲜骨髓单核细胞。用含5 ng/mL巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)的培养液重悬细胞,调整细胞密度为107~109/mL,24 h后收集未贴壁细胞,于13 800×g离心10 min。弃去上清,用含50 mol/L M-CSF的培养液重悬细胞,调整细胞密度为107~109/mL,接种于96孔板,每孔100 μL。4 d后更换为含50 ng/mL M-CSF、100 ng/mL核因子κB受体活化因子配体(receptor activator of nuclear factor kappa B ligand,RANKL)的完全培养液,每3 d换1次培养液。破骨细胞于第10天分化成熟,用于相关指标检测。
1.5 大鼠破骨细胞检测 1.5.1 细胞计数取培养成熟的大鼠破骨细胞,将培养液更换为含10-15、10-14、10-13mol/L蛇麻酮、葎草酮的培养液,并设置对照组。按照TRAP检测试剂盒说明书对破骨细胞进行检测,每孔随机选取10个视野,拍照,计算破骨细胞数目之和。
1.5.2 TRAP活性取培养成熟的大鼠破骨细胞,将培养液更换为含10-15、10-14、10-13mol/L蛇麻酮、葎草酮的培养液,并设置对照组。药物作用48 h后加入1% Triton X-100裂解细胞,于37 ℃裂解15 min。加入TRAP反应液(0.02 g对硝基苯磷酸二钠、0.1 g酒石酸钾钠,加入7.5 mL去离子水,溶解后加入1 mol/L HCl调节pH至3.5,加去离子水定容至10 mL),于37 ℃反应30 min;加入TRAP终止液(1 mol/L NaOH溶液),于405 nm处测定D值。建立对硝基苯酚标准曲线,TRAP活性用每孔破骨细胞生成的对硝基苯酚的nmol数表示。
1.6 蛋白质印迹检测将成熟的大鼠成骨细胞和破骨细胞裂解,提取细胞总蛋白,根据BCA法进行蛋白定量[12]。蛋白变性后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转膜、封闭后,分别加入OPN、BSP、BMP-2、CK和MMP-9抗体,4 ℃孵育过夜。用洗膜缓冲液(Tris-buffered saline/Tween-20,TBST)洗膜3×10 min,加入二抗,室温孵育30 min。用TBST再次洗膜3×10 min,采用ECL试剂进行检测。采用Tanon Image软件对蛋白印迹进行半定量分析。
1.7 统计学处理使用SPSS 22.0软件进行数据分析,实验数据以x±s表示。组间差异的比较采用单因素方差分析,两两比较采用LSD-t法。检验水准(α)为0.05。
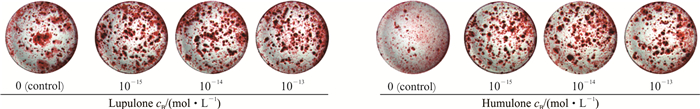
2 结果 2.1 蛇麻酮、葎草酮对大鼠成骨细胞增殖、分化、矿化及OCN水平的影响如表 1所示,与对照组相比,蛇麻酮在10-15、10-14 mol/L浓度下可促进成骨细胞增殖(P<0.05),在10-14、10-13 mol/L浓度下可提高成骨细胞ALP活性及骨结节矿化能力(P<0.05,P<0.01),在10-13 mol/L浓度下可促进骨形成相关蛋白OCN的表达(P<0.01)。葎草酮在10-15~10-13 mol/L浓度下均可促进成骨细胞增殖,提高ALP活性,增强骨结节矿化能力,促进OCN的表达(P均<0.01)。图 1为骨矿化结节茜素红染色图,同样显示蛇麻酮、葎草酮可促进成骨细胞的骨矿化能力,促进骨形成。
|
|
表 1 蛇麻酮、葎草酮对大鼠成骨细胞增殖、分化、矿化、OCN表达的影响 Tab 1 Effects of lupulone and humulone on rat osteoblastic proliferation, differentiation, mineralization and OCN expression |
|
图 1 大鼠成骨细胞骨矿化结节茜素红染色图 Fig 1 Representative images of rat osteoblastic bone mineralization nodule stained with alizarin red |
2.2 蛇麻酮、葎草酮对大鼠成骨细胞骨形成相关蛋白表达的影响
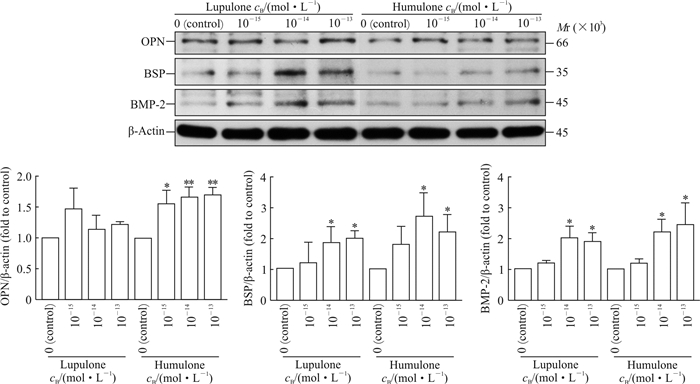
蛋白质印迹分析结果(图 2)显示,与对照组相比,蛇麻酮在10-14、10-13 mol/L浓度下可促进成骨细胞BSP和BMP-2的表达(P均<0.05),但对OPN水平无明显影响((P>0.05)。葎草酮在10-15~10-13 mol/L浓度范围内均可促进OPN的表达(P<0.05,P<0.01),在10-14、10-13 mol/L浓度下可促进BSP和BMP-2的表达(P均<0.05)。
|
图 2 蛇麻酮、葎草酮对大鼠骨形成相关蛋白表达的影响 Fig 2 Effects of lupulone and humulone on rat proteins related to bone formation OPN: Osteopontin; BSP: Bone sialoprotein; BMP-2: Bone morphogenetic protein 2. *P < 0.05, **P < 0.01 vs 0 mol/L (control) group. n=3, x±s |
2.3 蛇麻酮、葎草酮对大鼠破骨细胞数目及TRAP活性的影响
如表 2所示,与对照组相比,蛇麻酮、葎草酮在10-15~10-13 mol/L浓度下均可减少破骨细胞数目(P均<0.01);二者对破骨细胞TRAP活性有抑制趋势,但差异无统计学意义((P>0.05)。
|
|
表 2 蛇麻酮、葎草酮对破骨细胞数目、TRAP活性的影响 Tab 2 Effects of lupulone and humulone on number of osteoclasts and TRAP activity |
2.4 蛇麻酮、葎草酮对大鼠破骨细胞骨吸收相关蛋白表达的影响
蛋白质印迹分析结果(图 3)显示,与对照组相比,蛇麻酮在10-15~10-13 mol/L浓度下可抑制破骨细胞CK表达(P<0.05),且呈浓度依赖性,但其对MMP-9的表达无抑制作用(P>0.05)。葎草酮在10-15~10-13 mol/L浓度下均可抑制MMP-9和CK的表达(P<0.05,P<0.01)。

|
图 3 蛇麻酮、葎草酮对大鼠骨吸收相关蛋白表达的影响 Fig 3 Effects of lupulone and humulone on rat proteins related to bone resorption MMP-9: Matrix metalloproteinase 9; CK: Cathepsin K; GAPDH: Glyceraldehyde 3-phosphate dehydrogenase. *P < 0.05, **P < 0.01 vs control group. n=3, x±s |
3 讨论
成骨细胞和破骨细胞是骨代谢过程中的两种主要细胞,正常生理状态下,骨组织在这两种细胞的参与下不断进行代谢与重建。该过程包括破骨细胞贴附在旧骨区域,分泌酸性物质(如TRAP酶)溶解矿物质,形成骨吸收陷窝;其后,成骨细胞移行至被吸收部位,分泌骨基质,骨基质矿化而形成新骨[13]。
具体言之,成骨细胞的增殖、分化与矿化分别标志着骨基质的合成、分泌和矿化过程。成骨细胞的增殖水平反映骨形成的强弱,其分泌的ALP是成骨细胞分化阶段的关键酶[14],可介导骨组织矿化;而当成骨细胞外基质中形成羟磷灰石结晶则表示细胞进入矿化期[15]。本研究中,苦味酸类成分蛇麻酮和葎草酮均能促进成骨细胞的增殖,提高ALP活性,促进成骨细胞的骨矿化水平,提示二者可促进骨基质的分泌,加速骨质形成。成骨细胞合成并分泌的OPN是破骨细胞附着于骨表面、启动骨吸收过程的重要因子,BSP直接参与骨吸收过程,当破骨细胞脱离骨面后,成骨细胞进入骨表面,OPN和BSP开始介导成骨活动[16-17]。BMP-2是参与成骨细胞分化阶段的主要蛋白[18],而OCN参与成骨细胞由分化晚期进入矿化期的过程。本研究中,蛇麻酮和葎草酮可在一定程度上促进OCN、BSP和BMP-2的表达,说明二者可通过促进成骨细胞骨形成以维持骨稳态。
破骨细胞是一种巨大的多核细胞,由骨髓内造血干细胞经过破骨前体细胞分化而来。破骨细胞可利用其伪足吸收骨基质无机成分,降解有机成分,破坏骨组织结构。在骨吸收过程中,破骨细胞数目过多或活性过强可诱发骨质疏松。本研究中,蛇麻酮和葎草酮可使破骨细胞数目降低,但对TRAP活性无明显影响,说明蛇麻酮和葎草酮主要影响破骨前体细胞向破骨细胞的分化过程。CK是一种由破骨细胞表达的半胱氨酸蛋白酶[19],可降解骨基质中骨胶原蛋白,参与破骨细胞骨吸收过程[20]。MMP-9由破骨细胞分泌,可降解Ⅰ、Ⅲ、Ⅳ、Ⅴ型胶原及骨胶原[21],是骨组织重塑中的关键酶。本研究中蛇麻酮可抑制MMP-9的表达,葎草酮对MMP-9和CK均具有抑制作用,表明二者可抑制骨吸收过程,缓解骨质降解,防止骨丢失。
本研究首次在细胞水平上证明了两种苦味酸类成分葎草酮和蛇麻酮具有调节骨代谢的作用,具体表现为二者可促进成骨细胞的功能及骨形成能力,以及抑制破骨细胞的增殖及骨吸收活性,这为进一步探讨苦味酸类成分抗骨质疏松的作用机制以及相关药物的研发奠定了基础。
| [1] |
张乃丹, 蒋益萍, 薛黎明, 韩婷, 张巧艳, 辛海量. 仙茅酚苷类成分促进成骨细胞骨形成和抑制破骨细胞骨吸收[J]. 第二军医大学学报, 2016, 37: 562-568. ZHANG N D, JIANG Y P, XUE L M, HAN T, ZHANG Q Y, XIN H L. Phenolic glycosides in Curculigo orchioides promotes osteoblastic bone formation and inhibits osteoclastic bone resorption[J]. Acad J Sec Mil Med Univ, 2016, 37: 562-568. |
| [2] |
Consensus development conference: diagnosis, prophylaxis and treatment of osteoporosis[J]. Am J Med, 1993, 94: 646-650.
|
| [3] |
DI VIESTI V, CARNEVALE G, ZAVATTI M, BENELLI A, ZANOLI P. Increased sexual motivation in female rats treated with Humulus lupulus L. extract[J]. J Ethnopharmacol, 2011, 134: 514-517. DOI:10.1016/j.jep.2010.12.040 |
| [4] |
ZHANG B, CHU W, WEI P, LIU Y, WEI T. Xanthohumol induces generation of reactive oxygen species and triggers apoptosis through inhibition of mitochondrial electron transfer chain complexⅠ[J]. Free Radical Biol Med, 2015, 89: 486-497. DOI:10.1016/j.freeradbiomed.2015.09.021 |
| [5] |
GERHÄUSER C. Broad spectrum antiinfective potential of xanthohumol from hop (Humulus lupulus L.) in comparison with activities of other hop constituents and xanthohumol metabolites[J]. Mol Nutr Food Res, 2005, 49: 827-831. DOI:10.1002/(ISSN)1613-4133 |
| [6] |
KAO T H, WU G Y. Simultaneous determination of prenylflavonoid and hop bitter acid in beer lee by HPLCDAD-MS[J]. Food Chem, 2013, 141: 1218-1226. DOI:10.1016/j.foodchem.2013.04.032 |
| [7] |
YAJIMA H, IKESHIMA E, SHIRAKI M, KANAYA T, FUJIWARA D, ODAI H, et al. Isohumulones, bitter acids derived from hops, activate both peroxisome proliferatoractivated receptor alpha and gamma and reduce insulin resistance[J]. J Biol Chem, 2004, 279: 33456-33462. DOI:10.1074/jbc.M403456200 |
| [8] |
HALL A J, BABISH J G, DARLAND G K, CARROLL B J, KONDA V R, LERMAN R H, et al. Safety, efficacy and anti-inflammatory activity of rho iso-alpha-acids from hops[J]. Phytochemistry, 2008, 69: 1534-1547. DOI:10.1016/j.phytochem.2008.02.001 |
| [9] |
张嘉, 李多伟, 张小燕, 董崇强, 赵蓉, 张媛媛. 超声提取啤酒花中植物雌激素样物质工艺的研究[J]. 西北药学杂志, 2007, 22: 14-15. DOI:10.3969/j.issn.1004-2407.2007.01.008 |
| [10] |
翟远坤, 牛银波, 潘亚磊, 李晨睿, 武祥龙, 梅其炳. 柚皮苷对体外培养乳鼠颅骨成骨细胞增殖和分化成熟的影响[J]. 中国中药杂志, 2013, 38: 105-111. |
| [11] |
张乃丹.基于分子对接策略的熟地黄防治糖尿病性骨质疏松症有效成分及其作用机制研究[D].上海: 第二军医大学, 2016.
|
| [12] |
薛黎明.基于蛋白质组学淫羊藿苷防治骨质疏松作用机理及药对"淫羊藿仙茅"配伍机制研究[D].上海: 第二军医大学, 2012.
|
| [13] |
张葆鑫, 王兴国, 郝廷. 成骨细胞、破骨细胞与骨折愈合的相关性研究进展[J]. 中国现代医生, 2017, 55: 161-164. |
| [14] |
MANOLAGAS S C. Birth and death of bone cells:basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis[J]. Endocr Rev, 2000, 21: 115-137. |
| [15] |
童安莉, 陈璐璐, 丁桂芝. 成骨细胞骨形成机制研究进展[J]. 中国骨质疏松杂志, 1999, 5: 60-64. DOI:10.3969/j.issn.1006-7108.1999.03.020 |
| [16] |
ROOHANI-ESFAHANI S I, NO Y J, LU Z, NG P Y, CHEN Y, SHI J, et al. A bioceramic with enhanced osteogenic properties to regulate the function of osteoblastic and osteocalastic cells for bone tissue regeneration[J/OL]. Biomed Mater, 2016, 11: 35018. doi: 10.1088/1748-6041/11/3/035018.
|
| [17] |
ATANGA E, DOLDER S, DAUWALDER T, WETTERWALD A, HOFSTETTER W. TNFα inhibits the development of osteoclasts through osteoblast-derived GM-CSF[J]. Bone, 2011, 49: 1090-1100. DOI:10.1016/j.bone.2011.08.003 |
| [18] |
安新玲, 韩金祥, 王世立. 骨形态发生蛋白的研究进展[J]. 食品与药品, 2009, 11: 69-73. |
| [19] |
COSTA A G, CUSANO N E, SILVA B C, CREMERS S, BILEZIKIAN J P. Cathepsin K: its skeletal actions and role as a therapeutic target in osteoporosis[J/OL]. Nat Rev Rheumatol, 2011, 7: 447. doi: 10.1038/nrrheum.2011.77.
|
| [20] |
ZHAO Q, JIA Y, XIAO Y. Cathepsin K:a therapeutic target for bone diseases[J]. Biochem Biophys Res Commun, 2009, 380: 721-723. DOI:10.1016/j.bbrc.2009.01.139 |
| [21] |
HE B, HU M, LI S D, YANG X T, LU Y Q, LIU J X, et al. Effects of geraniin on osteoclastic bone resorption and matrix metalloproteinase-9 expression[J]. Bioorg Med Chem Lett, 2013, 23: 630-634. DOI:10.1016/j.bmcl.2012.12.005 |
 2019, Vol. 40
2019, Vol. 40


