2. 解放军第五医院心肾内科, 银川 750000;
3. 海军军医大学(第二军医大学)药物安全检测中心, 上海 200433
2. Department of Cardiology and Nephrology, No.5 Hospital of PLA, Yinchuan 750000, Ningxia Hui Autonomous Region, China;
3. Center for Evaluation of Drug Safety, Naval Medical University(Second Military Medical University), Shanghai 200433, China
胃肠道症状是慢性肾功能衰竭(chronic renal failure,CRF)早期发生率较高的并发症之一,长期合并胃肠道症状会进一步导致各种营养不良[1-2],进而增加患者住院率及病死率[3],但其发生和发展的病理生理机制目前尚不完全清楚。已有研究证实,炎症和氧化应激参与CRF的进展[4-6]。机体氧化-抗氧化失衡可通过多种指标衡量。丙二醛(malondialdehyde,MDA)是脂质过氧化作用的产物,是描述脂质过氧化最好的标志物之一[7-8]。氧化应激也可引起DNA损伤,8-羟脱氧鸟苷(8-hydroxy deoxyguanosine,8-OHdG)被认为是目前氧化应激DNA损伤的标志物之一[8]。超氧化物歧化酶(superoxide dismutase,SOD)是内源性抗氧化酶,也是机体重要的自由基清除剂[9-10]。内源性和食物源衍生抗氧化剂的总和即为细胞外液的总抗氧化能力(total antioxidant capacity,TAC)。
结肠(尤其回盲瓣附近的结肠组织)是机体微生物群落聚集的场所。研究证实,尿毒症毒素累积破坏肠道固有菌群的生态平衡,进而损伤肠道黏膜屏障[11]。肠道微生物失调可导致机体微炎症、氧化-抗氧化失衡,甚至氧化应激的激活[12],严重者损伤细胞膜,影响线粒体呼吸链相关复合体Ⅲ的编码基因——泛素细胞色素C诱导核心蛋白酶Ⅰ(ubiquinol cytochrome C reductase core protein Ⅰ,UQCRC1)的表达[13-14],从而影响能量的产生。因此各种菌群聚集的肠道可能是全身氧化应激激活的起始部位。结肠组织中是否存在氧化应激反应、是否参与胃肠道功能障碍的发生,目前尚不清楚。本研究通过构建CRF大鼠模型,探讨CRF条件下结肠组织中是否存在氧化应激反应,并进一步探索其机制。
1 材料和方法 1.1 动物模型构建与分组所有动物实验的操作均按照严格的操作步骤进行,并通过海军军医大学(第二军医大学)动物伦理委员会审核。4~6周龄的Sprague-Dawley(SD)大鼠30只,体质量150~160 g,购自海军军医大学(第二军医大学)实验动物中心[动物使用许可证号:SYXK(沪)2012-0003]。动物饲养在海军军医大学(第二军医大学)实验动物中心无特定病原体(specific pathogen free,SPF)级实验室,温度20~25 ℃,相对湿度65%~75%,光照周期为12 h/12 h。将大鼠随机分为对照组(10只)和CRF组(20只)。通过5/6肾脏切除建立CRF模型[15]。对照组大鼠予以腹腔注射10%水合氯醛(2.5 mL/kg)麻醉后,仅剥离肾外包膜后缝合;CRF组大鼠麻醉后切除左侧肾脏上、下极各1/3肾组织,1周后再切除右侧肾脏,完成CRF模型的建立[13]。所有大鼠手术后均未使用抗生素。成模后第10周,所有大鼠予以腹腔注射10%水合氯醛(4 mL/kg)麻醉,收集血液和近回盲瓣结肠组织标本。近回盲瓣结肠组织收集后立即放在-80 ℃保存。血液标本经4 ℃ 250×g离心10 min取上清液,之后于-80 ℃保存。
实验过程中,CRF组有8只大鼠死亡、对照组有2只大鼠死亡,因此,在第10周实验结束时,CRF组有12只大鼠标本、对照组有8只大鼠标本用于研究。检测肾功能指标血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,SCr)以评估造模是否成功。
1.2 生物化学指标检测取0.2 g回盲瓣结肠组织,切成小块,放入玻璃管中,加入冷生理盐水,研磨成浆,经4 ℃ 440×g离心10 min后,取上清液待测。血清标本从冰箱取出后,经37 ℃水浴箱复温待测。使用硫代巴比妥酸(thiobarbituric acid,TBA)方法检测结肠组织中MDA的含量[16],使用Bio-Assay试剂盒(美国Hayward公司)检测血清中MDA含量;使用Randox-Ransod酶试剂盒(德国Darmstadt公司)测定血清和结肠组织中SOD活性;使用TAC检测试剂盒(DTAC-100,美国BioAssay Systems公司)检测血清和结肠组织中的TAC;用ELISA法检测血清和结肠组织中8-OHdG,ELISA试剂盒购自艾美捷科技有限公司(批号:589320-96)。
1.3 实时荧光定量PCR检测UQCRC1 mRNA的表达取25~30 mg结肠组织放于离心管中,在平底玻璃管中加入1 mL TRIzol液(15596-026,Invitrogen公司),使用匀浆机匀浆后放于冰上,之后加入200 μL氯仿[货号:10006818,基尔顿生物科技(上海)有限公司],用震荡器剧烈摇荡,之后4 ℃ 21 000×g离心15 min取上清液;加入600 μL异丙醇[基尔顿生物科技(上海)有限公司,货号:40064360],混合均匀,4 ℃静置1 h,之后4 ℃ 21 000×g离心15 min去上清液,加入1 mL 75%的无水乙醇[750 μL无水乙醇+250 μL焦碳酸二乙酯(货号:750024,美国Invitrogen公司)]漂洗,4 ℃ 21 000×g离心5 min,用无水乙醇洗2次;弃上清,室温干燥10 min至沉淀透明,加入焦碳酸二乙酯溶解RNA。溶解后测RNA浓度,-80 ℃冰箱保存。将获得的RNA按照反转录试剂盒(货号:K1622,美国Fermentas公司)的步骤,获得cDNA。以鼠的甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,检测UQCRC1 mRNA的表达。GAPDH上游引物:5′-TGG AGT CTA CTG GCG TCT TG-3′,下游引物:5′-TGT CAT ATT TCT CGT GGT TCA TC-3′;UQCRC1上游引物:5′-AGC AGT GTC TCC CAG GTG TAC-3′,下游引物:5′-AGC CAC GTT GTC TGG GTT AGC-3′。实验过程中,将上游引物和下游引物各取10 μL加到80 μL无酶水组成引物混合物。取5 μL荧光染料SYBR Green Mix(货号:CS7561,美国Invitrogen公司)、1 μL引物混合物、3 μL无酶水、2 μL稀释后的cDNA构成实时荧光定量PCR扩增体系。将扩增体系分别加入96孔板,使用荧光定量PCR仪(CFX96TM Real-Time Systerm,美国Bio-Rad公司),设定反应程序。
1.4 蛋白质印迹法检测线粒体相关蛋白表达使用添加有蛋白酶和磷酸酶抑制剂(美国Thermo Fisher公司)的RIPA裂解液和提取液(美国G-Biosciences公司)提取回盲瓣结肠组织蛋白,使用BCA蛋白测定试剂盒(美国Thermo Scientific公司)测定蛋白质浓度,进行蛋白质印迹实验[14]。UQCRC1抗体购自英国Abcam公司(货号为ab197055,稀释比例为1:1 000),荧光二抗购自美国LI-COR Biosciences公司(稀释比例为1:10 000)。
1.5 统计学处理应用SPSS 18.0软件进行数据分析。计量资料均以x±s表示,正态分布的连续变量组间比较采用两独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 肾功能检测结果实验第10周结束后采集大鼠血清检测肾功能,结果显示CRF组BUN为(15.30±5.64)mmol/L,高于对照组[(5.74±0.77)mmol/L],差异有统计学意义(P=0.003);CRF组SCr为(77.68±23.51)μmol/L,高于对照组[(37.28±10.10)μmol/L],差异有统计学意义(P=0.023)。检测结果表明造模成功。
2.2 血清和结肠组织氧化应激相关指标检测结果与对照组相比,CRF组血清及结肠组织中MDA含量升高,差异有统计学意义(P<0.01)。2组血清及结肠组织中8-OHdG、SOD、TAC的差异无统计学意义((P>0.05)。见表 1。
|
|
表 1 CRF大鼠血清和结肠组织氧化应激相关指标的变化 Tab 1 Oxidative stress markers in serum and colon tissues of CRF rats in two groups |
2.3 结肠组织中UQCRC1的表达
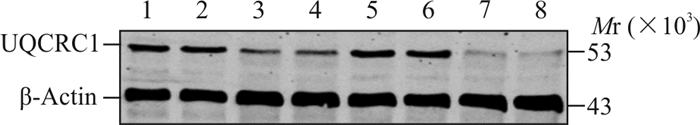
对照组大鼠结肠组织中UQCRC1 mRNA相对表达量为0.433±0.056,CRF组UQCRC1 mRNA相对表达量为0.409±0.120,2组间差异无统计学意义(P=0.57)。对照组和CRF组大鼠结肠组织中UQCRC1蛋白的表达结果见图 1,CRF组UQCRC1蛋白的相对表达量(0.49±0.23)较对照组(1.37±0.19)下降,差异有统计学意义(P<0.05)。
|
图 1 蛋白质印迹法检测2组CRF大鼠结肠组织中UQCRC1蛋白的表达 Fig 1 UQCRC1 protein expression in colon tissues of CRF rats in two groups detected by Western blotting CRF: Chronic renal failure; UQCRC1: Ubiquinolcytochrome C reductase core protein Ⅰ. 1, 2, 5, 6: Control group; 3, 4, 7, 8: CRF group |
3 讨论
胃肠道功能障碍是CRF患者发生率较高的并发症,目前已知的相关机制主要包括:(1)胃肠道排空延迟[17];(2)腹膜透析患者腹腔内压力增加而食管下段压力降低[18];(3)结肠转运时间延长[19-20];(4)肠道菌群改变。然而,越来越高的发病率[2]尚不能完全用以上传统的发病机制解释。研究表明,氧化应激在CRF的发生和进展中发挥重要作用[21-22]。研究证实,急性微炎症感染、细胞因子释放减少、CRF相关的并发症(慢性心力衰竭等)以及血液透析相关因素均可导致CRF相关的氧化应激[12]。炎症和氧化应激作为非传统因素,已经有报道证实其参与CRF的病变进展[4-6]。BUN和其他毒素的聚集可能是氧化应激的主要来源[13, 23-24]。而肠道是细菌繁殖的场所,可能与诱导炎症、参与氧化应激的进展有关,但具体机制尚不清楚。
本研究从菌群集中的肠道出发,探究CRF时是否存在肠源性氧化应激的激活,从非传统因素上探寻CRF相关胃肠道功能障碍的机制。MDA是生物体内自由基作用于脂质发生过氧化反应而产生的氧化终产物,可引起蛋白质、核酸等生命大分子的交联聚合[7, 25],同时影响线粒体呼吸链复合物及线粒体内关键酶活性[12-13],加剧细胞膜的损伤[13],是机体氧化应激的标志产物之一[7-8]。本研究证实,CRF组大鼠与对照组相比结肠组织和血清中MDA水平升高,表明在CRF状态下结肠组织中启动了氧化应激反应,同时也存在系统性氧化应激的激活,但结肠组织中氧化应激的激活是否为全身氧化应激激活的源头尚未可知。然而,作为DNA氧化损伤标志物的8-OHdG在CRF大鼠中变化不明显,CRF大鼠的抗氧化指标(SOD和TAC)改变也不明显。究其原因,可能与以下几个方面有关。首先,MDA是机体脂质过氧化的标志物,是多不饱和脂肪酸级联氧化降解的产物[8];而8-OHdG是DNA氧化性损伤的标志物,可以代表遗传物质的永久性修饰,参与突变、致癌和衰老等机制[25]。进一步解读本研究结果,CRF组大鼠发生了脂质过氧化,但无明显的DNA氧化性损伤,尚无遗传物质永久性修饰改变,这可能与尿毒症的病程和严重程度有关。Kuchta等[8]研究发现,CRF患者氧化应激促进肾功能衰竭的发生和发展。实际上,终末期肾病患者SCr水平通常为正常值上限的10倍以上。而动物实验研究发现,在5/6肾脏切除术后8周就可导致动物出现肾功能损伤,但由于存在个体差异,其残存肾功能也各不相同。本研究中,通过5/6肾切除建立的CRF模型组大鼠较对照组大鼠SCr水平升高2~3倍,和临床上的尿毒症期尚有一定差距,且肾功能损伤的时间较短,未必能够达到长期、高浓度尿毒症毒素刺激造成的损伤结果,其氧化损伤程度较低,还未引发DNA的氧化损伤,这可能是2组8-OHdG差异不大的原因。
其次,机体正常情况下存在氧化-抗氧化的平衡,该平衡是维持机体健康生存所必需的,一旦平衡被打破将出现一系列的病理生理改变。但机体发生氧化损伤时,抗氧化的防御也会随之开始。本研究发现,CRF大鼠结肠组织发生氧化损伤,但相应的抗氧化防御并未随之发生。这种氧化-抗氧化的失衡现象在CRF中并不常见。前期大量研究证实慢性肾脏病发生时伴有氧化产物的大量增加及抗氧化物质的减少[13, 26-28],相关的具体机制尚未完全清楚。虽然有许多标志物可用于描述氧化与抗氧化失衡,但是CRF状态下最有价值的标志物尚不明确。CRF患者TAC的异常结果与其氧化反应参数无关[8, 29]。有学者提出,通过TAC评估慢性肾脏病患者抗氧化能力可靠性不高[8]。本研究也发现,2组间血清及结肠组织中TAC水平差异无统计学意义。值得一提的是,许多研究者已经提出尿酸、抗坏血酸或血浆蛋白可能干扰TAC的测定,或者它们可能代表TAC的主要成分,如尿酸水平的升高主要(约49%)影响TAC值[30]。因此,关于CRF抗氧化反应的指标还有待进一步研究,以确立其代表性和可靠度。
本研究还评估了线粒体呼吸链相关蛋白的水平,结果显示与对照组相比,CRF组结肠组织中编码线粒体呼吸链复合体Ⅲ的UQCRC1蛋白的表达明显下降,但2组UQCRC1在mRNA水平上差异无统计学意义。对于结肠UQCRC1在蛋白和mRNA水平的非线性关系,我们认为可能与以下原因有关:(1)细胞内调节的问题,这可能涉及更为复杂的细胞内代谢调节,需要进一步在转录组水平进行验证;(2)蛋白质和mRNA的降解速度不一样,影响了实验结果。之前有研究证实,慢性肾脏病患者线粒体功能下降与氧化应激的激活有关[31],这与本研究结果一致。CRF组大鼠结肠组织存在线粒体呼吸链蛋白表达下降,影响线粒体功能。而众所周知,线粒体是机体最为重要的能量来源,其功能受损将导致机体能量供应减少,这可能是CRF患者出现胃肠道功能障碍,特别是低动力性功能障碍如厌食、便秘、嗳气等的机制之一。除此之外,CRF状态下,线粒体功能障碍与氧化应激伴发,主要因为细胞内活性氧的产生与线粒体呼吸链上超氧阴离子的产生以及复合体Ⅰ和Ⅲ的产生有关[25]。Gamboa等[32]研究证实发生慢性肾脏病时线粒体结构和功能明显损伤,慢性肾脏病5期患者骨骼肌中线粒体数量减少、密度降低,线粒体DNA拷贝数减少;同时,慢性肾脏病患者氧化应激相关的生物标志物升高。这一结果证实,CRF时氧化应激的激活和线粒体功能障碍有一定的相关性。
综上所述,本研究证实CRF大鼠血清及结肠组织中存在脂质过氧化反应,但不伴有抗氧化相关酶水平的异常及DNA氧化损伤;CRF大鼠结肠组织的氧化激活作为全身氧化应激反应的一部分参与到了氧化应激的启动中,在激活氧化应激方面发挥重要作用。在CRF大鼠中,无论是结肠组织局部还是全身反应中,都存在氧化-抗氧化的失衡。值得一提的是,在CRF条件下,结肠组织中线粒体呼吸链的功能异常与氧化应激的激活同时存在,二者之间可能有一定的因果联系,这可能是CRF患者出现胃肠道症状的非传统机制之一。由于本研究仅对CRF状态下的肠道氧化应激反应及线粒体功能进行了初步的探索性研究,肠源性氧化应激是否为全身系统氧化应激的起源、氧化应激与线粒体功能之间究竟存在怎样的关联,还需要进一步的深入研究。
| [1] |
YANG M, BAI Y H, WANG J S, JIANG H Y, HU S L. Preliminary study of Bim on the early diagnosis and prognosis of the elderly uremia with gastrointestinal nutrition combined with dialysis[J]. Eur Rev Med Pharmacol Sci, 2018, 22: 4598-4603. |
| [2] |
YU M K, WONG S P Y, LIU C F, HEBERT P L, O'HARE A M. Clinical presentation at initiation of maintenance dialysis and subsequent survival: a retrospective cohort study[J/OL]. Hemodial Int, 2018. doi: 10.1111/hdi.12690.[Epubaheadofprint].
|
| [3] |
SEGALL L, MOSCALU M, HOGAŞ S, MITITIUC I, NISTOR I, VEISA G, et al. Protein-energy wasting, as well as overweight and obesity, is a long-term risk factor for mortality in chronic hemodialysis patients[J]. Int Urol Nephrol, 2014, 46: 615-621. DOI:10.1007/s11255-014-0650-0 |
| [4] |
VERA M, TORRAMADE-MOIX S, MARTINRODRIGUEZ S, CASES A, CRUZADO J M, RIVERA J, et al. Antioxidant and anti-inflammatory strategies based on the potentiation of glutathione peroxidase activity prevent endothelial dysfunction in chronic kidney disease[J]. Cell Physiol Biochem, 2018, 51: 1287-1300. DOI:10.1159/000495540 |
| [5] |
YEUN J Y, LEVINE R A, MANTADILOK V, KAYSEN G A. C-reactive protein predicts all-cause and cardiovascular mortality in hemodialysis patients[J]. Am J Kidney Dis, 2000, 35: 469-476. DOI:10.1016/S0272-6386(00)70200-9 |
| [6] |
JANKOWSKA M, COBO G, LINDHOLM B, STENVINKEL P. Inflammation and protein-energy wasting in the uremic milieu[J]. Contrib Nephrol, 2017, 191: 58-71. |
| [7] |
HASUIKE Y, NAGAI T, YORIFUJI S, TANAKA S, MATSUMOTO A, YAHIRO M, et al. The mitochondrial protein frataxin is downregulated in hemodialysis patients[J]. Clin Exp Nephrol, 2013, 17: 424-430. DOI:10.1007/s10157-012-0737-9 |
| [8] |
KUCHTA A, PACANIS A, KORTAS-STEMPAK B, CWIKLIŃSKA A, ZIĘTKIEWICZ M, RENKE M, et al. Estimation of oxidative stress markers in chronic kidney disease[J]. Kidney Blood Press Res, 2011, 34: 12-19. DOI:10.1159/000321508 |
| [9] |
GHOSH S S, KRIEG R J, SICA D A, WANG R, FAKHRY I, GEHR T. Cardiac hypertrophy in neonatal nephrectomized rats:the role of the sympathetic nervous system[J]. Pediatr Nephrol, 2009, 24: 367-377. |
| [10] |
BAI J, HAO J, ZHANG X, GUI H, HAN J, GAO N. Netrin-1 attenuates the progression of renal dysfunction by blocking endothelial-to-mesenchymal transition in the 5/6 nephrectomy rat model[J/OL]. BMC Nephrol, 2016, 17: 47. doi: 10.1186/s12882-016-0260-4.
|
| [11] |
DE ALMEIDA DUARTE J B, DE AGUILARNASCIMENTO J E, NASCIMENTO M, NOCHI R J Jr. Bacterial translocation in experimental uremia[J]. Urol Res, 2004, 32: 266-270. DOI:10.1007/s00240-003-0381-7 |
| [12] |
RON-HAREL N, SANTOS D, GHERGUROVICH J M, SAGE P T, REDDY A, LOVITCH S B, et al. Mitochondrial biogenesis and proteome remodeling promote one-carbon metabolism for T cell activation[J]. Cell Metab, 2016, 24: 104-117. DOI:10.1016/j.cmet.2016.06.007 |
| [13] |
TYLICKI L, RUTKOWSKI B, HÖRL W H. Antioxidants:a possible role in kidney protection[J]. Kidney Blood Press Res, 2003, 26(5/6): 303-314. |
| [14] |
PENG H, CAO J, YU R, DANESH F, WANG Y, MITCH W E, et al. CKD stimulates muscle protein loss via Rhoassociated protein kinase 1 activation[J]. J Am Soc Nephrol, 2016, 27: 509-519. DOI:10.1681/ASN.2014121208 |
| [15] |
KREN S, HOSTETTER T H. The course of the remnant kidney model in mice[J]. Kidney Int, 1999, 56: 333-337. DOI:10.1046/j.1523-1755.1999.00527.x |
| [16] |
WILSON D W, METZ H N, GRAVER L M, RAO P S. Direct method for quantification of free malondialdehyde with high-performance capillary electrophoresis in biological samples[J]. Clin Chem, 1997, 43: 1982-1984. |
| [17] |
STRID H, SIMRÉN M, STOTZER P O, ABRAHAMSSON H, BJÖRNSSON E S. Delay in gastric emptying in patients with chronic renal failure[J]. Scand J Gastroenterol, 2004, 39: 516-520. DOI:10.1080/00365520410004505 |
| [18] |
DEJARDIN A, ROBERT A, GOFFIN E. Intraperitoneal pressure in PD patients:relationship to intraperitoneal volume, body size and PD-related complications[J]. Nephrol Dial Transplant, 2007, 22: 1437-1444. DOI:10.1093/ndt/gfl745 |
| [19] |
WU M J, CHANG C S, CHENG C H, CHEN C H, LEE W C, HSU Y H, et al. Colonic transit time in long-term dialysis patients[J]. Am J Kidney Dis, 2004, 44: 322-327. DOI:10.1053/j.ajkd.2004.04.048 |
| [20] |
LEFEBVRE H P, FERRÉ J P, WATSON A D, BROWN C A, SERTHELON J P, LAROUTE V, et al. Small bowel motility and colonic transit are altered in dogs with moderate renal failure[J]. Am J Physiol Regul Integr Comp Physiol, 2001, 281: R230-R238. DOI:10.1152/ajpregu.2001.281.1.R230 |
| [21] |
POESEN R, MEIJERS B, EVENEPOEL P. The colon:an overlooked site for therapeutics in dialysis patients[J]. Semin Dial, 2013, 26: 323-332. DOI:10.1111/sdi.2013.26.issue-3 |
| [22] |
MILLER L S, VEGESNA A K, SAMPATH A M, PRABHU S, KOTAPATI S K, MAKIPOUR K. Ileocecal valve dysfunction in small intestinal bacterial overgrowth:a pilot study[J]. World J Gastroenterol, 2012, 18: 6801-6808. DOI:10.3748/wjg.v18.i46.6801 |
| [23] |
WANG F, ZHANG P, JIANG H, CHENG S. Gut bacterial translocation contributes to microinflammation in experimental uremia[J]. Dig Dis Sci, 2012, 57: 2856-2862. DOI:10.1007/s10620-012-2242-0 |
| [24] |
PERICO L, MORIGI M, BENIGNI A. Mitochondrial sirtuin 3 and renal diseases[J]. Nephron, 2016, 134: 14-19. DOI:10.1159/000444370 |
| [25] |
VALKO M, LEIBFRITZ D, MONCOL J, CRONIN M T, MAZUR M, TELSER J. Free radicals and antioxidants in normal physiological functions and human disease[J]. Int J Biochem Cell Biol, 2007, 39: 44-84. DOI:10.1016/j.biocel.2006.07.001 |
| [26] |
ARAUJO M, WELCH W J. Oxidative stress and nitric oxide in kidney function[J]. Curr Opin Nephrol Hypertens, 2006, 15: 72-77. DOI:10.1097/01.mnh.0000191912.65281.e9 |
| [27] |
PRZEKWAS M, MAŁGORZEWICZ S, ZDROJEWSKI Z, DEBSKA-SLIZIEŃ A, ŁYSIAK-SZYDŁOWSKA W, RUTKOWSKI B. Influence of predialysis oxidative stress on peroxidation processes after renal transplantation[J]. Transplant Proc, 2003, 35: 2170-2173. DOI:10.1016/S0041-1345(03)00767-X |
| [28] |
VAZIRI N D. Roles of oxidative stress and antioxidant therapy in chronic kidney disease and hypertension[J]. Curr Opin Nephrol Hypertens, 2004, 13: 93-99. DOI:10.1097/00041552-200401000-00013 |
| [29] |
ANTOLINI F, VALENTE F, RICCIARDI D, BARONI M, FAGUGLI R M. Principal component analysis of some oxidative stress parameters and their relationships in hemodialytic and transplanted patients[J]. Clin Chim Acta, 2005, 358(1/2): 87-94. |
| [30] |
KAMPA M, NISTIKAKI A, TSAOUSIS V, MALIARAKI N, NOTAS G, CASTANAS E. A new automated method for the determination of the Total Antioxidant Capacity (TAC) of human plasma, based on the crocin bleaching assay[J/OL]. BMC Clin Pathol, 2002, 2: 3. doi: 10.1186/1472-6890-2-3.
|
| [31] |
DONG R, GUO Z Y, DING J R, ZHOU Y Y, WU H. Gastrointestinal symptoms:a comparison between patients undergoing peritoneal dialysis and hemodialysis[J]. World J Gastroenterol, 2014, 20: 11370-11375. DOI:10.3748/wjg.v20.i32.11370 |
| [32] |
GAMBOA J L, BILLINGS F T 4th, BOJANOWSKI M T, GILLIAM L A, YU C, ROSHANRAVAN B, et al. Mitochondrial dysfunction and oxidative stress in patients with chronic kidney disease[J/OL]. Physiol Rep, 2016, 4. pii: e12780. doi: 10.14814/phy2.12780.
|
 2019, Vol. 40
2019, Vol. 40


