肝细胞癌作为常见恶性肿瘤之一,在发展中国家有较高的发病率,严重威胁人类健康。且肝细胞癌起病较隐匿,大多数患者发现时已处于晚期,已失去手术治疗的最佳时机[1]。通过非手术治疗方法治疗晚期肝细胞癌是一种重要的手段,然而肝细胞癌对常规的放射治疗和化学治疗并不敏感,因此寻找新的治疗靶点和开发新的药物显得尤为重要。姜黄素作为中药姜黄中的一种化学成分,具有一定的抗肿瘤作用,且其对正常细胞毒性低,是一种潜在的抗肿瘤药[2]。研究发现,姜黄素能通过促进肿瘤细胞凋亡发挥抗肿瘤作用[3],但姜黄素促进肿瘤细胞凋亡的机制不十分明确,仍需进一步探讨。
自噬是细胞通过吞噬自身胞质蛋白和细胞器实现自我更新的一种方式[4]。自噬在肿瘤中的作用具有双面性,既能对肿瘤细胞增殖产生抑制作用,又能促进肿瘤的发生和发展[5]。研究发现哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路能够调节自噬的产生,而姜黄素能通过mTOR通路发挥抗肿瘤作用[3]。有研究表明自噬与凋亡存在相关性,自噬能够促进细胞凋亡[6]。本研究旨在验证姜黄素对人肝癌细胞系Huh7细胞的抑制增殖和促进凋亡作用,并观察姜黄素对自噬的影响及自噬在姜黄素抗肿瘤效应中所发挥的作用,探讨姜黄素对肝细胞癌的抑癌作用机制。
1 材料和方法 1.1 细胞与试剂人肝癌细胞系Huh7细胞购自中国科学院上海生命科学研究院(目录号:TCHu182),DMEM细胞培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,青霉素、链霉素、蛋白质印迹分析所需试剂均购自上海博光生物科技有限公司,姜黄素购自美国Sigma公司,自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)购自大连美仑生物技术有限公司,自噬检测试剂盒购自英国Abcam公司,Annexin Ⅴ-FITC细胞凋亡检测试剂盒和BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司,自噬微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)兔单克隆抗体购自美国CST公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔多克隆抗体购自美国Santa Cruz公司。
1.2 细胞培养及分组Huh7细胞用含10% FBS和1%青霉素、链霉素的DMEM培养液于37 ℃、5% CO2孵箱中培养。将Huh7细胞传代等分到6孔板中,培养24 h后用于实验;3-MA提前1 h加入细胞中,终浓度为5 mmol/L。细胞分为7组:空白对照组,5、10、20、40 μmol/L姜黄素处理组,3-MA处理组,3-MA和20 μmol/L姜黄素联合处理组。给药48 h后收集细胞备用。
1.3 CCK-8检测细胞增殖情况取对数生长期的Huh7细胞,以每孔5 000个细胞的密度接种于96孔板内。细胞完全贴壁后加入含5、10、20、40 μmol/L姜黄素的培养液,同时设置不加姜黄素的对照组,每组设5个复孔,培养24、36、48 h后弃培养液,加入含CCK-8试剂的培养液,2 h后用酶标仪检测450 nm处的光密度(D)值。
1.4 蛋白质印迹法检测细胞中LC3-Ⅱ和LC3-Ⅰ的表达将Huh7细胞用磷酸盐缓冲液(phosphate buffer saline,PBS)洗2次后加入RIPA蛋白裂解液200 μL和蛋白酶抑制剂苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)2 μL,冰上放置5 min后刮下细胞,4 ℃摇床放置10 min。收集细胞悬液,4 ℃ 17 000×g离心8 min,取上清用BCA试剂盒测定蛋白浓度。调整蛋白浓度,加入蛋白上样缓冲液后100 ℃变性5 min。经12.5%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,200 mA恒流转膜,室温封闭10 min,加入一抗4 ℃孵育过夜,放入TBST缓冲液中摇床3次,每次10 min;随后加入二抗室温避光孵育1 h,用TBST缓冲液洗3次。使用Odessey红外荧光扫描成像系统检测蛋白荧光强度。
1.5 流式细胞术检测细胞凋亡情况各组Huh7细胞处理48 h后,弃培养液,用PBS洗1次后加胰酶消化。终止消化后吹打成细胞悬液,1 000×g离心5 min,弃上清,加入PBS洗1次,1 000×g离心5 min,弃上清后加195 μL Annexin Ⅴ-FITC结合液重悬细胞,加入5 μL Annexin Ⅴ-FITC和10 μL碘化丙啶染色液,用流式细胞仪检测细胞凋亡情况。
1.6 细胞自噬小泡检测制作细胞爬片,48 h后弃培养液,用PBS洗2次,再用检测缓冲液洗2次后,加入100 μL荧光检测试剂,覆盖玻片,置37 ℃孵箱中孵育30 min,用检测缓冲液洗1次,加入4%多聚甲醛溶液固定30 min后用检测缓冲液洗3次。用抗荧光淬灭封片液封片后,通过荧光显微镜观察细胞自噬小体形成情况。
1.7 统计学处理应用GraphPad Prism 6软件进行数据分析和制图,分别采用两样本t检验、单因素方差分析和多因素方差分析比较组间差异,检验水准(α)为0.05。
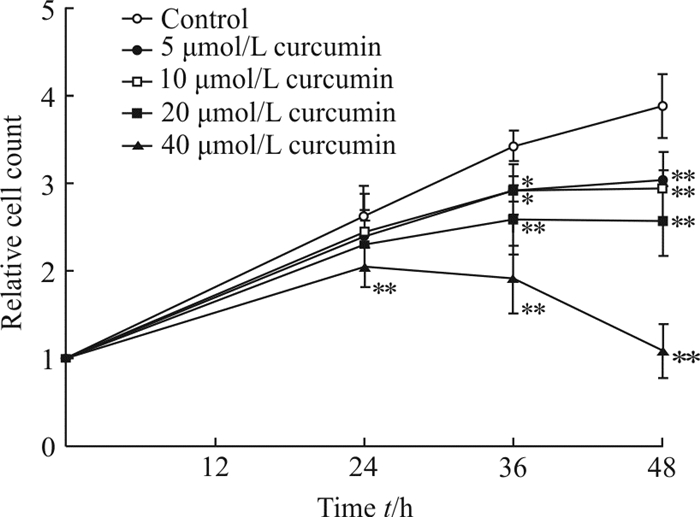
2 结果 2.1 姜黄素对Huh7细胞增殖的影响CCK-8检测结果显示5~40 μmol/L姜黄素能抑制Huh7细胞的增殖(P<0.05,P<0.01;图 1)。
|
图 1 CCK-8检测经姜黄素处理后Huh7细胞的增殖能力 Fig 1 Proliferation ability of Huh7 cells treated with curcumin measured by CCK-8 assay *P < 0.05, **P < 0.01 vs control group. n=5, x±s |
2.2 姜黄素对Huh7细胞凋亡的影响
流式细胞术检测结果显示,加入5~40 μmol/L姜黄素后,Huh7细胞的凋亡率增加(P<0.05,P<0.01),且细胞凋亡率随着姜黄素浓度的升高而上升(图 2),说明姜黄素能促进Huh7细胞凋亡。

|
图 2 流式细胞术检测经姜黄素处理后Huh7细胞凋亡情况 Fig 2 Apoptosis level of Huh7 cells treated with curcumin detected by flow cytometry FITC: Fluorescein isothiocyanate. *P < 0.05, **P < 0.01 vs control group; △△P < 0.01 vs 5 μmol/L or 10 μmol/L curcumin group. n=3, x±s |
2.3 姜黄素对Huh7细胞自噬的影响
蛋白质印迹检测结果显示,各姜黄素处理组LC3-Ⅱ/LC3-Ⅰ比值上升(P<0.05,P<0.01;图 3),说明姜黄素促进了细胞自噬蛋白的产生。荧光显微镜检测Huh7细胞内的自噬小体,发现20 μmol/L姜黄素处理组绿色荧光强度强于对照组,说明Huh7细胞内的自噬小体增多(图 4)。上述结果表明姜黄素能促进Huh7细胞的自噬。

|
图 3 蛋白质印迹法检测经姜黄素处理后Huh7细胞自噬相关蛋白的表达 Fig 3 Autophagy-related protein expression in Huh7 cells treated with curcumin by Western blotting LC3: Microtubule-associated protein 1 light chain 3; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. *P < 0.05, **P < 0.01 vs control group; △△P < 0.01 vs 5 μmol/L curcumin group; ▲P < 0.05 vs 10 μmol/L curcumin group. n=3, x±s |

|
图 4 荧光显微镜观察经姜黄素(20 μmol/L)处理后Huh7细胞自噬小体的形成 Fig 4 Autophagosome in Huh7 cells treated with curcumin (20 μmol/L) under fluorescence microscope DAPI: 4', 6-Diamidino-2-phenylindole. Original magnification: ×200 |
2.4 抑制自噬对姜黄素诱导Huh7细胞凋亡的影响
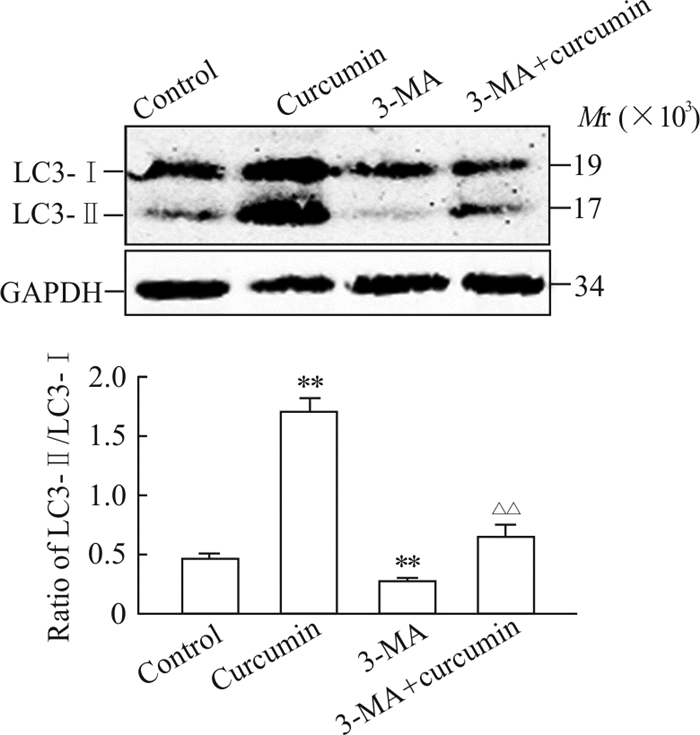
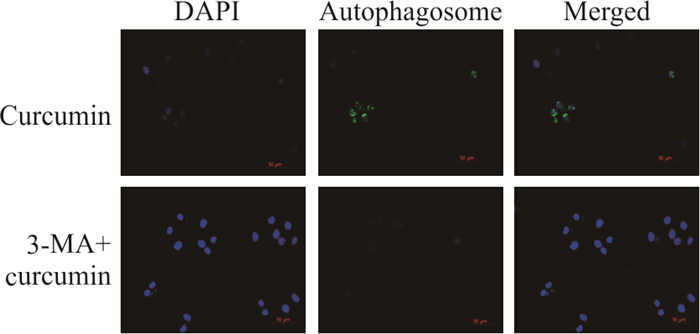
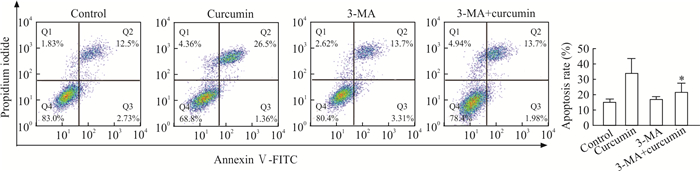
与只含20 μmol/L姜黄素组相比,3-MA和20 μmol/L姜黄素联合使用组LC3-Ⅱ/LC3-Ⅰ比值降低(P<0.01,图 5)、自噬小体减少(图 6),说明3-MA减弱了姜黄素对Huh7细胞的促进自噬作用。同时流式细胞术检测结果显示3-MA和20 μmol/L姜黄素联合使用组Huh7细胞凋亡率下降,与只加入20 μmol/L姜黄素组相比差异有统计学意义(P<0.05,图 7),说明自噬抑制剂3-MA能抑制姜黄素诱导的促Huh7细胞凋亡作用。
|
图 5 经3-MA和姜黄素(20 μmol/L)联合处理后Huh7细胞自噬相关蛋白表达的变化 Fig 5 Autophagy-related protein expression in Huh7 cells treated with 3-MA and curcumin (20 μmol/L) 3-MA: 3-Methyladenine; LC3: Microtubule-associated protein 1 light chain 3; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. **P < 0.01 vs control group; △△P < 0.01 vs curcumin group. n=3, x±s |
|
图 6 荧光显微镜下观察经3-MA和姜黄素(20 μmol/L)联合处理后Huh7细胞自噬小体的形成 Fig 6 Autophagosome in Huh7 cells treated with 3-MA and curcumin (20 μmol/L) under fluorescence microscope 3-MA: 3-Methyladenine; DAPI: 4', 6-Diamidino-2-phenylindole. Original magnification: ×200 |
|
图 7 流式细胞术检测经3-MA和姜黄素(20 μmol/L)联合处理后Huh7细胞的凋亡情况 Fig 7 Apoptosis level of Huh7 cells treated with 3-MA and curcumin (20 μmol/L) by flow cytometry 3-MA: 3-Methyladenine; FITC: Fluorescein isothiocyanate. *P < 0.05 vs curcumin group. n=4, x±s |
3 讨论
姜黄素是从姜黄根茎中提取的一种酚性色素,具有广谱抗肿瘤作用,能够诱导肿瘤细胞凋亡[7]。文献报道姜黄素及其衍生物能诱导肿瘤细胞自噬[8],但自噬在姜黄素诱导人肝癌细胞Huh7凋亡中起何种作用尚未得到清楚阐释。本研究发现,姜黄素能抑制人肝癌细胞系Huh7细胞的增殖并诱导其凋亡,随着姜黄素浓度的升高其作用效果越明显。姜黄素加入细胞48 h之后细胞自噬小泡增加,LC3-Ⅱ/LC3-Ⅰ比值增加,这都提示姜黄素能诱导Huh7细胞自噬;自噬抑制剂3-MA本身对Huh7细胞凋亡无明显影响,但能抑制姜黄素对Huh7细胞的诱导凋亡作用。
本研究结果表明姜黄素可能通过诱导细胞自噬促进Huh7细胞的凋亡,但其机制仍待进一步研究。目前认为自噬促进细胞凋亡可能的机制有以下几个方面:(1)自噬能选择性降低细胞凋亡中抑制分子的表达(如caveolin-1和Fap-1),从而促进细胞凋亡[6, 9];(2)自噬产物能形成类似于支架的结构,为细胞凋亡反应提供场所[10];(3)自噬相关分子的切割产物促进凋亡的发生,比如细胞凋亡与钙蛋白酶介导的Atg5切割相关,而Atg的切割产物能阻碍抗凋亡分子Bcl-xL发挥功能,从而触发细胞凋亡[11]。下一步我们将从分子水平探讨姜黄素诱导Huh7细胞自噬促进细胞凋亡的相关机制。
| [1] |
ATTWA M H, EL-ETREBY S A. Guide for diagnosis and treatment of hepatocellular carcinoma[J]. World J Hepatol, 2015, 7: 1632-1651. DOI:10.4254/wjh.v7.i12.1632 |
| [2] |
BOSE S, PANDA A K, MUKHERJEE S, SA G. Curcumin and tumor immune-editing: resurrecting the immune system[J/OL]. Cell Div, 2015, 10: 6. doi: 10.1186/s13008-015-0012-z.
|
| [3] |
LIU F, GAO S, YANG Y, ZHAO X, FAN Y, MA W, et al. Antitumor activity of curcumin by modulation of apoptosis and autophagy in human lung cancer A549 cells through inhibiting PI3K/Akt/mTOR pathway[J]. Oncol Rep, 2018, 39: 1523-1531. |
| [4] |
WHITE E. Deconvoluting the context-dependent role for autophagy in cancer[J]. Nat Rev Cancer, 2012, 12: 401-410. DOI:10.1038/nrc3262 |
| [5] |
XU D W, ZHANG G Q, WANG Z W, XU X Y, LIU T X. Autophagy in tumorigenesis and cancer treatment[J]. Asian Pac J Cancer Prev, 2015, 16: 2167-2175. DOI:10.7314/APJCP.2015.16.6.2167 |
| [6] |
DOHERTY J, BAEHRECKE E H. Life, death and autophagy[J]. Nat Cell Biol, 2018, 20: 1110-1117. |
| [7] |
KIM W K, PYEE Y, CHUNG H J, PARK H J, HONG J Y, SON K H, et al. Antitumor activity of spicatoside A by modulation of autophagy and apoptosis in human colorectal cancer cells[J]. J Nat Prod, 2016, 79: 1097-1104. DOI:10.1021/acs.jnatprod.6b00006 |
| [8] |
XIE W Y, ZHOU X D, YANG J, CHEN L X, RAN D H. Inhibition of autophagy enhances heat-induced apoptosis in human non-small cell lung cancer cells through ER stress pathways[J]. Arch Biochem Biophys, 2016, 607: 55-66. DOI:10.1016/j.abb.2016.08.016 |
| [9] |
GUMP J M, STASKIEWICZ L, MORGAN M J, BAMBERG A, RICHES D W, et al. Autophagy variation within a cell population determines cell fate through selective degradation of Fap-1[J]. Nat Cell Biol, 2014, 16: 47-54. DOI:10.1038/ncb2886 |
| [10] |
YOUNG M M, TAKAHASHI Y, KHAN O, PARK S, HORI T, YUN J, et al. Autophagosomal membrane serves as platform for intracellular death-inducing signaling complex (iDISC)-mediated caspase-8 activation and apoptosis[J]. J Biol Chem, 2012, 287: 12455-12468. DOI:10.1074/jbc.M111.309104 |
| [11] |
YOUSEFI S, PEROZZO R, SCHMID I, ZIEMIECKI A, SCHAFFNER T, SCAPOZZA L, et al. Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis[J]. Nat Cell Biol, 2006, 8: 1124-1132. DOI:10.1038/ncb1482 |
 2019, Vol. 40
2019, Vol. 40


