2. 广西医科大学基础医学院生理学教研室, 南宁 530021
2. Department of Physiology, School of Preclinical Medicine, Guangxi Medical University, Nanning 530021, Guangxi Zhuang Autonomous Region, China
原发性肝癌(primary liver cancer,以下简称肝癌)是全球发病率排名第6位的常见恶性肿瘤及第二大癌症相关死因[1]。目前,肝切除术是治疗肝癌首选且最有效的手段[2]。但是大多数肝癌患者存在慢性肝疾病,容易导致肝癌患者发生肝切除术后肝衰竭(post-hepatectomy liver failure,PHLF),这是肝切除术后围手术期死亡的主要原因,降低了肝切除术的安全性[3-4]。因此,术前如何准确地预测肝癌患者的肝功能至关重要。
目前,Child-Pugh评分是临床应用最广泛的术前评估肝功能储备的方法[2],为评估患者肝脏疾病的严重程度及肝功能是否适应手术治疗奠定了基础,但其存在明显的自身缺陷[5],最主要的是该评分在评估肝性脑病或腹水时具有较大的随意性和主观性[6],限制了其预测肝癌患者肝切除术后发生PHLF的准确性。为了弥补Child-Pugh评分的不足,Malinchoc等[7]提出了终末期肝病预后模型(model for end-stage liver disease,MELD),该模型已经成功应用于经颈静脉肝内门体分流术治疗的患者的短期病情预测、肝硬化患者行肝移植时供肝的分配和行手术治疗时的预后分析[8]。但MELD评分是针对终末期肝硬化患者设计的,此时患者大都失去了手术机会,且用于识别肝癌患者围手术期并发症及死亡率的风险仍存在不确定性[7]。近年来,Johnson等[9]提出了白蛋白-胆红素(albumin-bilirubin,ALBI)评分,在循证基础上提供了一个简单、客观的评估肝癌患者肝功能的模型,消除了肝性脑病和腹水对于肝功能评估的随意性和主观性。Kuo等[10]和Hiraoka等[11]的研究均表明ALBI评分预测肝癌患者长期生存时间的准确性明显高于Child-Pugh或MELD评分。我们前期研究证实ALBI评分预测肝癌患者肝切除术后发生PHLF的准确性优于Child-Pugh评分[12],但是ALBI评分不宜作为梗阻性黄疸患者评估肝功能的评判指标,而且不能有效地评估肝硬化对肝功能造成的损害。
因此,术前如何准确地预测伴有肝硬化的肝癌患者肝切除术后发生PHLF的风险仍然是一个难题。Wai等[13]提出了一个简单、客观、无创的预测肝纤维化和肝硬化的指标,即天冬氨酸转氨酶与血小板的比值指数(aspartate aminotransferase to platelet ratio index,APRI),并证实APRI评估肝纤维化和肝硬化的准确性与肝穿刺活组织检查一致。Shen等[14]及Cheng等[15]的研究进一步证实术前APRI与肝切除术后并发症的发生率呈正相关,可作为评估肝癌患者肝切除术后PHLF风险增加的指标。但目前对于术前APRI是否可以真实反映肝癌患者的肝功能尚未达成共识,仍需进一步研究。本研究将APRI与Child-Pugh评分、MELD评分及ALBI评分进行比较,探讨术前APRI预测肝癌患者肝切除术后发生PHLF风险的价值。
1 资料和方法 1.1 一般资料回顾性分析2013年9月至2016年12月在广西医科大学附属肿瘤医院接受首次肝切除术的1 108例肝癌患者的临床病理资料,所有患者术后病理均证实为肝癌(肝细胞癌1 044例,胆管细胞癌及混合性癌64例),并伴有不同程度的肝硬化。排除肝脏转移瘤患者,术前接受放射治疗、化学治疗或介入治疗的患者,以及接受复发手术及因全身性疾病不能耐受手术的患者。
1.2 手术方法及术后随访根据患者的一般状况、临床症状、肿瘤直径、肿瘤数目、肝脏储备功能及残余肝体积决定手术方式及切除范围。切除范围≥3个肝段定义为大范围肝切除,≤2个肝段定义为小范围肝切除[16]。具体手术方式包括肿瘤剜除、肝段切除、肝叶切除、半肝切除以及扩大半肝切除等[17]。出院后,患者于术后1个月开始随访,每3个月1次,第2年每3~6个月1次,随访指标包括血常规、肝功能、凝血功能、血清甲胎蛋白(α-fetoprotein,AFP)水平、腹部增强计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)等。根据患者一般状况、临床症状、肝脏储备功能、肿瘤侵犯程度等情况给予复发患者行肝切除术、经皮乙醇注射、射频消融、肝动脉化学栓塞或索拉非尼等治疗[18]。
1.3 观察指标与评估方法Child-Pugh评分包括血清胆红素、白蛋白、凝血酶原时间、腹水、肝性脑病5项指标,分别按照不同的程度进行评分,每项1~3分,分为3级:5~6分为A级,7~9分为B级,10~12分为C级[2];MELD评分根据文献[7]的公式计算,结果取整数[7];ALBI评分计算公式为:0.66×lg(总胆红素,μmol/L])-0.085×(白蛋白,g/L)[9];APRI计算公式为:[(天冬氨酸转氨酶/正常值上限)/(血小板计数,×109/L)]×100[13]。分别于术后第1、3、5、7天常规检测血常规、肝功能等指标,动态监测肝癌患者肝切除术后2周内相关并发症,并根据一般情况、临床症状及肝功能指标等来评估肝功能恢复情况。临床意义显著的门静脉高压(clinically significant portal hypertension,CSPH)通过内镜诊断伴有食管胃底静脉曲张或超声、CT等影像学检查证实有脾肿大(直径超过12 cm)与血常规检测血小板计数低于100×109/L来确定[19]。PHLF根据2011年国际肝脏外科学会(International Study Group of Liver Surgery,ISGLS)提出的标准定义进行判断,具体如下:在排除胆道梗阻的前提下,与术前的数值相比,若术后5 d或之后国际标准化比值升高同时伴有血清总胆红素水平升高,即可视为PHLF;A级PHLF患者无需特殊治疗,B级PHLF患者需非侵入性治疗,C级PHLF患者需要侵入性治疗[20]。
1.4 统计学处理采用SPSS 23.0软件(美国IBM公司)进行统计学分析。正态分布的连续资料以x±s表示,组间比较采用t检验;非正态分布的连续资料以中位数(下四分位数,上四分位数)表示,组间比较采用Mann-Whitney U检验;分类资料以频数表示,组间比较采用χ2检验。将单因素分析有统计学意义(P<0.05)的变量纳入多变量logistic回归模型,确定PHLF的独立预测因子。用受试者工作特征(receiver operating characteristic,ROC)曲线确定曲线下面积(area under curve,AUC),分别评估Child-Pugh评分、MELD评分、ALBI评分及APRI预测PHLF的能力,根据约登指数选择最佳截断值并计算其灵敏度和特异度。检验水准(α)为0.05。
2 结果 2.1 PHLF的发病率纳入的1 108例患者中,年龄≥60岁有233例(21.0%),年龄<60岁有875例(79.0%);男性939例(84.7%),女性169例(15.3%);乙型肝炎病毒(hepatitis B virus,HBV)阳性954例(86.1%),肝硬化438例(39.5%)。共有217例(19.6%)发生PHLF,其中A级PHLF有101例(9.1%),B级PHLF有109例(9.8%),C级PHLF有7例(0.6%)。纳入患者的基线资料见表 1。
|
|
表 1 1 108例原发性肝癌患者的基线资料及PHLF预测因子的单因素分析 Tab 1 Baseline data of 1 108 patients with primary liver carcinoma and univariable analysis to identify predictors of PHLF |
2.2 PHLF的相关因素分析
单因素分析结果见表 1。将单因素分析中有统计学意义(P<0.05)的指标纳入多变量logistic回归模型。为避免共线性,多因素分析采用不同的logistic回归模型对Child-Pugh评分、MELD评分、ALBI评分及APRI进行分析,结果见表 2。由表 2可见,男性、HBV DNA、肝硬化、肿瘤直径、肿瘤数目、术中出血、切除范围、Child-Pugh评分、MELD评分、ALBI评分及APRI等因素均与PHLF密切相关(P均<0.05)。其中Child-Pugh评分的比值比为1.599 [95%置信区间(confidence interval,CI):1.223~2.091,P=0.001],MELD评分的比值比为1.084(95% CI:1.035~1.136,P=0.001),ALBI评分的比值比为2.259(95% CI:1.385~3.683,P=0.001),APRI的比值比为1.932(95% CI:1.475~2.532,P<0.001),提示Child-Pugh评分、MELD评分、ALBI评分及APRI均可作为PHLF的独立预测指标。
|
|
表 2 多变量logistic回归分析识别PHLF预测因子 Tab 2 Multivariable logistic analysis identifying predictors of PHLF |
2.3 Child-Pugh评分、MELD评分、ALBI评分及APRI预测PHLF能力比较
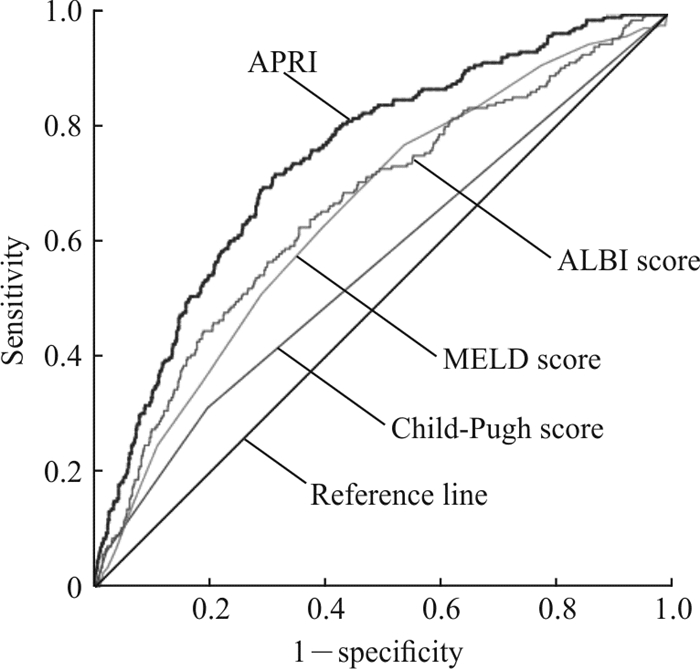
采用ROC曲线确定AUC,评估Child-Pugh评分、MELD评分、ALBI评分及APRI预测PHLF的能力。结果(图 1)显示,Child-Pugh评分的AUC为0.561(95% CI:0.516~0.605,P=0.005),MELD评分的AUC为0.650(95% CI:0.610~0.691,P<0.001),ALBI评分的AUC为0.662(95% CI:0.621~0.703,P<0.001),APRI的AUC为0.745(95% CI:0.709~0.781,P<0.001),可见APRI预测PHLF的能力优于Child-Pugh评分、MELD评分及ALBI评分。
|
图 1 术前Child-Pugh评分、MELD评分、ALBI评分及APRI预测PHLF的ROC曲线 Fig 1 ROC curves for preoperative Child-Pugh score, MELD score, ALBI score and APRI in predicting PHLF The AUC of Child-Pugh score was 0.561, AUC of MELD score was 0.650, AUC of ALBI score was 0.662, and AUC of APRI was 0.745. MELD: Model for end-stage liver disease; ALBI: Albumin-bilirubin; APRI: Aspartate aminotransferase to platelet ratio index; PHLF: Post-hepatectomy liver failure; ROC: Receiver operating characteristic; AUC: Area under curve |
2.4 APRI与PHLF之间的关系
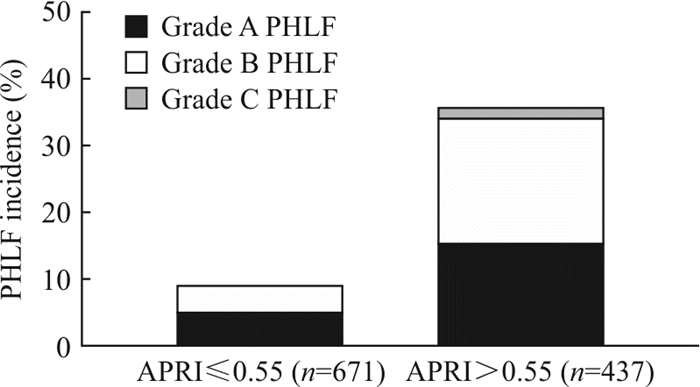
根据约登指数,APRI的最佳截断值为0.55,此时APRI预测PHLF的灵敏度与特异度分别为71.9%和68.5%。依据APRI的最佳截断值,将1 108例患者分为高风险组(APRI>0.55,437例)和低风险组(APRI≤0.55,671例),结果显示,高风险组PHLF总体发病率及PHLF A、B、C各等级的发病率分别为35.7%(156/437)、15.3%(67/437)、18.8%(82/437)、1.6%(7/437),低风险组分别为9.1%(61/671)、5.1%(34/671)、4.0%(27/671)、0%(0/671),两组间差异均有统计学意义(P均<0.05,图 2)。
|
图 2 术前APRI与PHLF之间的关系 Fig 2 Correlation between preoperative APRI and PHLF APRI: Aspartate aminotransferase-to-platelet ratio index; PHLF: Post-hepatectomy liver failure |
3 讨论
肝切除术是目前治疗肝癌的首选而且最有效的方法[2]。PHLF是肝癌患者肝切除术后围手术期死亡的主要原因,降低了肝切除术的安全性[3]。大多数肝癌患者存在慢性肝疾病,如乙型肝炎、丙型肝炎、酒精性肝病、非酒精性脂肪肝等,研究证实约80%~90%的肝癌患者存在着不同程度的肝硬化[7],是限制肝脏再生能力而导致PHLF最重要的因素之一。伴有肝硬化的肝癌患者行肝切除术后极易发生顽固性腹水、门静脉高压、肝性脑病、肝衰竭等并发症,这与肝细胞生长因子水平降低、转录因子受损和DNA合成减少导致的再生肝脏体积减少相关[21],进而很大程度上增加了PHLF的死亡风险。因此,术前对伴有肝硬化的肝癌患者的肝功能进行准确的评估十分重要。
肝穿刺活组织检查是确诊肝纤维化或肝硬化及其严重程度的金标准[22],但是肝穿刺属于有创操作,且存在取材不准,术中、术后出血及术后疼痛等风险。术前采用准确、客观、无创的评估方法来预测伴有肝硬化的肝癌患者术后发生PHLF的风险至关重要。Wai等[13]于2003年提出APRI这一指标,并证实APRI评估肝纤维化和肝硬化的准确性与肝穿刺活组织检查一致。研究认为APRI可作为诊断肝纤维化和肝硬化的一个简单、客观、无创的替代肝穿刺活组织检查的指标[23]。在肝纤维化及肝硬化进程中,天冬氨酸转氨酶与血小板存在着相反的变化趋势,线粒体的损伤会导致天冬氨酸转氨酶释放增加及清除减少,出现血清天冬氨酸转氨酶显著上升[24];同时肝硬化和门静脉高压恶化导致脾功能亢进,使血小板破坏增多,血小板明显下降。因此,随着肝纤维化严重程度的进展APRI有增大的趋势。近年来APRI被用于术前预测PHLF,Ichikawa等[25]的研究表明当APRI>10时肝癌患者存在较高的PHLF风险;Shen等[14]及Cheng等[15]的研究进一步证实术前APRI与术后并发症的发生率呈正相关,可作为评估肝癌患者PHLF风险的指标。
本研究通过单因素分析和多变量logistic回归分析表明,术前APRI可作为肝癌患者肝切除术后发生PHLF的独立预测指标;通过ROC曲线分析发现,术前APRI预测PHLF的能力明显优于Child-Pugh评分、MELD评分及ALBI评分;此外,根据约登指数得到术前APRI的最佳截断值为0.55,此时APRI预测PHLF的灵敏度和特异度分别为71.9%和68.5%;根据最佳截断值将患者分为高风险组(APRI>0.55)和低风险组(APRI≤0.55),高风险组PHLF总体发病率及PHLF A、B、C不同分级的发病率均高于低风险组(P均<0.05)。
本研究也存在局限性。首先,本研究入选的研究对象大部分为HBV相关的肝癌患者,需要进一步拓展在其他慢性肝病背景病因人群中的研究;其次,本研究采用的是回顾性研究,只是初步发现术前APRI可作为客观、快速的预测PHLF的指标,仍需扩大样本量及采用前瞻性研究,以进一步证实术前APRI对PHLF的预测价值。
综上所述,本研究显示术前APRI预测肝癌患者肝切除术后PHLF的效能优于Child-Pugh评分、MELD评分及ALBI评分。作为一个简便、无创、可靠的指标,术前APRI对于预测肝癌患者肝切除术后发生PHLF及提高手术安全性和肝癌患者预后有积极的意义。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67: 7-30. DOI:10.3322/caac.21387 |
| [2] |
European Association for the Study of the Liver. EASL clinical practice guidelines:management of hepatocellular carcinoma[J]. J Hepatol, 2018, 69: 182-236. DOI:10.1016/j.jhep.2018.03.019 |
| [3] |
MCCORMACK L, PETROWSKY H, JOCHUM W, FURRER K, CLAVIEN P A. Hepatic steatosis is a risk factor for postoperative complications after major hepatectomy:a matched case-control study[J]. Ann Surg, 2007, 245: 923-930. DOI:10.1097/01.sla.0000251747.80025.b7 |
| [4] |
SHIHA G, IBRAHIM A, HELMY A, SARIN S K, OMATA M, KUMAR A, et al. Asian-Pacific Association for the Study of the Liver (APASL) consensus guidelines on invasive and non-invasive assessment of hepatic fibrosis:a 2016 update[J]. Hepatol Int, 2017, 11: 1-30. |
| [5] |
DURAND F, VALLA D. Assessment of the prognosis of cirrhosis:Child-Pugh versus MELD[J]. J Hepatol, 2005, 42(Suppl 1): S100-S107. |
| [6] |
WIESNER R, EDWARDS E, FREEMAN R, HARPER A, KIM R, KAMATH P, et al. Model for end-stage liver disease (MELD) and allocation of donor livers[J]. Gastroenterology, 2003, 124: 91-96. DOI:10.1053/gast.2003.50016 |
| [7] |
MALINCHOC M, KAMATH P S, GORDON F D, PEINE C J, RANK J, TER BORG P C. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts[J]. Hepatology, 2000, 31: 864-871. DOI:10.1053/he.2000.5852 |
| [8] |
BROWN R S Jr, LAKE J R. The survival impact of liver transplantation in the MELD era, and the future for organ allocation and distribution[J]. Am J Transplant, 2005, 5: 203-204. DOI:10.1111/ajt.2005.5.issue-2 |
| [9] |
JOHNSON P J, BERHANE S, KAGEBAYASHI C, SATOMURA S, TENG M, REEVES H L, et al. Assessment of liver function in patients with hepatocellular carcinoma:a new evidence-based approach-the ALBI grade[J]. J Clin Oncol, 2015, 33: 550-558. DOI:10.1200/JCO.2014.57.9151 |
| [10] |
KUO Y H, WANG J H, HUNG C H, RAU K M, WU I P, CHEN C H, et al. Albumin-bilirubin grade predicts prognosis of HCC patients with sorafenib use[J]. J Gastroenterol Hepatol, 2017, 32: 1975-1981. DOI:10.1111/jgh.13783 |
| [11] |
HIRAOKA A, KUMADA T, MICHITAKA K, TOYODA H, TADA T, UEKI H, et al. Usefulness of albuminbilirubin grade for evaluation of prognosis of 2584 Japanese patients with hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2016, 31: 1031-1036. DOI:10.1111/jgh.13250 |
| [12] |
WANG Y Y, ZHONG J H, SU Z Y, HUANG J F, LU S D, XIANG B D, et al. Albumin-bilirubin versus Child-Pugh score as a predictor of outcome after liver resection for hepatocellular carcinoma[J]. Br J Surg, 2016, 103: 725-734. DOI:10.1002/bjs.2016.103.issue-6 |
| [13] |
WAI C T, GREENSON J K, FONTANA R J, KALBFLEISCH J D, MARRERO J A, CONJEEVARAM H S, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C[J]. Hepatology, 2003, 38: 518-526. |
| [14] |
SHEN S L, FU S J, CHEN B, KUANG M, LI S Q, HUA Y P, et al. Preoperative aspartate aminotransferase to platelet ratio is an independent prognostic factor for hepatitis B-induced hepatocellular carcinoma after hepatic resection[J]. Ann Surg Oncol, 2014, 21: 3802-3809. DOI:10.1245/s10434-014-3771-x |
| [15] |
CHENG J, ZHAO P, LIU J, LIU X, WU X. Preoperative aspartate aminotransferase-to-platelet ratio index (APRI) is a predictor on postoperative outcomes of hepatocellular carcinoma[J/OL]. Medicine (Baltimore), 2016, 95: e5486. doi: 10.1097/MD.0000000000005486.
|
| [16] |
POL B, CAMPAN P, HARDWIGSEN J, BOTTI G, PONS J, LE TREUT Y P. Morbidity of major hepatic resections:a 100-case prospective study[J]. Eur J Surg, 1999, 165: 446-453. DOI:10.1080/110241599750006686 |
| [17] |
麦荣云, 叶甲舟, 曾洁, 施显茂, 龙中荣, 刘劲梧, 等. 血清前白蛋白-胆红素评分预测乙肝相关性肝细胞癌肝切除术后肝衰竭的价值[J]. 中华肝胆外科杂志, 2018, 24: 737-741. DOI:10.3760/cma.j.issn.1007-8118.2018.11.003 |
| [18] |
麦荣云, 叶甲舟, 王言焱, 白涛, 陈洁, 黄山, 等. ALBI联合APRI对HBV相关肝细胞癌肝切除术后肝衰竭发生的预测价值[J]. 临床肝胆病杂志, 2018, 34: 292-297. DOI:10.3969/j.issn.1001-5256.2018.02.015 |
| [19] |
BERZIGOTTI A, REIG M, ABRALDES J G, BOSCH J, BRUIX J. Portal hypertension and the outcome of surgery for hepatocellular carcinoma in compensated cirrhosis:a systematic review and meta-analysis[J]. Hepatology, 2015, 61: 526-536. DOI:10.1002/hep.27431 |
| [20] |
RAHBARI N N, GARDEN O J, PADBURY R, BROOKE-SMITH M, CRAWFORD M, ADAM R, et al. Posthepatectomy liver failure:a definition and grading by the International Study Group of Liver Surgery (ISGLS)[J]. Surgery, 2011, 149: 713-724. DOI:10.1016/j.surg.2010.10.001 |
| [21] |
SHIRABE K, SHIMADA M, GION T, HASEGAWA H, TAKENAKA K, UTSUNOMIYA T, et al. Postoperative liver failure after major hepatic resection for hepatocellular carcinoma in the modern era with special reference to remnant liver volume[J]. J Am Coll Surg, 1999, 188: 304-309. DOI:10.1016/S1072-7515(98)00301-9 |
| [22] |
DIENSTAG J L. The role of liver biopsy in chronic hepatitis C[J]. Hepatology, 2002, 36(5 Suppl 1): S152-S160. |
| [23] |
LOAEZA-DEL-CASTILLO A, PAZ-PINEDA F, OVIEDO-CÁRDENAS E, SÁNCHEZ-AVILA F, VARGAS-VORÁCKOVÁ F. AST to platelet ratio index (APRI) for the noninvasive evaluation of liver fibrosis[J]. Ann Hepatol, 2008, 7: 350-357. |
| [24] |
SOOKOIAN S, CASTAÑO G O, SCIAN R, FERNÁNDEZ GIANOTTI T, DOPAZO H, ROHR C, et al. Serum aminotransferases in nonalcoholic fatty liver disease are a signature of liver metabolic perturbations at the amino acid and Krebs cycle level[J]. Am J Clin Nutr, 2016, 103: 422-434. DOI:10.3945/ajcn.115.118695 |
| [25] |
ICHIKAWA T, UENISHI T, TAKEMURA S, OBA K, OGAWA M, KODAI S, et al. A simple, noninvasively determined index predicting hepatic failure following liver resection for hepatocellular carcinoma[J]. J Hepatobiliary Pancreat Surg, 2009, 16: 42-48. DOI:10.1007/s00534-008-0003-4 |
 2019, Vol. 40
2019, Vol. 40


