2. 海军军医大学(第二军医大学)长海医院脑血管病中心, 上海 200433
2. Stroke Center, Changhai Hospital, Navy Medical University(Second Military Medical University), Shanghai 200433, China
目前,脑卒中已经成为我国国民死亡的首位原因,其发病率以每年8.7%的速度增长[1-2]。急性缺血性脑卒中(acute ischemic stroke,AIS)约占所有脑卒中的70%,我国每年新发AIS患者超过200万[2-3]。尽管不同病因AIS的血管狭窄程度可能相似,但因病理生理变化不同其对治疗(机械取栓及静脉溶栓等)的反应可能不同[4]。因此,准确、及时的病因判断是制定个体化血流重建策略的前提条件。
传统的AIS病因判断主要基于急性脑卒中Org 10172治疗试验(Trial of Org 10172 in Acute Stroke Treatment,TOAST)分型,对急诊AIS患者并不适用[5]。大动脉粥样硬化和心源性栓塞是AIS最常见的两大病因,探究AIS特征差异对AIS病因的判断具有指导意义。在众多影像学检查设备及技术中,多模态计算机断层扫描(computed tomography,CT)目前已被国内外多家卒中中心用于AIS患者的术前筛查及评估。一站式多模态CT检查结合第三方软件的定量分析,能够快速、准确地评估AIS患者的脑组织及脑血管改变[6]。本研究基于多模态CT检查对AIS患者脑组织改变进行量化分析,评估大动脉粥样硬化与心源性栓塞AIS患者的特征差异,以指导临床并制定精准治疗方案。
1 资料和方法 1.1 一般资料回顾性纳入2016年10月至2018年6月于我院急诊入院治疗,入院后、治疗前均行多模态CT检查且CT图像质量可用于诊断的AIS患者99例,包括大动脉粥样硬化AIS患者46例,心源性栓塞AIS患者53例。所有患者入院时均行美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分及格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分。本研究通过我院医学伦理委员会审批。
1.2 影像学检查多模态CT检查,包括CT平扫、计算机断层扫描血管成像(computed tomography angiography,CTA)、计算机断层扫描灌注成像(computed tomography perfusion,CTP)检查,均采用256层CT仪(Brilliance iCT Elite FHD;Philips Healthcare)。CT平扫:管电压为120 kV,管电流为350 mAs,层厚为5 mm。CTP检查:采用JOG模式,管电压为80 kV,管电流为180 mAs,共15个循环,每个循环扫描时间为0.33 s,间隔时间为4 s,层厚为5 mm,扫描范围为128 mm,视野(field of view,FOV)为220 mm×220 mm;经肘静脉置入留置针(20 G),使用双筒高压注射器推注非离子型造影剂碘必乐(370 mg I/mL)50 mL,注射速率为5 mL/s,随后以相同速率推注20 mL 0.5%氯化钠注射液冲管。CTA检查:CTP扫描结束后立即再推注非离子型造影剂碘必乐(370 mg I/mL)45 mL,注射速率为5 mL/s,随后以相同速率推注20 mL 0.5%氯化钠注射液冲管,使用自动触发技术扫描,管电压为120 kV,管电流为300 mAs,层厚为1 mm。
1.3 图像后处理CT平扫图像经设备后台自动重建获得,层厚为5 mm、层间距为5 mm,用于排除脑出血及初步评估后循环血管闭塞率(后循环血管闭塞AIS患者例数/AIS患者总例数)。CTP原始数据经重建后自动传输至RAPID软件(iSchemaView,Menlo Park,CA)进行量化分析,得出脑血流量(cerebral blood flow,CBF)<30%及达峰时间(time to maximun,Tmax)>6 s的脑组织体积(mL);其中CBF<30%的脑组织区域判定为梗死核心区,Tmax>6 s为缺血低灌注区,而CBF<30%与Tmax>6 s之间不匹配的区域(mismatch volume)为缺血半暗带。CTA图像后处理采用256层CT仪配套的Philips软件进行重建,层厚为1 mm、层间距为1 mm;重建图像传输到Philips工作站进行后处理,得到容积再现(volume render,VR)及最大密度投影(maximum intensity projection,MIP)图像,用于分析颅内大动脉包括颈内动脉颅外段和颅内段、椎动脉V1~V4段、基底动脉、大脑后动脉P1段、大脑前动脉A1段及大脑中动脉M1和M2段的狭窄或闭塞情况,计算患者颅内大动脉闭塞率(颅内大血管闭塞AIS患者例数/ AIS患者总例数)。
1.4 统计学处理采用SPSS 19.0软件进行数据分析。呈正态分布的计量资料以x±s表示,组间比较采用t检验;呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用Mann-Whitney U检验;计数资料以例数和百分数表示,组间比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 一般资料共纳入AIS患者99例,男57例,女42例;年龄为42~83岁,平均为(66.6±10.8)岁;所有患者均有肢体活动障碍和(或)语言功能障碍。大动脉粥样硬化组46例,其中男32例、女14例,平均年龄为(65.6±8.6)岁;心源性栓塞组53例,其中男25例、女28例,平均年龄为(67.4±12.4)岁;两组患者的性别、年龄差异均无统计学意义(χ2=0.071,P=0.789;t=-0.84,P=0.404)。
2.2 临床评分大动脉粥样硬化组和心源性栓塞组AIS患者入院时NHISS评分分别为9.5(2.0,16.0)分和15.0(6.0,24.0)分,入院时GCS评分分别为(13.52±2.69)分和(11.60±3.31)分,两组差异均有统计学意义(Z=2.31,P<0.001;t=1.04,P=0.002)。
2.3 多模态CT检查结果CT平扫检查显示,前循环大血管闭塞AIS患者77例(大动脉粥样硬化29例,心源性栓塞48例),后循环血管闭塞AIS患者22例(大动脉粥样硬化17例,心源性栓塞5例);大动脉粥样硬化组后循环血管闭塞率为36.96%(17/46),心源性栓塞组后循环血管闭塞率为9.43%(5/53),两组差异有统计学意义(χ2=6.77,P<0.001)。
与大动脉粥样硬化组比较,心源性栓塞组AIS患者的梗死核心区和缺血半暗带体积均较大[1(0,22)mL vs 0(0,1)mL,Z=3.85,P<0.001;64(30,126)mL vs 10(0,70)mL,Z=3.43,P<0.001]。但大动脉粥样硬化组和心源性栓塞组AIS患者缺血半暗带与梗死核心区体积的差值分别为10(0,64)和46(4,103)mL,两组差异无统计学意义(Z=1.92,P>0.05)。
CTA检查结果显示,大动脉粥样硬化组和心源性栓塞组AIS患者颅内大动脉闭塞率分别为30.43%(14/46)和50.94%(27/53),两组差异有统计学意义(χ2=11.82,P<0.001)。大动脉粥样硬化AIS典型病例影像学特征见图 1,心源性栓塞AIS典型病例影像学特征见图 2。
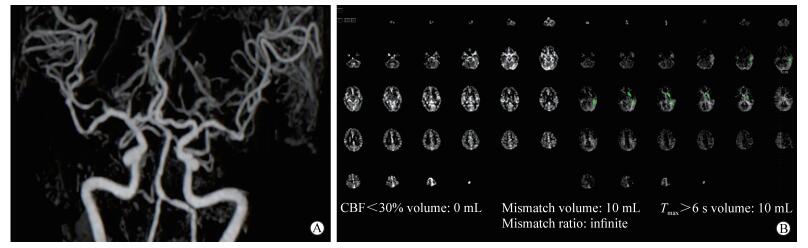
|
图 1 大动脉粥样硬化AIS患者的CTA及CTP图像 Fig 1 CTA and CTP images of AIS patient with large artery atherosclerosis Male, 68 years, paroxysmal right limb weakness for 1 d. The NIHSS score was 22 and GCS score was 7 on admission. A: CTA examination showed that M1 segments of bilateral middle cerebral artery had stenosis; B: CTP examination showed that the volumes of infraction core (CBF < 30% volume) and ischemic penumbra were 0 mL and 10 mL, respectively. AIS: Acute ischemic stroke; CTA: Computed tomography angiography; CTP: Computed tomography perfusion; NIHSS: National Institutes of Health stroke scale; GCS: Glasgow coma scale; CBF: Cerebral blood flow; Tmax: Time to maximum |
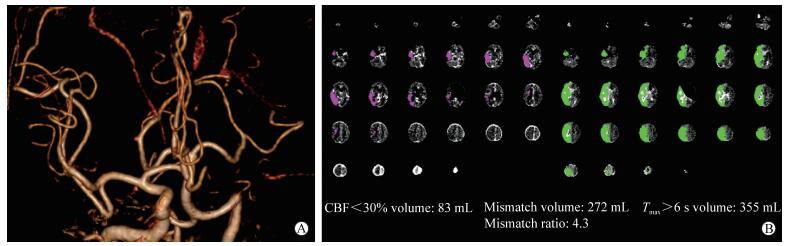
|
图 2 心源性栓塞AIS患者的CTA及CTP图像 Fig 2 CTA and CTP images of AIS patient with cardioembolism Male, 75 years, sudden right limb weakness. The NIHSS score was 11 and GCS score was 13 on admission. A: CTA examination showed that left internal carotid artery and middle cerebral artery were occluded; B: CTP examination showed that the volumes of infraction core (CBF < 30% volume) and ischemic penumbra were 83 mL and 272 mL, respectively. AIS: Acute ischemic stroke; CTA: Computed tomography angiography; CTP: Computed tomography perfusion; NIHSS: National Institutes of Health stroke scale; GCS: Glasgow coma scale; CBF: Cerebral blood flow; Tmax: Time to maximum |
3 讨论
大动脉粥样硬化和心源性栓塞是AIS的常见病因,约占所有AIS患者的50%[7]。AIS病因学分析不仅可以影响血管狭窄或闭塞后侧支循环形成及治疗效果,还对临床治疗方案的选择如再通后是否行抗血小板治疗等至关重要[4]。本研究通过分析大动脉粥样硬化与心源性栓塞AIS患者的临床与影像学数据,评估两种常见病因AIS患者的临床特征、脑组织缺血状态及颅内大血管闭塞情况,并探讨其差异,从而快速指导临床判别AIS患者病因和制定精准治疗方案。
NIHSS评分和GCS评分是临床评估AIS患者神经功能损伤程度的常用的有效工具。Fischer等[8]通过对超早期缺血性脑卒中患者行数字减影血管造影(digital subtraction angiography,DSA)检查以及NIHSS评分,发现NIHSS评分与颅内动脉狭窄有关。本研究结果显示,与大动脉粥样硬化AIS比较,心源性栓塞AIS患者入院时NIHSS评分更高,GCS评分更低,提示心源性栓塞AIS患者的神经功能受损程度更严重。研究表明大动脉粥样硬化AIS侧支循环较丰富,原因可能是大动脉粥样硬化AIS血管狭窄、闭塞的速度相对缓慢,因此具有足够的时间开放及形成侧支循环[9]。本研究发现心源性栓塞AIS患者颅内大动脉闭塞率更高,原因同样可能与血管狭窄、闭塞的速度有关,心源性栓塞AIS血管狭窄、闭塞的速度较快,导致其大动脉闭塞率更高。另外,本研究结果显示与大动脉粥样硬化AIS比较,心源性栓塞AIS不易累及后循环,其原因可能是前循环血流量更大,心源性栓子更易进入。
缺血半暗带和梗死核心区是评价AIS患者脑组织缺血的重要指标。Kim等[9]采用磁共振成像(magnetic resonance imaging,MRI)分析大动脉粥样硬化与心源性栓塞AIS患者灌注模式的差异,结果发现与心源性栓塞AIS比较,尽管大动脉粥样硬化AIS缺血半暗带的绝对脑组织体积差异并无统计学意义,但灌注加权成像与弥散加权成像不匹配区体积的比值(灌注加权成像Tmax≥2 s的脑组织体积/弥散加权成像异常的脑组织体积)较高。本研究发现,心源性栓塞AIS患者的缺血半暗带和梗死核心区体积均大于大动脉粥样硬化AIS,但二者差值的差异并无统计学意义,与Kim等[9]的研究结果不一致,原因可能是由纳入病例偏倚等原因所致。尽管各研究结果不一致,但均表明大动脉粥样硬化与心源性栓塞AIS的梗死特征存在差异,基于多中心随机对照数据的不同病因AIS梗死特征差异有待进一步研究。
AIS梗死核心区的范围可用于评估血管内治疗的风险,缺血半暗带的范围可以预测患者预后,临床上通常将最小绝对错配比作为血管内治疗的纳入标准,以帮助临床决策是否进行血管内治疗[10]。本研究中缺血半暗带和梗死核心区体积的差值差异无统计学意义,提示AIS病因学的区分对于血管内治疗可能并无指导意义。然而研究表明,静脉溶栓和机械取栓治疗大动脉粥样硬化AIS的疗效均较心源性栓塞AIS差,原因可能是大动脉粥样硬化AIS出现临床症状主要是因为斑块表面原位血栓形成阻塞血管,尽管临床治疗可以改善血栓局部狭窄使其再通,但慢性斑块存在导致其残余狭窄及再闭塞率增加,从而影响疗效[11-12]。
目前多数医院采用CT检查对AIS患者进行评估,主要是由于MRI扫描时间长,对于AIS患者并不适用。即使能够急诊开展MRI检查且采用快速扫描序列(6 min内完成扫描),仍有14%~30%的患者因金属植入物等原因无法行MRI检查;并且文献报道采用MRI检查AIS患者的中位入院至静脉溶栓时间难以缩短到60 min内[13]。除时间因素外,对于AIS尤其是大血管闭塞AIS患者,术前影像学评估的目的除了排除出血性病变外,还需要识别闭塞血管部位以及通过直接或间接征象评估梗死核心区、缺血半暗带和侧支循环,从而选择通过机械取栓可能获得良好预后的患者[14]。
多模态CT检查结合快速图像重建及自动化的图像分析软件能够快速得出CT平扫、CTA及CTP数据[15]。CT平扫可以排除脑出血,并发现脑组织缺血及大血管闭塞的早期征象,例如灰白质分界消失、大脑动脉高密度征等。CTA有助于明确AIS的责任血管,显示大血管闭塞,评估侧支循环,并且能够为血管内治疗提供路径信息等。CTP能评估脑血流储备、梗死核心区、缺血半暗带(可挽救的脑组织)、侧支循环等,为静脉溶栓、桥接或动脉内机械取栓、辅助支架治疗等手段提供循证依据。本研究采用的RAPID软件目前已被应用于多家国际卒中中心,RAPID软件分析可以得到不同界值脑血容量、CBF及Tmax对应的脑组织体积(mL),使脑组织血流灌注结果得以量化,从而更加精准地评估脑组织缺血状态[16]。
本研究仍存在不足。首先,本研究为单中心研究,且样本量有限。其次,尽管大动脉粥样硬化及心源性栓塞是AIS的主要病因,但根据TOAST分型,还有小动脉闭塞、其他原因及不明原因的AIS,纳入各种病因AIS患者的临床和影像学特征差异分析有待进一步研究,从而更全面评估AIS缺血状态,以指导临床治疗方案的选择。
| [1] |
ZHOU M, WANG H, ZHU J, CHEN W, WANG L, LIU S, et al. Cause-specific mortality for 240 causes in China during 1990-2013:a systematic subnational analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2016, 387: 251-272. DOI:10.1016/S0140-6736(15)00551-6 |
| [2] |
WANG W, JIANG B, SUN H, RU X, SUN D, WANG L, et al. Prevalence, incidence, and mortality of stroke in China:results from a nationwide population-based survey of 480687 adults[J]. Circulation, 2017, 135: 759-771. DOI:10.1161/CIRCULATIONAHA.116.025250 |
| [3] |
高峰, 徐安定. 急性缺血性卒中血管内治疗中国指南2015[J]. 中国卒中杂志, 2015, 10: 590-606. |
| [4] |
TIAN C, CAO X, WANG J. Recanalisation therapy in patients with acute ischaemic stroke caused by large artery occlusion:choice of therapeutic strategy according to underlying aetiological mechanism?[J]. Stroke Vasc Neurol, 2017, 2: 244-250. DOI:10.1136/svn-2017-000090 |
| [5] |
SPOSATO L A, CIPRIANO L E, SAPOSNIK G, RUÍZ VARGAS E, RICCIO P M, HACHINSKI V. Diagnosis of atrial fibrillation after stroke and transient ischaemic attack:a systematic review and meta-analysis[J]. Lancet Neurol, 2015, 14: 377-387. DOI:10.1016/S1474-4422(15)70027-X |
| [6] |
NAEL K, KHAN R, CHOUDHARY G, MESHKSAR A, VILLABLANCA P, TAY J, et al. Six-minute magnetic resonance imaging protocol for evaluation of acute ischemic stroke:pushing the boundaries[J]. Stroke, 2014, 45: 1985-1991. DOI:10.1161/STROKEAHA.114.005305 |
| [7] |
ADAMS H P JR, BENDIXEN B H, KAPPELLE L J, BILLER J, LOVE B B, GORDON D L, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment[J]. Stroke, 1993, 24: 35-41. DOI:10.1161/01.STR.24.1.35 |
| [8] |
FISCHER U, ARNOLD M, NEDELTCHEV K, BREKENFELD C, BALLINARI P, REMONDA L, et al. NIHSS score and arteriographic findings in acute ischemic stroke[J]. Stroke, 2005, 36: 2121-2125. DOI:10.1161/01.STR.0000182099.04994.fc |
| [9] |
KIM H J, YUN S C, CHO K H, CHO A H, KWON S U, KIM J S, et al. Differential patterns of evolution in acute middle cerebral artery infarction with perfusion-diffusion mismatch:atherosclerotic vs. cardioembolic occlusion[J]. J Neurol Sci, 2008, 273(1/2): 93-98. |
| [10] |
CAMPBELL B C, MITCHELL P J, KLEINIG T J, DEWEY H M, CHURILOV L, YASSI N, et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection[J]. N Engl J Med, 2015, 372: 1009-1018. DOI:10.1056/NEJMoa1414792 |
| [11] |
MOLINA C A, MONTANER J, ARENILLAS J F, RIBO M, RUBIERA M, ALVAREZ-SABÍN J. Differential pattern of tissue plasminogen activator-induced proximal middle cerebral artery recanalization among stroke subtypes[J]. Stroke, 2004, 35: 486-490. DOI:10.1161/01.STR.0000110219.67054.BF |
| [12] |
FORLIVESI S, BOVI P, TOMELLERI G, MICHELETTI N, CARLETTI M, MORETTO G, et al. Stroke etiologic subtype may influence the rate of hyperdense middle cerebral artery sign disappearance after intravenous thrombolysis[J]. J Thromb Thrombolysis, 2017, 43: 86-90. DOI:10.1007/s11239-016-1404-x |
| [13] |
SHAH S, LUBY M, POOLE K, MORELLA T, KELLER E, BENSON R T, et al. Screening with MRI for Accurate and Rapid Stroke Treatment:SMART[J]. Neurology, 2015, 84: 2438-2444. DOI:10.1212/WNL.0000000000001678 |
| [14] |
中国卒中学会, 中国卒中学会神经介入分会, 中华预防医学会卒中预防与控制专业委员会介入学组. 急性缺血性卒中血管内治疗影像评估中国专家共识[J]. 中国卒中杂志, 2017, 12: 1041-1056. DOI:10.3969/j.issn.1673-5765.2017.11.014 |
| [15] |
CAMPBELL B C, PARSONS M W. Imaging selection for acute stroke intervention[J]. Int J Stroke, 2018, 13: 554-567. DOI:10.1177/1747493018765235 |
| [16] |
ALBERS G W, GOYAL M, JAHAN R, BONAFE A, DIENER H C, LEVY E I, et al. Ischemic core and hypoperfusion volumes predict infarct size in SWIFT PRIME[J]. Ann Neurol, 2016, 79: 76-89. DOI:10.1002/ana.24543 |
 2018, Vol. 39
2018, Vol. 39


