集束化管理,也称集束化治疗或捆绑式治疗,指将一系列有循证医学证据的治疗及护理措施集合,以治疗某种危重或难治性的疾病,从而协助医护人员为患者提供最优化的处理[1]。脑卒中是神经科的急危重症,其致残、致死率高。急性缺血性脑卒中约占所有脑卒中的70%[2],静脉溶栓是该疾病有效的治疗手段,但出血转化是静脉溶栓治疗最严重的并发症[3]。血压变异是一段时间内血压的波动幅度,研究表明,血压连续变异是影响急性缺血性脑卒中静脉溶栓治疗后出血转化及预后不良的独立危险因素,且血压变异越大,静脉溶栓治疗后72 h内出血转化的风险越高[4];此外,血压变异还与早期神经功能恶化和死亡以及90 d预后不良有关[5]。
我院脑血管病中心为提高急性缺血性脑卒中救治效率,不断改进超早期血管再通治疗的流程,并构建静脉溶栓治疗血压集束化管理方案。本研究旨在比较急性缺血性脑卒中重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)静脉溶栓治疗后血压集束化管理对患者血压变异、出血转化及预后的影响。
1 资料和方法 1.1 研究对象连续收集2015年10月1日至2018年3月31日在我院脑血管病中心接受单纯静脉溶栓治疗的急性缺血性脑卒中患者311例。其中2015年10月1日至2016年9月30日静脉溶栓后未接受血压集束化管理的患者130例(对照组),2016年10月1日至2018年3月31日静脉溶栓后接受血压集束化管理的患者181例(集束化组)。纳入标准:(1)年龄≥18岁;(2)患者发病4.5 h内,其中80岁及80岁以上患者发病3 h内;(3)临床诊断缺血性脑卒中;(4)符合《中国急性缺血性脑卒中诊治指南2014》[6]静脉溶栓适应证;(5)患者或家属签署知情同意书。排除标准:(1)有静脉溶栓禁忌证者;(2)静脉溶栓后接受脑血管造影或桥接治疗者;(3)血压、美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分、改良Rankin量表(modified Rankin scale,mRS)评分等数据记录不完整者。本研究通过我院医学伦理委员会审批。
1.2 静脉溶栓治疗方案静脉溶栓治疗前血压过高[收缩压(systolic blood pressure,SBP)≥180 mmHg(1 mmHg=0.133 kPa),舒张压(diastolic blood pressure,DBP)≥105 mmHg]的患者予以乌拉地尔静脉微泵注射。静脉溶栓药物使用rt-PA阿替普酶,剂量为0.9 mg/kg,最大剂量≤90 mg,首剂静脉推注总量的10%,剩余90%微泵注射维持60 min。静脉溶栓后24 h内不予抗栓治疗。
1.3 研究方法对照组患者在静脉溶栓治疗后给予常规血压干预,包括常规健康宣教、按时监测血压、及时给予口服降压药物、密切观察神经系统体征。集束化组实行血压集束化管理,具体包括以下几个方面。
1.3.1 成立血压集束化管理小组由脑血管病中心主任医师、护士长、护士共10人组成静脉溶栓后血压集束化管理小组。根据《中国急性缺血性脑卒中诊治指南2014》[6],检索Medline、Elsevier、维普、万方等国内外数据库,查阅大量证据级别较高的meta分析、系统综述及随机对照试验研究文献,拟定静脉溶栓治疗患者血压集束化管理模式。
1.3.2 组员培训培训内容:(1)学习静脉溶栓的适应证、禁忌证、溶栓时及溶栓后24 h内需要监测的指标;(2)学习近5年发表的meta分析、系统综述及随机对照试验研究等静脉溶栓后血压控制的文献;(3)学习NIHSS、mRS、患者健康问卷抑郁自评量表(nine-item depression module of the patient health questionnaire,PHQ-9)、广泛性焦虑障碍量表(generalized anxiety disorder 7-item scale,GAD-7)等的评分标准及规范的血压测量方法;(4)学习血压集束化管理方案。组员经考核合格后方可参与血压集束化管理。
1.3.3 血压集束化管理方案的实施(1)护士加入:护士参与静脉溶栓患者接诊、检查及治疗全过程。患者到达急诊预检台和静脉溶栓治疗实施前均测量血压,溶栓过程中护士每15 min测量1次血压并记录,溶栓结束后再陪同患者复查头颅计算机断层扫描(computed tomography,CT)并转运至病房,以便及时发现血压波动。(2)心理疏导:入科时对患者进行PHQ-9和GAD-7评分,以早期发现有焦虑抑郁倾向的患者,并进行情绪安抚和心理疏导,必要时加用抗抑郁或抗焦虑药物。(3)绘制血压波动曲线:为每例患者绘制血压波动曲线。对于血压波动较大,或血压超过180/105 mmHg的患者每30 min测量血压1次,如果血压仍持续增高,必要时予乌拉地尔静脉微泵治疗,平稳降压。(4)及时发现引起血压增高的其他因素:观察患者的大小便及腹痛情况,及时解除因小便潴留或便秘等因素引起的血压增高。密切监测患者生命体征的变化,预防缺氧及低血容量。(5)患者外出检查时由医师陪同,减少患者不必要的搬动和主动体位摆放。(6)所有血压测量均使用水银袖带血压计而非电动血压计,以减少测量误差。
1.4 观察指标 1.4.1 血压变异测量静脉溶栓前收缩压(S1)、舒张压(D1)以及脉压(P1),静脉溶栓后24 h内每小时测量1次血压,SBP分别记录为S2、S3、…Si、…、S25,DBP分别记录为D2、D3、…、Di、…、D25。计算最大收缩压(maximum systolic blood pressure,Smax)、最小收缩压(minimum systolic blood pressure,Smin)、平均收缩压(mean systolic blood pressure,Smean)及收缩压标准差(standard deviation of systolic blood pressure,SSD),最大舒张压(maximum diastolic blood pressure,Dmax)、最小舒张压(minimum diastolic blood pressure,Dmin)、平均舒张压(mean diastolic blood pressure,Dmean)和舒张压标准差(standard deviation of diastolic blood pressure,DSD)。
血压连续变异(successive variation,SV)的计算公式如下:
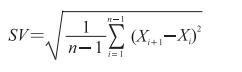
|
根据此公式计算收缩压连续变异(successive variation of systolic blood pressure,SSV)、舒张压连续变异(successive variation of diastolic blood pressure,DSV)、最大收缩压连续变异(successive variation of maximum systolic blood pressure,SSVmax)、最大舒张压连续变异(successive variation of maximum diastolic blood pressure,DSVmax)。
1.4.2 神经功能评价记录溶栓前、后及出院时患者的NIHSS评分。在院死亡定义为发生在本次住院期间的死亡;症状性颅内出血定义为溶栓治疗开始后36 h内复查头颅CT发现可识别的出血病灶,且NIHSS评分增加≥4分。随访90 d的mRS评分:0~2分定义为预后良好,3~6分定义为预后不良。
1.5 统计学处理采用SPSS 17.0软件进行数据处理。呈正态分布的计量资料采用x±s表示,两组间比较用t检验。呈偏态分布计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用Mann-Whitney U检验。计数资料采用例数和百分数表示,组间比较用χ2检验。应用logistic回归进行单因素和多因素分析。检验水准(α)为0.05。
2 结果 2.1 两组患者基本资料比较连续登记接受单纯静脉溶栓治疗的急性缺血性脑卒中患者311例,剔除假卒中患者4例、血压等临床数据记录不完整者10例、溶栓前多模态CT检查提示颅内大血管闭塞但因家属拒绝或梗死核心区太大等原因未予血管内治疗的患者11例,剩余286例患者纳入研究。根据是否施行血压集束化管理措施,将患者分为集束化组161例和对照组125例。两组年龄、性别、高血压病、糖尿病、心房颤动、吸烟、入院时NIHSS评分和溶栓前血压差异均无统计学意义(P均>0.05)。集束化组患者静脉溶栓治疗后症状性颅内出血发生率低于对照组,且差异有统计学意义(χ2=4.598,P=0.032)。两组患者在院死亡率差异无统计学意义(χ2=0.058,P=0.810)。集束化组患者静脉溶栓后90 d随访预后良好率为62.11%(100/161),高于对照组的49.60%(62/125),两组差异有统计学意义(χ2=4.485,P=0.034)。见表 1。
|
|
表 1 两组接受静脉溶栓治疗的急性缺血性脑卒中患者临床资料和预后比较 Tab 1 Comparison of clinical data and prognosis of acute ischemic stroke patients with intravenous thrombolysis between two groups |
2.2 两组患者血压参数比较
集束化组患者Smean和Dmean与对照组相比差异均无统计学意义(P均>0.05)。集束化组患者Smax和Dmax均低于对照组(t=2.516、2.354,P=0.018、0.026),SSV和DSV也均小于对照组(t=2.437、1.842,P=0.025、0.046)。见表 2。
|
|
表 2 两组接受静脉溶栓治疗的急性缺血性脑卒中患者血压参数比较 Tab 2 Comparison of blood pressure parameters of acute ischemic stroke patients with intravenous thrombolysis between two groups |
2.3 影响患者预后的多因素分析
静脉溶栓治疗后对患者进行90 d随访,286例患者中预后良好(mRS评分为0~2分)者162例(56.64%),预后不良124例(43.36%)。对预后因素进行单因素分析,结果(表 3)显示,预后良好组接受集束化管理的患者比例高于预后不良组(χ2=4.013,P=0.045),入院时NIHSS评分低于预后不良组(t=2.333,P=0.037),发病至静脉溶栓时间短于预后不良组(U=1.375,P=0.042),SSV(t=2.603,P=0.037)和DSV(t=2.958,P=0.008)也均小于预后不良组。将上述P<0.1的变量纳入logistic回归模型进行多因素分析,并将DSV按照15 mmHg[7]转化为二分类变量后纳入统计分析,结果(表 4)显示接受集束化管理[比值比(odds ratio,OR)=0.798,P=0.002]、DSV≤15 mmHg(OR=0.816,P=0.018)为预后良好的独立预测因素。
|
|
表 3 急性缺血性脑卒中静脉溶栓治疗患者预后影响因素的单因素分析 Tab 3 Univariate analysis of prognostic factors in acute ischemic stroke patients with intravenous thrombolysis |
|
|
表 4 急性缺血性脑卒中静脉溶栓治疗患者预后影响因素的多因素logistic回归分析 Tab 4 Multivariate logistic regression analysis of prognostic factors in acute ischemic stroke patients with intravenous thrombolysis |
3 讨论
在缺血性脑卒中急性期,高达75%的患者会出现高血压,其机制尚不明确。美国卒中协会健康管理指南推荐,缺血性脑卒中患者日常状态、静脉溶栓前和溶栓后能够耐受的血压上限分别是220/120 mmHg、185/110 mmHg和180/105 mmHg,静脉溶栓最严重的并发症是症状性颅内出血[8]。关于血压与静脉溶栓后出血并发症的关系,有报道认为溶栓后血压增高与出血转化相关,但也有报道却认为二者之间并无关联[9-10]。关于降压治疗观察性研究的结论不一致,有文献建议将收缩压降至140~150 mmHg[7, 11],相反,多项随机临床试验的事后分析认为降压治疗对患者并无获益[5, 12-13]。
近年临床研究结果显示,高血压病对脑血管的危害不只是平均血压升高的结果,血压变异同样会影响高血压患者靶器官的损害及总体预后。血压变异大引起脑卒中的机制可能是,长时血压变异后血液流变学干扰血管舒张收缩调节,增强氧化应激反应,导致易损斑块破裂引起缺血性脑卒中[14]。对于短期血压变异,血压变异大可导致缺血性脑卒中后症状性颅内出血发生率、死亡率和预后不良率的增加[3]。一项临床试验的事后分析结果同样显示,缺血性脑卒中静脉溶栓治疗后24 h内血压变异大与预后不良有关[15]。
本研究显示,血压变异与缺血性脑卒中静脉溶栓治疗患者预后有关。既往研究认为收缩压是缺血性脑卒中静脉溶栓治疗安全性和功能恢复的重要影响因素;大部分观察性研究发现,就诊时收缩压高与脑卒中预后不良相关,二者之间的关联呈U型曲线关系[16];第三次国际卒中试验(the third International Stroke Trial,IST-3)的事后分析发现,收缩压变异大与不良事件的发生有关,不良事件包括症状性颅内出血和6个月预后不良[13]。然而,本研究结果显示,溶栓后24 h内DSV≤15 mmHg是预后良好的独立预测因素,提示在临床工作中对舒张压的监测和控制与收缩压同等重要。
本研究发现,通过对急性缺血性脑卒中患者静脉溶栓后24 h内进行血压集束化管理可降低患者的血压变异,包括收缩压连续变异和舒张压连续变异,降低静脉溶栓治疗后症状性颅内出血发生率,提高90 d预后良好率,是缺血性脑卒中静脉溶栓治疗预后良好的独立预测因素。血压变异与多种外因(既往用药情况、心律失常患者使用β-受体阻滞剂、植物神经功能和情绪压力、体位改变、电动血压计连续记录还是手工测量等)和内因(血容量、脑卒中亚型、血管再通情况、自主神经调节功能等)有关[17],如果血压监测不够及时和密切,则难以精确记录血压变异。此外,缺血性脑卒中急性期血压管理还应该结合缺血半暗带、血管闭塞、侧支循环、血管再通状况以及脑卒中的病因进行综合分析。因此,急性缺血性脑卒中静脉溶栓治疗后血压个体化规范化管理能更使患者获益。
综上所述,对急性缺血性脑卒中患者静脉溶栓治疗后启用血压集束化管理可降低静脉溶栓治疗后血压变异,降低静脉溶栓治疗后症状性颅内出血的发生率,改善预后。
| [1] |
HARADEN C. What is a bundle 2006[EB/OL]. (2017-04-26)[2018-07-26]. http://www.ihi.org/resources/Pages/ImprovementStories/WhatIsaBundle.aspx.
|
| [2] |
WANG W, JIANG B, SUN H, RU X, SUN D, WANG L, et al. Prevalence, incidence, and mortality of stroke in China:results from a nationwide population-based survey of 480687 adults[J]. Circulation, 2017, 135: 759-771. DOI:10.1161/CIRCULATIONAHA.116.025250 |
| [3] |
LIU K, YAN S, ZHANG S, GUO Y, LOU M. Systolic blood pressure variability is associated with severe hemorrhagic transformation in the early stage after thrombolysis[J]. Transl Stroke Res, 2016, 7: 186-191. DOI:10.1007/s12975-016-0458-6 |
| [4] |
ENDO K, KARIO K, KOGA M, NAKAGAWARA J, SHIOKAWA Y, YAMAGAMI H, et al. Impact of early blood pressure variability on stroke outcomes after thrombosis:the SAMURAI rt-PA Registry[J]. Stroke, 2013, 44: 816-818. DOI:10.1161/STROKEAHA.112.681007 |
| [5] |
HE J, ZHANG Y, XU T, ZHAO Q, WANG D, CHEN C S, et al. Effects of immediate blood pressure reduction on death and major disability in patients with acute ischemic stroke:the CATIS randomized clinical trial[J]. JAMA, 2014, 311: 479-489. DOI:10.1001/jama.2013.282543 |
| [6] |
中华医学会神经病学分会. 中国急性缺血性脑卒中诊治指南2014[J]. 中华神经科杂志, 2015, 48: 246-257. DOI:10.3760/cma.j.issn.1006-7876.2015.04.002 |
| [7] |
GEEGANAGE C M, TRACY M, BATH M W, BATH P M. Blood pressure reduction and cardiovascular prevention:meta-regression using ordered categorical (ordinal) event data[J]. J Hypertens, 2010, 28: 1995-1999. DOI:10.1097/HJH.0b013e32833c7a32 |
| [8] |
JAUCH E C, SAVER J L, ADAMS H P JR, BRUNO A, CONNORS J J, DEMAERSCHALK B M, et al. Guidelines for the early management of patients with acute ischemic stroke:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2013, 44: 870-947. DOI:10.1161/STR.0b013e318284056a |
| [9] |
AL-KHALED M, MATTHIS C, EGGERS J. Predictors of in-hospital mortality and the risk of symptomatic intracerebral hemorrhage after thrombolytic therapy with recombinant tissue plasminogen activator in acute ischemic stroke[J]. J Stroke Cerebrovasc Dis, 2014, 23: 7-11. DOI:10.1016/j.jstrokecerebrovasdis.2012.04.004 |
| [10] |
BUTCHER K, CHRISTENSEN S, PARSONS M, DE SILVA D A, EBINGER M, LEVI C, et al. Postthrombolysis blood pressure elevation is associated with hemorrhagic transformation[J]. Stroke, 2010, 41: 72-77. DOI:10.1161/STROKEAHA.109.563767 |
| [11] |
AHMED N, WAHLGEN N, BRAININ M, CASTILLO J, FORD G A, KASTE M, et al. Relationship of blood pressure, antihypertensive therapy, and outcome in ischemic stroke treated with intravenous thrombolysis:retrospective analysis from Safe Implementation of Thrombolysis in Stroke-International Stroke Thrombolysis Register (SITS-ISTR)[J]. Stroke, 2009, 40: 2442-2449. DOI:10.1161/STROKEAHA.109.548602 |
| [12] |
ENOS Trial Investigators. Efficacy of nitric oxide, with or without continuing antihypertensive treatment, for management of high blood pressure in acute stroke (ENOS):a partial-factorial randomised controlled trial[J]. Lancet, 2015, 385: 617-628. DOI:10.1016/S0140-6736(14)61121-1 |
| [13] |
BERGE E, COHEN G, LINDLEY R I, SANDERCOCK P, WARDLAW J M, SANDSET E C, et al. Effects of blood pressure and blood pressure-lowering treatment during the first 24 hours among patients in the Third International Stroke Trial of Thrombolytic treatment for acute ischemic stroke[J]. Stroke, 2015, 46: 3362-3369. DOI:10.1161/STROKEAHA.115.010319 |
| [14] |
FUKUDA K, KAI H, KAMOUCHI M, HATA J, AGO T, NAKANE H, et al. Day-by-day blood pressure variability and functional outcome after acute ischemic stroke:Fukuoka Stroke Registry[J]. Stroke, 2015, 46: 1832-1839. DOI:10.1161/STROKEAHA.115.009076 |
| [15] |
MANNING L S, MISTRI A K, POTTER J, ROTHWELL P M, ROBINSON T G. Short term blood pressure variability in acute stroke:post hoc analysis of the controlling hypertension and hypotension immediately post stroke and continue or stop post-stroke antihypertensives collaborative study trials[J]. Stroke, 2015, 46: 1518-1524. DOI:10.1161/STROKEAHA.115.009078 |
| [16] |
TOMⅡ Y, TOYODA K, NAKASHIMA T, NEZU T, KOGA M, YOKOTA C, et al. Effects of hyperacute blood pressure and heart rate on stroke outcomes after intravenous tissue plasminogen activator[J]. J Hypertens, 2011, 29: 1980-1987. DOI:10.1097/HJH.0b013e32834a764e |
| [17] |
CHAMORRO A, AMARO S, VARGAS M, OBACH V, CERVERA A, GOMEZ-CHOCO M, et al. Catecholamines, infection, and death in acute ischemic stroke[J]. J Neurol Sci, 2007, 252: 29-35. DOI:10.1016/j.jns.2006.10.001 |
 2018, Vol. 39
2018, Vol. 39


