急性缺血性脑卒中是好发于中老年患者的脑血管病,具有高发病率和高致残率的特点,其中基底节区腔隙性脑梗死在临床上较多见[1]。Fisher[2]认为穿支脂质透明样变和动脉粥样硬化是腔隙性脑梗死的病理基础,由于两种病因腔隙性脑梗死在临床表现和治疗方面存在差异,因此,需要不同的治疗策略。Caplan[3]将穿支开口处动脉粥样硬化斑块所致的缺血性脑卒中命名为穿支动脉粥样硬化病(branch atheromatous disease,BAD),影像学上常表现为超大型腔隙性梗死灶(梗死灶直径>15 mm)。目前临床研究发现,部分基底节区孤立性缺血性脑卒中患者早期临床症状易进展[4],其原因不明确。由于难以获得病理学资料,影像学发展开辟了新的研究方向。高分辨率磁共振成像(high resolution-magnetic resonance imaging,HR-MRI)可以无创、清晰地显示大脑中动脉(middle cerebral artery,MCA)管壁、斑块情况[5],目前在临床应用广泛。本研究应用HR-MRI分析基底节区孤立性缺血性脑卒中与MCA病变的相关性,以探讨基底节区孤立性缺血性脑卒中的发病原因。
1 资料和方法 1.1 病例选择纳入2015年1月至2016年12月我院脑血管病中心收治的发病2周内、经磁共振成像(magnetic resonance imaging,MRI)弥散加权成像(diffusion weighted imaging,DWI)证实基底节区存在孤立的急性梗死灶,并且完善病变侧MCA管壁MRI平扫+增强检查的患者15例。排除颈部计算机断层扫描血管成像(computed tomography angiography,CTA)或磁共振血管成像(magnetic resonance angiography,MRA)检查显示颈部血管狭窄≥50%,以及心源性栓塞和栓子来源为椎动脉或伴血液系统疾病、烟雾病、夹层动脉瘤等患者。所有研究对象均签署书面知情同意书,本研究通过我院医学伦理委员会审批。
1.2 临床资料收集患者年龄、性别、脑血管病危险因素(高血压病、糖尿病、高脂血症、冠心病、吸烟、脑卒中史);记录入院时美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分;实验室检查指标包括血常规、空腹血糖、总胆固醇、三酰甘油、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、肝肾功和同型半胱氨酸等;所有患者均行头颅和颈部MRA或CTA检查。心脏评估指标包括常规心电图、动态心电图、心脏彩色多普勒超声检查。
1.3 HR-MRI检查及参数所有患者HR-MRI检查均在我院影像医学科进行,采用8通道标准线圈,应用3.0 T磁共振扫描平台成像系统(HDX platform,GE Healthcare,USA)行多序列扫描。头颅HR-MRI检查包括T1加权像(T1 weighted imaging,T1WI)、T2加权像(T2 weighted imaging,T2WI)、液体衰减反转恢复(fluid-attenuated inversion recovery,FLAIR)及DWI 4个序列。HR-MRI扫描矩阵为320×256,先釆用“亮血技术”行三维时间飞跃法磁共振血管成像(three dimensional time-of-flight magnetic resonance angiography,3D-TOF-MRA)进行定位序列扫描,明确病变部位;采用“黑血技术”对病变MCA M1段进行多序列垂直扫描(连续12层,层厚为2 mm),扫描序列包括T1WI、T2WI、短时反转恢复(short time inversion recovery,STIR)序列和T1WI增强;完成5个序列扫描时间为30~45 min。
1.4 评估指标评价指标包括梗死灶直径和MCA是否有斑块、斑块位置、斑块形态及斑块是否有强化。依据华法林-阿司匹林症状性颅内动脉疾病研究(Warfarin-Aspirin Symptomatic Intracranial Disease Study,WASIDS)方法[5]计算狭窄率,根据责任动脉狭窄程度将目标动脉分为轻度狭窄(<50%)、中度狭窄(50%~69%)、重度狭窄(70%~99%)和闭塞(100%)。根据既往研究[6]将MCA管壁分为4个壁:前壁、后壁、上壁、下壁,分析病变侧MCA M1段的血管情况。根据T2WI图像判断斑块的形态和位置。BAD定义为头颅DWI检查累及基底节区3个或3个以上层面且梗死灶直径>15 mm[7]。注射造影剂后T1WI图像上斑块的信号强度增加,称为有强化。根据T1WI增强前后信号差异,以增强后垂体漏斗的信号为参照将斑块强化程度分为3级:0级为轻度强化,即T1WI增强图像上信号相似或低于无斑块颅内动脉壁;1级为中度强化,即T1WI增强图像上信号高于0级但低于垂体漏斗;2级为明显强化,即T1WI增强图像上信号相似或高于垂体漏斗[8]。深部微小流空(deep tiny flow voids,DTFV)定义为在HR-MRI的T2WI序列2个及以上层面病变MCA管壁周围有≥3个流空影[9]。
1.5 统计学处理采用SPSS 21.0软件进行数据处理。计量资料若服从正态分布以x±s表示,若不服从正态分布以中位数(范围)表示;计数资料以例数和百分数表示。
2 结果15例基底节区孤立性缺血性脑卒中患者的临床资料和MCA斑块特征见表 1。患者年龄为30~78岁,平均年龄为(55.6±12.1)岁;男11例(73.3%),女4例(26.7%);入院时中位NIHSS评分为2(0~8)分。脑血管病危险因素:高血压病9例,糖尿病6例,高脂血症3例,吸烟史6例,脑卒中史2例。4例患者病程早期肢体无力进展加重,11例患者突发起病后即达高峰。头颅和颈部CTA或MRA检查提示无狭窄患者6例,轻度狭窄4例,中度狭窄2例,重度狭窄3例。HR-MRI检查显示10例患者病变侧MCA主干存在斑块,其中1例为无狭窄患者,9例为狭窄患者;7例为弧形斑块、3例为环形斑块;T1WI增强检查提示8例明显强化,1例轻度强化和1例无强化。病例1、2、4、5、8、9、10、11及15的HR-MRI T2WI上病变侧MCA无DTFV现象而对侧存在,其中对侧6例MCA无狭窄,2例轻度狭窄,1例重度狭窄(图 1);其余患者双侧均无DTFV现象。DWI测量示15例患者的中位梗死灶直径为23.04(4.00~45.96)mm。头颅MRI FLAIR序列冠状位显示12例患者的梗死灶呈逗号状,在DWI图像上梗死灶直径均>15 mm,诊断为BAD(7例患者的责任MCA主干存在斑块);3例梗死灶呈点片状,在DWI图像上梗死灶直径均<15 mm,诊断为非BAD(3例患者责任MCA均检出斑块)。典型非BAD患者的影像学资料见图 1,典型BAD患者的影像学资料见图 2。
|
|
表 1 15例基底节区孤立性缺血性脑卒中患者的一般资料和MCA斑块特征 Tab 1 Clinical data and MCA plaque features of 15 patients with basal ganglia isolated ischemic stroke |
|
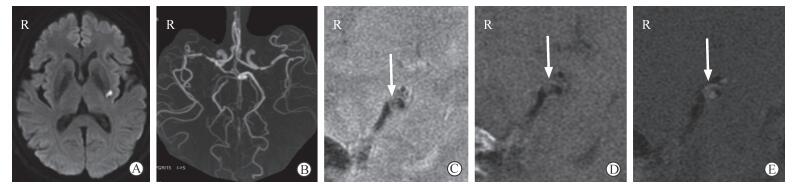
图 1 1例MCA狭窄的非穿支动脉粥样硬化病患者影像学资料 Fig 1 Imaging data of a non-branch atheromatous disease patient with MCA stenosis Patient 13, female, 68 years. A: DWI showing fresh infarction in left basal ganglia; B: MRA showing moderate stenosis of left MCA; C: HR-MRI T2WI showing plaque formation on the ventral and superior wall of left MCA (arrow); D, E: HR-MRI T1WI showing arc plaque on the wall (arrow, D) with enhancement after the administration of contrast (arrow, E). MCA: Middle cerebral artery; DWI: Diffusion weighted imaging; MRA: Magnetic resonance angiography; HR-MRI: High resolution-magnetic resonance imaging; T2WI: T2 weighted imaging; T1WI: T1 weighted imaging |
|
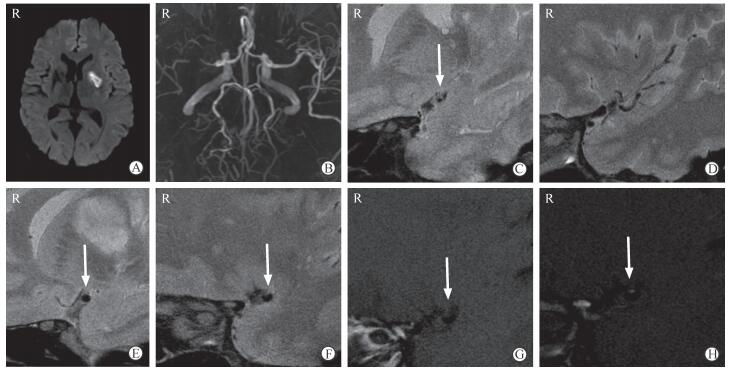
图 2 1例MCA狭窄的穿支动脉粥样硬化病患者影像学资料 Fig 2 Imaging data of a branch atheromatous disease patient with MCA stenosis Patient 4, male, 48 years. A: DWI showing the fresh left basal ganglia infarction; B: MRA showing severe stenosis of right MCA, and mild stenosis of left MCA; C, D: HR-MRI T2WI of right MCA showing severe proximal artery stenosis with DTFV (arrow) around the narrow artery (C), and the distal artery occlusion with cortical artery flow viods (D); E, F: HR-MRI T2WI of left MCA showing the proximal artery superior and dorsal area with DTFV (arrow, E), and arc plaque (arrow) on the superior wall of MCA without DTFV around it (F); G, H: HR-MRI T1WI showing arc plaque on the superior wall (arrow, G) with enhancement after the administration of contrast (arrow, H). MCA: Middle cerebral artery; DWI: Diffusion weighted imaging; MRA: Magnetic resonance angiography; HR-MRI: High resolution-magnetic resonance imaging; T2WI: T2 weighted imaging; DTFV: Deep tiny flow voids; T1WI: T1 weighted imaging |
3 讨论
基底节区包括基底节及周围白质、内囊等,供血动脉为穿支,是脑血管病的好发部位,但患者临床及影像学特征存在差异,提示发病机制可能不同。BAD这一概念属于病理学范畴,临床上难以获得病理学资料,故目前BAD的诊断主要依靠临床和影像学资料。本研究中12例患者的梗死灶在头颅MRI冠状位上呈典型的逗号状,且DWI上梗死灶直径>15 mm,诊断为BAD;3例患者DWI表现为小斑片状弥散受限,CTA或MRA检查显示MCA中度至重度狭窄,HR-MRI证实为不稳定斑块,故分类为大动脉粥样硬化缺血性脑卒中。
BAD是穿支开口处发生动脉粥样硬化,血管评估未发现明显大动脉狭窄或狭窄程度<50%[7]。但是,Tatsumi和Yamamoto[10]报道了1例头颅MRA检查未见血管狭窄、脑桥旁中央梗死的患者,死后病理结果显示基底动脉中度至重度粥样硬化,穿支开口闭塞,说明血管正常不能排除BAD。本研究发现CTA和MRA检查无狭窄的6例患者中有1例也检测出MCA存在斑块。随着HR-MRI的临床应用,越来越多研究发现动脉粥样硬化斑块可导致动脉外生性生长,有学者将该现象称为正性重构[11],且多项研究支持正性重构与症状性血管狭窄有关[12-13],考虑部分原因可能是管壁扩张过程中堵塞穿支开口或斑块不稳定脱落引起缺血事件,对病因判断有一定帮助。
BAD病因是穿支粥样硬化,而小动脉闭塞脑梗死为深部穿支透明样变,且目前研究发现BAD较透明样变梗死早期症状更易进展[7, 14],但二者均可表现为腔隙综合征,临床常依据梗死灶面积区分。本研究发现3例基底节区梗死灶直径<15 mm患者的MCA存在中度至重度狭窄,HR-MRI检查证实MCA斑块形成,且有强化。12例BAD患者中5例HR-MRI未检出MCA斑块,但不能排除穿支本身的动脉粥样硬化。7例同侧MCA存在斑块,5例弧形斑块累及上壁(穿支开口处[15]),1例环形斑块也以上壁明显强化为表现,斑块明显强化属于不稳定斑块,考虑斑块阻塞穿支开口引起BAD。1例患者斑块位于下壁(斑块好发部位[15]),推测可能为斑块脱落导致动脉栓塞。故仅凭影像学和临床症状难以全面评估病情,需要进一步完善脑血管造影和动脉管壁成像检查,明确病因,以制定最佳的脑卒中二级预防方案。
Xu等[9]研究发现DTFV多见于MCA重度狭窄或闭塞的患者,尤其是无症状者,考虑DTFV来源于新生血管网以应对慢性脑缺血。本研究中,病例4头颅DWI检查示左侧基底节区新发梗死灶;病灶对侧MCA起始部中度至重度狭窄,管壁周围可见DTFV,而闭塞的远端可见皮质支流空影。分析两侧MCA管壁情况,病变侧斑块由前下壁螺旋至前上壁,M1段近端(斑块在前下壁)管壁前上方可见DTFV,而M1段远端(斑块在前上壁)管腔周围无DTFV,推测该侧MCA为慢性进展性闭塞。DTFV显示代偿血管影像,由于侧支循环形成良好而未发生临床缺血事件,故认为DTFV可能为新生血管。但本研究中9例患者病变侧MCA周围未见DTFV,而对侧均可见DTFV,与Xu等[9]的研究结果不同,本研究中6例患者梗死灶对侧的MCA无狭窄,认为DTFV可能包含穿支。
本研究也存在不足:(1)管壁成像无法显示穿支本身病变情况,且部分HR-MRI不能连续扫描目标动脉,有可能未能显示病变最严重处,也缺乏病理学资料支持;(2)样本量小,未进行统计学分析,仅部分基底节区孤立性缺血性脑卒中患者行管壁影像学像检查,资料不完整,故需要进一步扩大样本量,研究基底节区孤立性缺血性脑卒中的病因学。
总之,基底节区孤立性缺血性脑卒中病因可能是BAD或深穿支透明变性,完整的神经影像学和脑血管造影检查可以全面评估病因。HR-MRI可以清晰地显示MCA管壁及斑块情况,结合斑块形态、部位及有无强化等全面评估有助于明确病因,可为临床医师制定治疗方案提供影像学依据。
| [1] |
孙海欣, 王文志. 我国脑卒中流行状况及其防控策略[J]. 中华神经科杂志, 2017, 50: 881-884. DOI:10.3760/cma.j.issn.1006-7876.2017.12.001 |
| [2] |
FISHER C M. Capsular infarcts:the underlying vascular lesions[J]. Arch Neurol, 1979, 36: 65-73. DOI:10.1001/archneur.1979.00500380035003 |
| [3] |
CAPLAN L R. Intracranial branch atheromatous disease:a neglected, understudied, and underused concept[J]. Neurology, 1989, 39: 1246-1250. DOI:10.1212/WNL.39.9.1246 |
| [4] |
DEGUCHI I, HAYASHI T, KATO Y, NAGOYA H, OHE Y, FUKUOKA T, et al. Treatment outcomes of tissue plasminogen activator infusion for branch atheromatous disease[J/OL]. J Stroke Cerebrovasc Dis, 2013, 22: e168-e172. doi: 10.1016/j.jstrokecerebrovasdis.2012.10.012.
|
| [5] |
CHIMOWITZ M I, KOKKINOS J, STRONG J, BROWN M B, LEVINE S R, SILLIMAN S, et al. The Warfarin-Aspirin Symptomatic Intracranial Disease Study[J]. Neurology, 1995, 45: 1488-1493. DOI:10.1212/WNL.45.8.1488 |
| [6] |
MANDELL D M, MOSSA-BASHA M, QIAO Y, HESS C P, HUI F, MATOUK C, et al. Intracranial vessel wall MRI:principles and expert consensus recommendations of the American Society of Neuroradiology[J]. AJNR Am J Neuroradiol, 2017, 38: 218-229. DOI:10.3174/ajnr.A4893 |
| [7] |
NAKASE T, YOSHIOKA S, SASAKI M, SUZUKI A. Clinical evaluation of lacunar infarction and branch atheromatous disease[J]. J Stroke Cerebrovasc Dis, 2013, 22: 406-412. DOI:10.1016/j.jstrokecerebrovasdis.2011.10.005 |
| [8] |
QIAO Y, ZEILER S R, MIRBAGHERI S, LEIHH R, URRUTIA V, WITYK R, et al. Intracranial plaque enhancement in patients with cerebrovascular events on high-spatial-resolution MR images[J]. Radiology, 2014, 271: 534-542. DOI:10.1148/radiol.13122812 |
| [9] |
XU Y Y, LI M L, GAO S, HOU B, SUN Z Y, ZHOU H L, et al. Non-moyamoya vessel network formation along steno-occlusive middle cerebral artery[J]. Neurology, 2016, 86: 1957-1963. DOI:10.1212/WNL.0000000000002698 |
| [10] |
TATSUMI S, YAMAMOTO T. An autopsied case of an apparent pontine branch atheromatous disease[J]. Eur Neurol, 2010, 63: 184-185. DOI:10.1159/000290248 |
| [11] |
GLAGOV S, WEISENBERG E, ZARINS C K, STANKUNAVICIUS R, KOLETTIS G J. Compensatory enlargement of human atherosclerotic coronary arteries[J]. N Engl J Med, 1987, 316: 1371-1375. DOI:10.1056/NEJM198705283162204 |
| [12] |
QIAO Y, ANWAR Z, INTRAPIROMKUL J, LIU L, ZEILER S R, LEIGH R, et al. Patterns and implications of intracranial arterial remodeling in stroke patients[J]. Stroke, 2016, 47: 434-440. |
| [13] |
SHI M C, WANG S C, ZHOU H W, XING Y Q, CHENG Y H, FENG J C, et al. Compensatory remodeling in symptomatic middle cerebral artery atherosclerotic stenosis:a high-resolution MRI and microemboli monitoring study[J]. Neurol Res, 2012, 34: 153-158. DOI:10.1179/1743132811Y.0000000065 |
| [14] |
JEONG H G, KIM B J, YANG M H, HAN M K, BAE H J. Neuroimaging markers for early neurologic deterioration in single small subcortical infarction[J]. Stroke, 2015, 46: 687-691. DOI:10.1161/STROKEAHA.114.007466 |
| [15] |
ZHU X J, DU B, LOU X, HUI F K, MA L, ZHENG B W, et al. Morphologic characteristics of atherosclerotic middle cerebral arteries on 3T high-resolution MRI[J]. AJNR Am J Neuroradiol, 2013, 34: 1717-1722. DOI:10.3174/ajnr.A3573 |
 2018, Vol. 39
2018, Vol. 39


