2. 海军军医大学(第二军医大学)基础医学院组织胚胎学教研室, 上海 200433;
3. 浙江省海宁市人民医院呼吸科, 海宁 314400
2. Department of Histology and Embryology, College of Basic Medical Sciences, Navy Medical University(Second Military Medical University), Shanghai 200433, China;
3. Department of Respiratory Medicine, People's Hospital of Haining, Haining 314400, Zhejiang, China
哮喘是一种以气道高反应性为特征,由多种细胞因子介导的慢性气道炎症性疾病,其控制率较低。有学者对4 805例来自亚洲(包括中国在内的12个国家和地区)多个城市哮喘患者的哮喘控制状态进行评估,结果显示控制率仅为3%[1]。2008年中国哮喘联盟调查中国哮喘患者的控制率为28.7%[2]。为了合理用药,全球哮喘防治创议(Global Initiative for Asthma,GINA)和哮喘研究人员根据患者的临床症状,以及第1秒用力呼气容积(forced expiratory volume in one second,FEV1)或最大呼气流量(peak expiratory flow,PEF)将患者治疗前的病情严重程度分为4个等级:间歇状态(第1级)、轻度持续(第2级)、中度持续(第3级)和重度持续(第4级)[3]。临床上根据哮喘严重程度确定药物的使用剂量和频率,因此准确判断哮喘等级是临床治疗该病的关键。但是有文献报道,仅根据临床症状和FEV1对哮喘患者进行分级,有35%以上患者的病情被低估,因而延误了治疗[4]。如何避免临床诊治过程中低估患者病情的情况,正确使用升降级治疗,以及更准确地评估哮喘病情的严重程度,是需要研究的重要课题。
外泌体是一种由细胞分泌的直径为30~200 nm的含多种生物活性蛋白质与核酸成分的囊泡[5]。近年来,研究发现外泌体能够反映其来源细胞的病理状态,是一种极具潜力的新型诊断标志物[6]。有研究显示,外泌体能够参与机体免疫应答,参与包括哮喘在内的各种疾病过程[7]。随着研究的逐步深入,微RNA(microRNA,miRNA)被证明参与了气道变应性炎症的发病过程[8-9]。研究表明,从哮喘患者支气管肺泡灌洗液中分离得到的外泌体中包含的miRNA表型和功能与健康人有显著差异[10]。微RNA-21(microRNA-21,miR-21)在哮喘患者的支气管上皮细胞中表达增加[11],在难治性哮喘患者血浆中的表达显著高于完全控制性哮喘患者(P<0.001)[12],说明miR-21的表达水平可能与哮喘的严重程度有关,并且可能参与了哮喘发生过程。因此,本研究通过对治疗前不同严重程度(4个等级)哮喘患者的血清外泌体中miR-21水平进行检测,以评价其对哮喘的诊断效能,并探寻血清外泌体中miR-21水平与哮喘严重程度的关系。
1 资料和方法 1.1 一般资料选取2016年4月至2017年4月海军军医大学(第二军医大学)长海医院收治的治疗前哮喘患者82例,根据支气管哮喘防治指南[3]、GINA(2011)[4]制定的病情严重程度分级标准将所有患者分成4组:间歇状态20例,FEV1占预计值百分比(forced expiratory volume in one second as percentage of predicted,FEV1%Pred)≥80%,PEF变异率<20%;轻度持续22例,FEV1%Pred≥80%,PEF变异率为20%~30%;中度持续22例,FEV1%Pred为60%~79%,PEF变异率>30%;重度持续18例,FEV1%Pred<60%,PEF变异率>30%。选取同期海军军医大学(第二军医大学)长海医院80名健康体检的健康人作为健康对照(FEV1%Pred≥83%,PEF变异率<20%)。本研究通过海军军医大学(第二军医大学)长海医院伦理委员会批准,所有研究对象均知情同意并签署知情同意书。
1.2 标本采集用无添加剂真空采血管采集各组患者外周静脉血2 mL,静置15 min,4 ℃ 1 500×g离心10 min后吸取上清液,将上清过0.22 μm一次性滤膜,收集血清标本于-80 ℃保存备用。
1.3 外泌体的提取及鉴定应用血清/血浆外泌体RNA分离试剂盒(exoRNeasy Serum/Plasma Maxi Kit;货号:77064,德国Qiagen公司)提取外泌体,严格依照试剂盒使用说明进行操作。采用qNano ATS粒度分析仪(加拿大ATS公司)检测外泌体的粒径、分布和浓度,根据仪器说明书的标准流程进行检测。
1.4 外泌体中miR-21水平的检测应用血清/血浆外泌体RNA分离试剂盒(exoRNeasy Serum/Plasma Maxi Kit;货号:77064,德国Qiagen公司)并严格依照使用说明提取外泌体中的RNA。应用去基因组高效率反转录试剂盒(ReverTra Ace® qPCR RT Master Mix with gDNA Remover;货号:FSQ-301,日本Toyobo公司)对提取的外泌体RNA进行反转录,获得cDNA。采用SYBR法,以β-actin为内参进行qPCR。引物序列:miR-21正义5′-AAC CCG UAG AUC UUG GAU CCU G-3′,反义5′-CAA GAU CAU CUA CGG UUU GGG U-3′;β-actin正义5′-CTC CAT CCT GGC CTC GCT GT-3′,反义5′-GCT GTC ACC TTC ACC GTT CC-3′。应用2-∆∆Ct法计算miR-21的相对表达量。
1.5 肺功能检测采用MS-PFT型肺功能测试仪(德国耶格公司)测定并记录所有研究对象的肺功能,所得主要参数为FEV1%Pred。
1.6 统计学处理应用SPSS 22.0软件对数据进行分析。计量资料以x±s表示,多组间比较用单因素方差分析,组间两两比较采用LSD-t检验。血清外泌体中miR-21表达水平与哮喘严重程度的相关性分析采用Spearman相关分析。通过受试者工作特征(receiver operating characteristic,ROC)曲线评价外泌体中miR-21表达水平对哮喘严重程度的诊断效能。检验水准(α)为0.05。
2 结果 2.1 研究对象一般资料健康对照组年龄(41.00±3.25)岁,男48例、女32例。间歇状态、轻度持续、中度持续、重度持续哮喘患者的年龄分别为(42.15±2.86)、(42.31±2.13)、(41.92±3.67)、(42.23±2.91)岁,男女患者分别为14例和6例、14例和8例、15和7例、10例和8例。各组年龄、性别、吸烟史、家族史及过敏性鼻炎病史的差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 1各组研究对象一般资料 Tab 1 Characteristics of subjects in each group |
2.2 外泌体鉴定
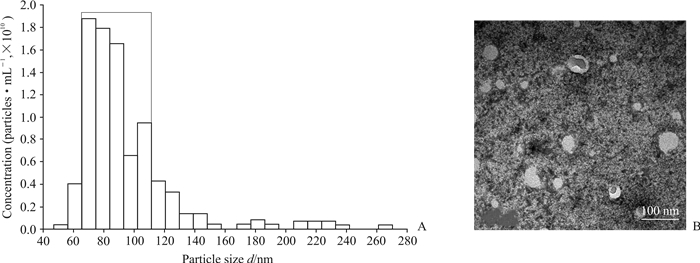
采用qNano ATS粒度分析仪对单一粒子的粒径、分布和浓度进行分析并计数,发现抽提获得的囊泡粒径主要分布在70~110 nm,符合外泌体粒径范围(30~200 nm[5]),见图 1A。电子显微镜下可见抽提获得的囊泡大小较均匀,多数粒径略小于100 nm,与粒度分析仪测量结果相似,并呈现外泌体典型的茶托形特征,见图 1B。
|
图 1 外泌体鉴定结果 Fig 1 Characterization of isolated exosomes A: Particle size distribution of exosomes (the diameter was ranged in the rectangular box); B: Exosomes under electron microscope |
2.3 各组血清外泌体中miR-21水平比较
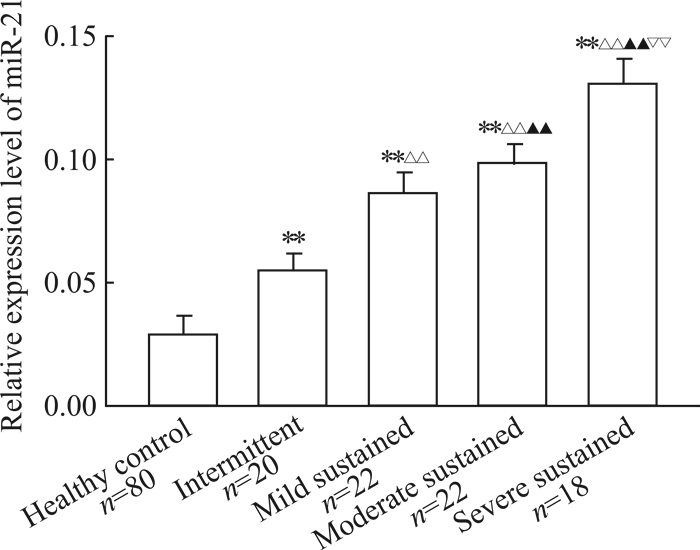
治疗前不同严重程度(间歇状态、轻度持续、中度持续和重度持续)哮喘患者的血清外泌体中miR-21表达水平均高于健康对照组,且差异均有统计学意义(P均<0.01),哮喘患者各组间血清外泌体中miR-21水平差异也有统计学意义(P均<0.01),见图 2。Spearman相关分析结果显示,血清外泌体中miR-21的相对表达量与哮喘严重程度呈正相关(r=0.974,P=0.016 7)。
|
图 2 各组血清外泌体中miR-21表达水平 Fig 2 Expression levels of miR-21 of serum exosomes in each group **P < 0.01 vs healthy control group; △△P < 0.01 vs intermittent group; ▲▲P < 0.01 vs mild sustained group; ▽▽P < 0.01 vs moderate stustained group. x±s |
2.4 血清外泌体中miR-21诊断效能的评估
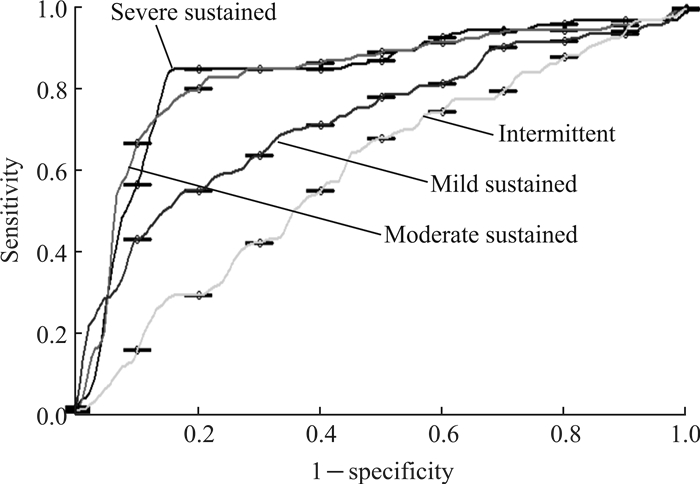
血清外泌体中miR-21对间歇状态、轻度持续、中度持续、重度持续哮喘患者诊断效能的ROC曲线下面积分别为0.657、0.769、0.847、0.916(P均<0.01,图 3)。说明哮喘患者的病情越严重,血清外泌体中miR-21水平对其诊断的特异度越高。
|
图 3 血清外泌体中miR-21诊断不同严重程度哮喘的ROC曲线 Fig 3 ROC curve of miR-21 in serum exosomes for diagnosing different severities of asthma ROC: Receiver operating characteristic |
3 讨论
近年来,我国哮喘的发病率逐年上升,已经成为一种严重威胁公众健康的常见多发呼吸系统疾病。外泌体由免疫细胞和非免疫细胞分泌,可运输和传递大量的蛋白质、脂质和核酸,参与细胞间通讯,还能修饰细胞和器官功能。其组成因细胞起源和细胞的生理状态而不同,通过测定外泌体中核酸种类和数量可反映该外泌体来源器官、组织、细胞的病变情况。因此,外泌体越来越被认同为有望成为疾病新的生物标志物。外泌体在哮喘发病过程中的作用也日益引起重视。最近有学者研究显示,在过敏原刺激之前和之后,可以在过敏性哮喘患者的诱导痰中检测到含RNA的外泌体[13],因此,生物体液中的外泌体特异性RNA和免疫相关蛋白可能可以作为哮喘的生物标志物,并可以由此发展新型的无创性诊断模式。作为一种非编码单链小分子RNA,miR-21可通过抑制IL12p35基因表达,使IL-12水平下降进而诱发哮喘发作,这可能是哮喘的发生机制之一[14],因而血清外泌体中miR-21可能具有一定的临床诊断价值。
本研究结果显示,血清外泌体中miR-21对哮喘的严重程度有较高的诊断效能,哮喘病情越严重,miR-21的表达水平越高。因此,血清外泌体中miR-21水平作为一种无创性检测指标,有望成为哮喘诊断的新型分子标志物以及对哮喘病情严重程度进行准确分级的更为合理的评估标准,并有望用于指导临床治疗哮喘时药物使用的剂量和频率。
| [1] |
LAI C K, KO F W, BHOME A, DE GUIA T S, WONG G W, ZAINUDIN B M, et al. Relationship between asthma control status, the Asthma Control TestTM and urgent health-care utilization in Asia[J]. Respirology, 2011, 16: 688-697. DOI:10.1111/res.2011.16.issue-4 |
| [2] |
苏楠, 吴昌归, 林江涛, 袁雅冬, 周新, 殷凯生, 等. 全国城区哮喘患者控制现状和疾病认知程度的调查[C]//中华医学会第六届全国哮喘学术会议暨中国哮喘联盟第二次大会论文集, 2008.
|
| [3] |
中华医学会呼吸病学分会哮喘学组. 支气管哮喘防治指南[J]. 中华结核和呼吸杂志, 2008, 31: 177-185. DOI:10.3321/j.issn:1001-0939.2008.03.007 |
| [4] |
LIARD R, LEYNAERT B, ZUREIK M, BEGUIN F X, NEUKIRCH F. Using Global Initiative for Asthma guidelines to assess asthma severity in populations[J]. Eur Respir J, 2000, 16: 615-620. DOI:10.1034/j.1399-3003.2000.16d08.x |
| [5] |
DOLDÁN X, FAGÚNDEZ 1, CAYOTA A, LAÍZ J, TOSAR J P. Electrochemical sandwich immunosensor for determination of exosomes based on surface marker-mediated signal amplification[J]. Anal Chem, 2016, 88: 10466-10473. DOI:10.1021/acs.analchem.6b02421 |
| [6] |
HARRIS D A, PATEL S H, GUCEK M, HENDRIX A, WESTBROEK W, TARASKA J W. Exosomes released from breast cancer carcinomas stimulate cell movement[J/OL]. PLoS One, 2015, 10: e117495. doi: 10.1371/journal.pone.0117495.
|
| [7] |
白丰玺, 潘珏. 外泌体与肺疾病的研究现状[J]. 国际呼吸杂志, 2015, 5: 629-632. DOI:10.3760/cma.j.issn.1673-436X.2015.08.016 |
| [8] |
MUNITZ A, KARO-ATAR D, FOSTER P S. Asthma diagnosis:microRNAs to the rescue[J]. J Allergy Clin Immunol, 2016, 137: 1447-1448. DOI:10.1016/j.jaci.2016.02.013 |
| [9] |
ROŻALSKI M, RUDNICKA L, SAMOCHOCKI Z. MiRNA in atopic dermatitis[J]. Postepy Dermatol Alergol, 2016, 33: 157-162. |
| [10] |
LEVÄNEN B, BHAKTA N R, TORREGROSA PAREDES P, BARBEAU R, HILTBRUNNER S, POLLACK J L, et al. Altered microRNA profliles in bronehoalveolar lavage fluid exosomes in asthmatic patients[J]. J Allergy Clin Immunol, 2013, 131: 894-903. DOI:10.1016/j.jaci.2012.11.039 |
| [11] |
WU X B, WANG M Y, ZHU H Y, TANG S Q, YOU Y D, XIE Y Q. Overexpression of microRNA-21 and microRNA-126 in the patients of bronchial asthma[J]. Int J Clin Exp Med, 2014, 7: 1307-1312. |
| [12] |
邬超, 陈丽萍, 王慧琴, 王文艺, 杨晓红. 难治性哮喘患者血浆中miR-21和miR-126的表达及意义[J]. 国际呼吸杂志, 2017, 37: 886-889. DOI:10.3760/cma.j.issn.1673-436X.2017.12.002 |
| [13] |
SÁNCHEZ-VIDAURRE S, ELDH M, LARSSEN P, DAHAM K, MARTINEZ-BRAVO M J, DAHLÉN S E, et al. RNA-containing exosomes in induced sputum of asthmatic patients[J]. J Allergy Clin Immunol, 2017, 140: 1459-1461. DOI:10.1016/j.jaci.2017.05.035 |
| [14] |
LU T X, MUNITZ A, ROTHENBERG M E. MicroRNA-21 is up-regulated in allergic airway inflammation and regulates IL-12p35 expression[J]. J Immunol, 2009, 182: 4994-5002. DOI:10.4049/jimmunol.0803560 |
 2018, Vol. 39
2018, Vol. 39


