2. 海军军医大学(第二军医大学)基础医学院组织胚胎学教研室, 上海 200433
2. Department of Histology and Embryology, College of Basic Medical Sciences, Navy Medical University(Second Military Medical University), Shanghai 200433, China
骨不连或骨折延迟愈合给骨折患者带来极大的痛苦与不便[1],促进骨再生、骨质生成和钙化在骨缺损修复中十分重要[2]。研究证明,间充质干细胞(mesenchymal stem cell,MSC)可促进骨组织再生[3],但是干细胞的临床应用受到体内安全性和临床制剂稳定性等因素的制约。外泌体作为一类由自体细胞分泌的纳米级囊泡样小体,参与细胞及内环境之间的物质运输和信号传递,并在细胞间通讯、器官间的联系和组织稳态中发挥重要作用[4]。干细胞分泌的外泌体因其成分稳定、安全隐患小,在组织再生领域受到关注[5]。已有研究报道外泌体可用于刺激组织再生(如肝细胞的再生[6])以及治疗疾病(如肺动脉高压小鼠模型[7])。研究发现MSC条件培养液能有效刺激骨再生[8],而MSC产生的外泌体也会分泌到条件培养液中,单独使用外泌体能否刺激骨再生尚不清楚。本研究探讨人脐带间充质干细胞(human umbilical cord mesenchymal stem cell,hucMSC)分泌的外泌体在骨再生中的潜在作用及其可能的机制,以探索促进骨缺损修复更有价值的方法。
1 材料和方法 1.1 实验动物SD大鼠12只,雄性,6~8周龄,体质量200~300 g,由上海斯莱克实验动物有限责任公司提供,许可证号:SCXK(沪)2017-0005。大鼠饲养于海军军医大学(第二军医大学)实验动物中心,饲养条件为清洁级环境,饲养间温度(20±2)℃,相对湿度(60±10)%,12 h光照/12 h黑暗,自由饮水、进食,饲料检测合格(检测内容为粗蛋白、粗灰分、水分、钙、总磷)。实验前适应性饲养1周,并记录大鼠的行为活动、饮食、体质量及精神状况。
1.2 大鼠胫骨骨折模型的建立使用4 mL/kg 4%水合氯醛腹腔注射麻醉大鼠后,取仰卧位固定于操作台上,双上肢、右下肢固定,左下肢未固定。在左下肢膝关节下切开约1 cm纵行切口,分离肌肉与筋膜,在胫骨粗隆下方约5 mm处使用牙科锯锯断胫骨骨干,由髌腱处将规格为0.88 mm的克氏针完全插入并对合骨折端,逐层缝合切口,构建大鼠左侧胫骨骨折模型。术后于清洁环境下单笼饲养,温度22~24 ℃,相对湿度60%,定期紫外线消毒与排风。常规给水及饮食,大鼠可自由活动。
1.3 hucMSC原代培养人脐带取自海军军医大学(第二军医大学)长海医院,并通过长海医院伦理委员会审查批准。按照标准程序体外原代培养hucMSC。将脐带用DMEM培养液[国科东方(上海)贸易有限公司]清洗,清除残余血液。用70%乙醇洗净后,切碎成2~4 mm小块,在37 ℃条件下于DMEM培养液孵育。当hucMSC融合度达80%时,经胰蛋白酶处理后传代培养。此后,每3 d更换1次新鲜培养液。第3~5代的hucMSC用于实验。
1.4 外泌体抽提收集hucMSC,按照标准的外泌体抽提方法抽提外泌体[9]。分离前4 ℃ 126 000×g离心3 h去除宿主外泌体。每2 d收集1次培养上清,将收集的培养上清转移到锥形离心管,4 ℃300×g离心10 min,收集上清。再次4 ℃ 16 500×g离心20 min,进一步去除细胞碎片。上清液经0.22 μm的滤器过滤,然后将滤液转移到新的离心管,4 ℃ 126 000×g离心150 min。将上清转移到新的离心管中用于hucMSC-上清组,管壁上的沉淀用100 μL磷酸盐缓冲液(phosphate buffer solution,PBS)重悬用于hucMSC-外泌体组,并转移到1.5 mL离心管中。
1.5 外泌体治疗将12只成功构建骨折模型的SD大鼠随机分为3组,每组4只,分别为空白对照组、hucMSC-外泌体组和hucMSC-上清组。以HYSTEM-HP水凝胶(货号GS315,美国Glycosan BioSystems公司)作为递送外泌体的载体[10]。依照说明书,在50 μL PBS中加入100 μg外泌体与100 μL水凝胶混合。骨折术后7 d,空白对照组用100 μL水凝胶+50 μL PBS处理;hucMSC-外泌体组用100 μL水凝胶+100 μg外泌体处理;hucMSC-上清组用100 μL水凝胶+50 μL去外泌体上清处理。经皮在骨折断端处注射水凝胶至骨髓腔。术后大鼠继续单笼饲养,可自由活动。
1.6 Micro-CT扫描和骨组织切片H-E染色观察注入外泌体3周后,麻醉大鼠,行micro-CT(上海赛新生物科技有限公司)活体扫描。然后处死大鼠,取左下肢胫骨,以骨折断端为中心向两端各取0.5 cm骨组织标本,在4%多聚甲醛溶液中固定、脱钙、梯度乙醇脱水、石蜡包埋、切片,切片厚度10 μm,H-E染色,于显微镜下观察骨组织断端的愈合情况并拍照。
1.7 qPCR检测成骨标志基因的表达水平取骨折断端周围骨组织100 mg,利用EASYspin Plus骨组织RNA快速提取试剂盒(杭州昊鑫生物科技有限公司)提取总RNA。采用反转录PCR快速试剂盒(RT-PCR Quick Master Mix,日本Toyobo公司)进行反转录。以β-actin为内参照基因,使用高效率荧光定量PCR试剂盒(KOD SYBR qPCR Mix,日本Toyobo公司)进行qPCR,检测骨钙素(osteocalcin,OCN)、骨桥蛋白(osteopontin,OPN)、碱性磷酸酶(alkaline phosphatase,ALP)和Runt相关转录因子2(Runt-related transcription factor 2,Runx-2)的表达水平。引物序列:OCN正义5′-GCC CTC ACA CTC CTC GCC CTA TT-3′,反义5′-GGG TCT CTT CAC TAC CTC GCT GCC-3′;OPN正义5′-ACA GCA TCG TCG GGA CCA GAC TCG T-3′,反义5′-GGT AGT GAG TTT TCC TTG GTC GGC G-3′;ALP正义5′-GGC AGC TTG ACC TCC TCG GAA GAC A-3′,反义5′-AGC ATG GGG GCC AGA CCA AAG ATA G-3′;Runx-2正义5′-CCC CTC CTA CCT GAG CCA GAT GAC G-3′,反义5′-AAG GGC CCA GTT CTG AAG CAC CTG A-3′;β-actin正义5′-CGG GAA ATC GTG CGT GAC AT-3′,反义5′-GGA CTC GTC ATA CTC CTG CTT GC-3′。每个检验指标设3个复孔,用2-ΔΔCt法进行相对定量。
1.8 统计学处理应用SPSS 20.0软件进行统计学分析。计量资料以x±s表示,各组间比较均采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 Micro-CT扫描观察各组大鼠骨折断端的愈合情况3周后对不同组大鼠进行活体micro-CT扫描以观察骨折断端的愈合情况。如图 1所示,空白对照组、hucMSC-上清组大鼠的骨折断端尚未吻合,骨皮质外观不连续,骨折线明显,提示新生骨量少,骨折愈合不明显;hucMSC-外泌体组大鼠的骨折断端对合良好,骨皮质外观较连续,骨折线基本消失,提示新生骨量较多,骨折愈合明显,骨折部位修复较为满意。
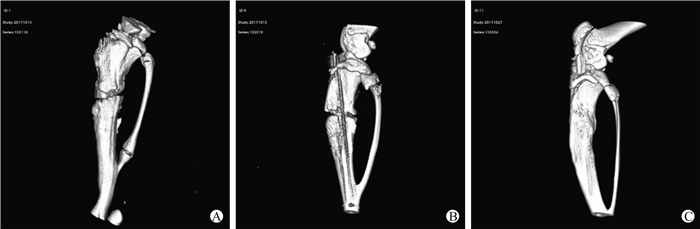
|
图 1 Micro-CT扫描观察各组大鼠骨折断端愈合情况 Fig 1 Healing of bone defect of rats in each group by micro-CT A: Control group; B: hucMSC-supernatant group; C: hucMSC-exosome group. CT: Computed tomography; hucMSC: Human umbilical cord mesenchymal stem cell |
2.2 骨组织切片H-E染色观察各组大鼠骨折断端愈合情况
H-E染色结果显示空白对照组、hucMSC-上清组大鼠的骨折断端骨折线明显,纤维骨痂尚未形成,骨皮质外观不连续,新生骨小梁结构不明显,提示新生骨量较少,骨折愈合不明显;hucMSC-外泌体组大鼠的骨折断端基本消失,形成完整的纤维骨痂结构,其中新生骨小梁结构较多,排列较为规则,提示骨折愈合较好。见图 2。

|
图 2 H-E染色观察各组大鼠骨折断端的愈合情况 Fig 2 Healing of bone defect of rats in each group by H-E staining A: Control group; B: hucMSC-supernatant group; C: hucMSC-exosome group. hucMSC: Human umbilical cord mesenchymal stem cell. Original magnification: ×40 |
2.3 qPCR检测各组大鼠成骨标志基因的表达水平
qPCR检测结果显示,hucMSC-外泌体组大鼠骨组织中OCN、OPN、ALP、Runx-2基因的表达量高于空白对照组和hucMSC-上清组,差异均有统计学意义(P均<0.05)。空白对照组与hucMSC-上清组大鼠上述成骨标志基因的表达差异均无统计学意义(P均>0.05)。见图 3。

|
图 3 qPCR检测各组大鼠成骨标志基因的表达水平 Fig 3 Expression levels of osteogenesis-related genes of rats in each group by qPCR hucMSC: Human umbilical cord mesenchymal stem cell; OCN: Osteocalcin; OPN: Osteopontin; ALP: Alkaline phosphatase; Runx-2: Runt-related transcription factor 2. *P < 0.05 vs control group or hucMSC-supernatant group. n=3, x±s |
3 讨论
本研究通过体内实验研究了hucMSC分泌的外泌体和培养hucMSC的去外泌体上清对SD大鼠胫骨骨折愈合情况的影响,结果发现hucMSC-上清组骨折断端愈合情况与空白对照组相近,骨皮质外观均不连续,尚未愈合;而hucMSC-外泌体组骨折断端骨折线基本消失,骨皮质愈合良好。初步证实,hucMSC分泌的外泌体对骨折愈合有明显的促进作用,这一结果为临床寻找促进骨折愈合的治疗方法提供了新的思路。
细胞可通过释放蛋白质、核酸、脂质等分子到细胞外,与受体结合从而介导经细胞内信号转导[11]。除了这些单分子以外,还有另外一种细胞相互作用模式,即外泌体通过水平转移功能性的信使RNA(messenger RNA,mRNA)、微RNA(microRNA,miRNA)和蛋白质到受体细胞,改变细胞的功能[12]。本研究发现经hucMSC分泌的外泌体处理后骨折大鼠骨组织中OCN、OPN、ALP和Runx-2等成骨标志基因的表达水平均升高,提示hucMSC来源的外泌体可促进成骨细胞的分化和骨形成,进一步促进骨折的愈合[13],但hucMSC分泌的外泌体促进成骨分化和骨形成的促进作用机制尚不清楚,可能与上述细胞相互作用有一定关系。进一步鉴定hucMSC外泌体中的核心功能性成分,特别是miRNA等调控分子的作用,将是我们进一步深入研究的方向。
| [1] |
KIMELMAN BLEICH N, KALLAI I, LIEBERMAN J R, SCHWARZ E M, PELLED G, GAZIT D. Gene therapy approaches to regenerating bone[J]. Adv Drug Deliv Rev, 2012, 64: 1320-1330. DOI:10.1016/j.addr.2012.03.007 |
| [2] |
BHATTACHARYA I, GHAYOR C, WEBER F E. The use of adipose tissue-derived progenitors in bone tissue engineering-a review[J]. Transfus Med Hemother, 2016, 43: 336-343. DOI:10.1159/000447494 |
| [3] |
KUNKEL N, WAGNER A, GEHWOLF R, HEIMEL P, TEMPFER H, KORNTNER S, et al. Comparing the osteogenic potential of bone marrow and tendon-derived stromal cells to repair a critical-sized defect in the rat femur[J]. J Tissue Eng Regen Med, 2017, 11: 2014-2023. DOI:10.1002/term.v11.7 |
| [4] |
RAPOSO G, STOORVOGEL W. Extracellular vesicles:exosomes, microvesicles, and friends[J]. J Cell Biol, 2013, 200: 373-383. DOI:10.1083/jcb.201211138 |
| [5] |
ZHOU Y, XU H, XU W, WANG B, WU H, TAO Y, et al. Exosomes released by human umbilical cord mesenchymal stem cells protect against cisplatin-induced renal oxidative stress and apoptosis in vivo and in vitro[J/OL]. Stem Cell Res Ther, 2013, 4: 34. doi: 10.1186/scrt194.
|
| [6] |
CHEN L, CHARRIER A, ZHOU Y, CHEN R, YU B, AGARWAL K, et al. Epigenetic regulation of connective tissue growth factor by microRNA-214 delivery in exosomes from mouse or human hepatic stellate cells[J]. Hepatology, 2014, 59: 1118-1129. DOI:10.1002/hep.v59.3 |
| [7] |
LEE C, MITSIALIS S A, ASLAM M, VITALI S H, VERGADI E, KONSTANTINOU G, et al. Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension[J]. Circulation, 2012, 126: 2601-2611. DOI:10.1161/CIRCULATIONAHA.112.114173 |
| [8] |
OSUGI M, KATAGIRI W, YOSHIMI R, INUKAI T, HIBI H, UEDA M. Conditioned media from mesenchymal stem cells enhanced bone regeneration in rat calvarial bone defects[J]. Tissue Eng Part A, 2012, 18(13/14): 1479-1489. |
| [9] |
LOBB R J, BECKER M, WEN S W, WONG C S, WIEGMANS A P, LEIMGRUBER A, et al. Optimized exosome isolation protocol for cell culture supernatant and human plasma[J/OL]. J Extracell Vesicles, 2015, 4: 27031. doi: 10.3402/jev.v4.27031.
|
| [10] |
VAN GRIENSVEN M. Preclinical testing of drug delivery systems to bone[J]. Adv Drug Deliv Rev, 2015, 94: 151-164. DOI:10.1016/j.addr.2015.07.006 |
| [11] |
卢婉, 杨人强, 王伶. 外泌体的研究进展[J]. 生命的化学, 2013, 33: 438-442. |
| [12] |
LEE Y, EL ANDALOUSSI S, WOOD M J. Exosomes and microvesicles:extracellular vesicles for genetic information transfer and gene therapy[J]. Hum Mol Genet, 2012, 21(R1): R125-R134. DOI:10.1093/hmg/dds317 |
| [13] |
WEI J, SHIMAZU J, MAKINISTOGLU M P, MAURIZI A, KAJIMURA D, ZONG H, et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation[J]. Cell, 2015, 161: 1576-1591. DOI:10.1016/j.cell.2015.05.029 |
 2018, Vol. 39
2018, Vol. 39


