2. 中南大学湘雅医学院附属海口医院中心实验室, 海口 570203
2. Central Laboratory, Central South University Xiangya School of Medicine Affiliated Haikou Hospital, Haikou 570203, Hainan, China
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种自身免疫性疾病,因T淋巴细胞、B淋巴细胞功能异常产生大量自身抗体,从而导致机体多系统损害[1],其病情反复迁延,需终身治疗,给患者造成巨大痛苦。活化诱导的胞嘧啶核苷脱氨酶(activation-induced cytidine deaminase,AICDA)为DNA/RNA编辑酶,主要表达于活化的生发中心的B淋巴细胞中,在免疫球蛋白基因的类别转换重组(class-switch recombination,CSR)和体细胞超突变(somatic hypermutation,SHM)中发挥重要作用[2-3]。AICDA具有潜在的基因突变活性,是迄今唯一可诱导人类基因组中DNA发生突变的酶,也是启动活性DNA去甲基化和以多能性为方向的重新编程所必需的。研究发现AICDA的异常表达与自身免疫性疾病有关[4]。本研究对SLE患者肾组织中AICDA的表达水平进行检测,旨在探讨AICDA与SLE患者肾炎发生和发展的关系,为SLE的诊治提供新思路。
1 对象和方法 1.1 研究对象纳入2013年3月至2017年6月于中南大学湘雅医学院附属海口医院就诊的SLE患者73例,男性6例、女性67例。所有患者均符合2009年系统性红斑狼疮国际临床合作组与美国风湿病学会(Systemic Lupus International Collaborating Clinic/American College of Rheumatology,SLICC/ACR)SLE分类标准[5],并按照SLE疾病活动度评分(SLEDAI)标准进行评分: 0~4分为基本无活动,5~9分为轻度活动,10~14分为中度活动,≥15分为重度活动。患者入院前6个月为诱导期治疗,治疗方案选择糖皮质激素联合免疫抑制剂(环磷酰胺、吗替麦考酚酯或环孢素A),治疗6个月内患者24 h尿蛋白定量<0.5 g视为完全缓解。纳入同期于中南大学湘雅医学院附属海口医院就诊的36例原发性膜性肾病(Ⅱ期)患者作为对照组,男性15例、女性21例。两组患者均无感染、肿瘤病史。收集两组患者的基本资料,包括年龄、血压、血清肌酐、24 h尿蛋白定量等,并行肾脏组织病理检查。
1.2 方法 1.2.1 肾脏组织病理检查取患者肾穿刺活组织切片常规脱蜡至水化,切片厚3~4 μm,分别行H-E染色、PAS(periodic acid-Schiff)染色、PASM(periodic acid-silver methenamine)染色和马松三色(Masson’s trichrome)染色,后均行苏木精复染,观察细胞核染色情况。参照国际肾脏学会/肾脏病理学会(International Society of Nephrology/Renal Pathology Society,ISN/RPS)2003年分类标准[6]将SLE患者狼疮肾炎(lupus nephritis,LN)分为6型:Ⅰ型为轻微病变性LN,Ⅱ型为系膜增生性LN,Ⅲ型为局灶性LN,Ⅳ型为弥漫性LN,Ⅴ型为膜性LN,Ⅵ型为终末硬化性LN。
1.2.2 免疫组织化学染色检测肾脏组织中AICDA表达抗AICDA抗体-ChIP Grade购于美国Abcam公司(ab59361)。取患者肾组织切片行免疫组织化学SP两步法染色,用磷酸盐缓冲液(phosphate buffer solution,PBS)代替一抗作为阴性对照。将标本置于80 ℃烤箱中烤片30 min;然后脱水、水化,140 ℃高压蒸汽枸橼酸缓冲液修复,3%过氧化氢溶液灭活内源性过氧化物酶;PBS洗3次,加一抗,4 ℃过夜;PBS洗3次,加二抗。DAB工作液室温显色,镜下观察,苏木精复染,1%盐酸乙醇分化、流水冲、梯度乙醇脱水、松节油透明,中性树胶封固。由2位病理科医师在不知道病例资料的情况下独立完成阅片,评判结果不一致(有分歧的样本为总样本的1%)时重新进行评估,直至2位医师意见一致。免疫组织化学评分评定结果参照Dorudi判读标准[7]:以细胞质或细胞膜棕黄色颗粒状沉积为阳性,先按阳性细胞比例将0%、1%~25%、26%~50%、51%~75%、76%~100%分别计为0~4分;再按染色强度将无、弱、中、强分别计为0~3分,其中不着色0分、黄色1分、棕黄色2分、黄褐色3分;最后两部分得分相乘即为总分,总分最高为12分,分数越高表明表达越强。
1.3 统计学处理应用SPSS 20. 0软件进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用F检验。检验水准(α)为0.05。
2 结果 2.1 一般资料SLE组与对照组患者的年龄、收缩压、舒张压、血清肌酐、24 h尿蛋白定量差异均无统计学意义(P>0.05),具有可比性。见表 1。
|
|
表 1 SLE组与对照组患者的一般资料比较 |
2.2 两组患者肾脏组织中AICDA表达的比较
免疫组织化学染色结果(图 1)显示,AICDA主要表达于肾脏远曲肾小管上皮细胞的细胞质和细胞膜中。SLE组患者肾组织中AICDA的表达水平高于对照组,差异有统计学意义(6.12±2.47 vs 3.33±1.91,P<0.05)。
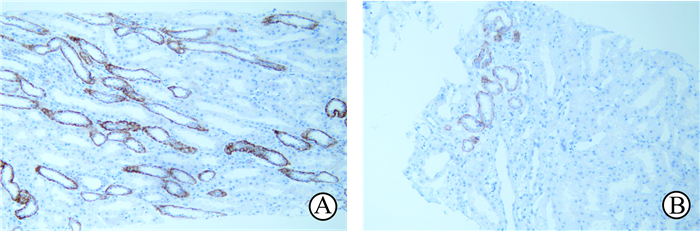
|
图 1 患者肾脏组织中AICDA免疫组织化学染色结果 A: SLE组(Ⅳ型LN); B:对照组(Ⅱ期原发性膜性肾病). AICDA:活化诱导的胞嘧啶核苷脱氨酶; SLE:系统性红斑狼疮; LN:狼疮肾炎. Original magnification: ×200 |
2.3 各型LN患者肾脏组织中AICDA表达的比较
73例SLE患者中Ⅲ型LN 8例、Ⅳ型25例、Ⅴ型10例、Ⅲ+Ⅴ型12例、Ⅳ+Ⅴ型18例,无Ⅰ、Ⅱ、Ⅵ型病例。Ⅲ型(5.25±4.06)、Ⅳ型(6.88±2.20)、Ⅴ型(6.10±1.66)、Ⅲ+Ⅴ型(5.75±2.34)、Ⅳ+Ⅴ型(5.72±2.37)LN患者间肾组织中AICDA的表达水平差异均无统计学意义(P均>0.05)。
2.4 SLE患者各系统损害与肾脏组织中AICDA表达的关系SLE患者表现为多脏器受累,其中口腔溃疡50例(68.5%)、间质性肺炎29例(39.7%)、神经系统损害12例(16.4%)、关节炎59例(80.8%)、血液系统损害46例(63.0%)、浆膜炎27例(37.0%)。比较各系统受损与未受损SLE患者肾组织中AICDA的表达水平可见,发生口腔溃疡、间质性肺炎、神经系统损害、关节炎、血液系统损害和浆膜炎的患者肾组织中AICDA的表达水平均分别高于无上述系统损害者(P均<0.01)。见表 2。
|
|
表 2 SLE患者系统损害与肾脏组织中AICDA表达的关系 |
2.5 SLEDAI与AICDA表达的关系
73例SLE患者中SLEDAI≥15分者23例,10~14分者36例,≤9分者14例。SLEDAI≥15分、10~14分、≤9分SLE患者肾组织中AICDA的表达水平依次为9.12±1.88、6.21±1.05、3.37±0.51;SLEDAI越高,AICDA表达越强,组间差异有统计学意义(F=43.44,P<0.01)。
2.6 治疗转归与AICDA表达的关系经诱导期治疗后,完全缓解52例、未完全缓解21例。完全缓解患者肾组织中AICDA的表达(5.84±2.39)低于未完全缓解患者(6.80±2.56),但差异无统计学意义(P>0.05)。
3 讨论SLE是一种系统性自身免疫性疾病,其主要特征为T淋巴细胞和B淋巴细胞的活性失调,随后引起循环B淋巴细胞的多克隆活化,进而产生大量自身抗体[1]。免疫系统通过有效的机制以有限数量的免疫球蛋白防御大量病原体,为产生不同种类的抗体,B淋巴细胞经历了一系列基因改变。当B淋巴细胞遇到与之相应的抗原时,活化的B淋巴细胞会在免疫球蛋白基因组中启动第2次多样化进程,包括CSR和SHM。虽然CSR和SHM的发生机制不同,但它们都由AICDA介导[2-3]。
正常生理情况下AICDA的转录仅限于活化生发中心的B淋巴细胞,当机体受到炎性因子刺激或病原体感染时,可诱导宿主细胞中的AICDA异位表达或过度表达,引起基因突变,进而导致肿瘤发生和转移[8-9]。此外,一些病毒可在AICDA的作用下发生超过体内抗体亲和力增强速度的高突变,继而直接导致获得性免疫系统的“超载”。同时,AICDA诱导的变异将对自身免疫反应产生负调控,造成免疫功能的紊乱或瘫痪[10]。
缺乏AICDA个体的CSR和SHM过程均会受到不同程度的影响,产生免疫缺陷临床综合征的表现。Chen等[11]研究了AICDA与鼠类狼疮之间的关系,发现相比AICDA感受态小鼠,AICDA缺陷小鼠产生显著高水平的免疫球蛋白M自体反应性抗体,且易患严重的肾小球肾炎和脾肿大,证明AICDA缺乏促进了系统性自身免疫现象,AICDA在鼠类狼疮的系统性自身免疫现象中起重要的负调控作用。Quartier等[12]研究结果显示,AICDA缺陷患者不仅容易发生感染,而且易患淋巴样组织增生、自身免疫性疾病和炎症反应性疾病,他们在研究中发现21%的AICDA缺陷患者出现自身免疫性疾病,包括类风湿性关节炎、自身免疫性肝病和克罗恩病。Guerrier等[13]的研究发现在4例原发性干燥综合征患者的唾液腺B淋巴细胞中可检测到与扁桃腺B淋巴细胞生发中心相似的AICDA mRNA表达,为原发性干燥综合征的治疗提供了新思路。Kuraoka等[14]发现骨髓幼稚B淋巴细胞中低水平的AICDA能抑制自身反应性抗体,该研究结果显示AICDA缺乏小鼠血清中的自身抗体水平显著升高,且初始B淋巴细胞中自身反应性的净化容量降低。因此,试图以限定AICDA功能来治疗免疫性疾病的策略应当谨慎。研究显示与AICD+/+ MRL/lpr狼疮小鼠和AICD+/- MRL/lpr狼疮小鼠相比,AICD-/- MRL/lpr狼疮小鼠的生存率增加、LN发生率降低,且炎性细胞浸润等病变程度减轻[15]。提取AICD-/-MRL/lpr小鼠的血清注射到无症状MRL/lpr小鼠体内,结果发现MRL/lpr小鼠的蛋白尿和免疫复合物沉积水平均减少[16],提示AICD-/-MRL/lpr小鼠血清中可能存在某种保护因子阻止LN的发生。目前,有关AICDA与SLE关系的研究主要集中在动物实验,未见以人为对象的研究报道。
本研究发现SLE和原发性膜性肾病患者肾组织中均存在AICDA的异常表达,且SLE患者肾组织中AICDA的表达水平高于原发性膜性肾病患者,提示AICDA的表达与SLE的发病有关。SLEDAI越高,AICDA表达越强,提示AICDA的表达与SLE疾病活动度有关。本研究中完全缓解SLE患者肾组织中AICDA的表达较未缓解患者低,但差异无统计学意义(P>0.05),因此不能确定AICDA的表达与SLE预后有关,可能与本研究随访时间较短有关。此外,本研究发现出现血液系统损害SLE患者肾组织中AICDA的表达水平高于未出现者,差异有统计学意义(P<0.01)。目前针对AICDA的研究主要集中在淋巴瘤方面,在各种人淋巴瘤和白血病患者中常见AICDA高表达[17]。AICDA高表达可诱导C-Myc IgH基因双链断裂,同时减弱细胞的检查和修复机制(如抑制TP53通路的形成),从而增加染色体异位频率,诱导霍奇金淋巴瘤的发生[17],但其是否也通过该机制影响SLE患者的血液系统还需进一步研究。此外,有口腔溃疡、间质性肺炎、神经系统损害、关节炎和浆膜炎的SLE患者肾组织中AICDA的表达水平也分别高于无上述系统损害者,但机制未明,推断可能与AICDA通过某种机制影响自身免疫抗体沉积有关。
综上所述,本研究提示AICDA与SLE的发生和发展有关。但因本研究属回顾性研究,未能对患者初发病时的血清学标志物进行检测,尚不能明确AICDA参与SLE发病的确切机制,其确切机制有待进一步研究。
| [1] |
HEINLEN L D, MCCLAIN M T, MERRILL J, AKBARALI Y W, EDGERTON C C, HARLEY I B, et al. Clinical criteria for systemic lupus erythematosus precede diagnosis, and associated autoantibodies are present before clinical symptoms[J]. Arthritis Rheum, 2010, 56: 2344-2351. |
| [2] |
METHOT S P, DI NOIA J M. Molecular mechanisms of somatic hypermutation and class switch recombination[J]. Adv Immunol, 2017, 133: 37-87. DOI:10.1016/bs.ai.2016.11.002 |
| [3] |
WEDEKIND J E, DANCE G S, SOWDEN M P, SMITH H C. Messenger RNA editing in mammals:new members of the APOBEC family seeking roles in the family business[J]. Trends Genet, 2003, 19: 207-216. DOI:10.1016/S0168-9525(03)00054-4 |
| [4] |
FRANCHINI D M, PETERSENMAHRT S K. AID and APOBEC deaminases:balancing DNA damage in epigenetics and immunity[J]. Epigenomics, 2014, 6: 427-443. DOI:10.2217/epi.14.35 |
| [5] |
PETRI M. SLICC Revision of the ACR Classification Criteria for SLE[J]. Arthritis Rheum, 2009, 60: 895. |
| [6] |
WEENING J J, D'AGATI V D, SCHWARTZ M M, SESHAN S V, ALPERS C E, GERALD B, et al. The classification of glomerulonephritis in systemic lupus erythematosus revisited[J]. Kidney Int, 2004, 65: 521-530. DOI:10.1111/j.1523-1755.2004.00443.x |
| [7] |
DORUDI S, SHEFFIELD J P, POULSOM R, NORTHOVER J M, HART I R. E-cadherin expression in colorectal cancer. An immunocytochemical and in situ hybridization study[J]. Am J Pathol, 1993, 142: 981-986. |
| [8] |
ZHANG H, YANG B, POMERANTZ R J, ZHANG C, ARUNACHALAM S C, GAO L. The cytidine deaminase CEM15 induces hypermutation in newly synthesized HIV-1 DNA[J]. Nature, 2003, 424: 94-98. DOI:10.1038/nature01707 |
| [9] |
HARDIANTI M S, TATSUMI E, SYAMPURNAWATI M, FURUTA K, SUZUKI A, SAIGO K, et al. Presence of somatic hypermutation and activation-induced cytidine deaminase in acute lymphoblastic leukemia L2 with t (14;18)(q32;q21)[J]. Eur J Haematol, 2015, 74: 11-19. |
| [10] |
HAO F, TIAN M, FENG Y, QUAN C, CHEN Y, CHEN S, et al. Abrogation of lupus nephritis in somatic hypermutation-deficient MRL/lpr mice[J]. J Immunol, 2018, 200: 3905-3912. DOI:10.4049/jimmunol.1800115 |
| [11] |
CHEN L, GUO L, TIAN J, ZHENG B, HAN S. Deficiency in activation-induced cytidine deaminase promotes systemic autoimmunity in lpr mice on a C57BL/6 background[J]. Clin Exp Immunol, 2010, 159: 169-175. DOI:10.1111/cei.2010.159.issue-2 |
| [12] |
QUARTIER P, BUSTAMANTE J, SANAL O, PLEBANI A, DEBRÉ M, DEVILLE A, et al. Clinical, immunologic and genetic analysis of 29 patients with autosomal recessive hyper-IgM syndrome due to activation-induced cytidine deaminase deficiency[J]. Clin Immunol, 2004, 110: 22-29. DOI:10.1016/j.clim.2003.10.007 |
| [13] |
GUERRIER T, LE POTTIER L, DEVAUCHELLE V, PERS J O, JAMIN C, YOUINOU P. Role of Toll-like receptors in primary Sjögren's syndrome with a special emphasis on B-cell maturation within exocrine tissues[J]. J Autoimmun, 2012, 39: 69-76. DOI:10.1016/j.jaut.2012.01.016 |
| [14] |
KURAOKA M, HOLL T M, LIAO D, WOMBLE M, CAIN D W, REYNOLDS A E, et al. Activation-induced cytidine deaminase mediates central tolerance in B cells[J]. Proc Natl Acad Sci USA, 2011, 108: 11560-11565. DOI:10.1073/pnas.1102571108 |
| [15] |
JIANG C, FOLEY J, CLAYTON N, KISSLING G, JOKINEN M, HERBERT R, et al. Abrogation of lupus nephritis in activation-induced deaminase-deficient MRL/lpr mice[J]. J Immunol, 2007, 178: 7422-7431. DOI:10.4049/jimmunol.178.11.7422 |
| [16] |
JIANG C, ZHAO M L, SCEARCE R M, DIAZ M. Activation-induced deaminase-deficient MRL/lpr mice secrete high levels of protective antibodies against lupus nephritis[J]. Arthritis Rheum, 2014, 63: 1086-1096. |
| [17] |
CHIARLE R, ZHANG Y, FROCK R L, LEWIS S M, MOLINIE B, HO Y J, et al. Genome-wide translocation sequencing reveals mechanisms of chromosome breaks and rearrangements in B cells[J]. Cell, 2011, 147: 107-119. DOI:10.1016/j.cell.2011.07.049 |
 2018, Vol. 39
2018, Vol. 39


