2. 上海中医药大学中药学院, 上海 201203;
3. 上海市浦东新区人民医院药剂科, 上海 201299
2. College of Chinese Materia Medica, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China;
3. Department of Pharmacy, People's Hospital of Shanghai Pudong New Area, Shanghai 201299, China
乳腺癌是女性最常见的恶性肿瘤,发病率高居女性恶性肿瘤之首,严重威胁女性的身心健康[1]。根据基因谱和分子生物学特征,可将乳腺癌分为4个主要亚型:luminal A、luminal B、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性及三阴型。目前,乳腺癌的治疗主要是外科手术结合放射治疗、化学治疗、内分泌治疗和靶向药物治疗[2]。乳腺癌的化疗药物包括蒽环类、紫杉醇类、顺铂、烷化剂等,这类药物杀伤肿瘤细胞的选择性较差,对机体的毒副作用大,因此其临床应用受到很大程度的限制[3];内分泌治疗药物主要包括雌激素受体拮抗剂(三苯氧胺)和芳香化酶抑制剂(来曲唑、阿那曲唑、依西美坦等),服药后患者体内的雌激素水平下降,出现的一系列不良反应严重影响患者的生活质量[4];分子靶向药物如曲妥珠单抗的选择性较强,仅对HER2阳性的乳腺癌细胞效果明显,但价格昂贵,且肿瘤细胞易对其产生耐药性[5]。化疗是目前常用的治疗手段,但迄今仍无公认的最佳化疗方案。由此可见,目前对乳腺癌患者的治疗仍缺乏理想的药物,亟待开发药理作用明确、毒副作用小的新药。
中药狼毒为大戟科大戟属植物月腺大戟(Euphorbia ebracteolata Hayata)的根,植物资源丰富,分布广泛。近年研究表明,中药狼毒含有多种活性成分,这些成分不仅拥有特殊结构,而且具有明显的抗结核杆菌、抗肿瘤等作用[6]。本课题组前期从狼毒药材中分离出一种乙酰间苯三酚类化合物月腺大戟素A,本研究拟通过乳腺癌模型评价其抗乳腺癌的生物活性。
1 材料和方法 1.1 仪器100级超洁净工作台(苏州安泰空气技术有限公司);二氧化碳培养箱(美国Thermo Fisher Scientific公司);XDS-200型倒置显微镜(上海蔡康光学仪器有限公司);Micro 17型微量高速离心机(美国Thermo Fisher Scientific公司);Mettler AE240型十万分之一电子天平(瑞士Mettler Toledo公司);Heal Force SMART-N型超纯水机(香港力康生物医疗科技控股有限公司);Multiskan MK3型全自动酶标仪(美国Thermo Fisher Scientific公司);FACSCaulibur流式细胞仪(美国BD公司);Bruker AVANCE Ⅲ 600型高分辨核磁共振波谱仪系统(德国Bruker公司);Agilent 1260型高效液相色谱仪、Agilent 6220型飞行时间质谱仪(美国Agilent Technologies公司)。
1.2 试剂与药品0.25%胰蛋白酶-EDTA消化液,Ham’s F12、DMEM、RPMI 1640培养基,胎牛血清、青霉素、链霉素均购于美国Corning公司;二甲亚砜(DMSO)购于美国Sigma-Aldrich公司;其他试剂为市售分析纯。紫杉醇购于德国Fine Science公司(批号:Y18Y03Y26)。中药狼毒饮片购于安徽(产地:山东,批号:20140811),经海军军医大学(第二军医大学)药学院生药学教研室的韩婷副教授鉴定为大戟科大戟属植物月腺大戟的干燥根。
1.3 实验动物与细胞BALB/c裸鼠36只,雌性、4周龄、体质量约20 g,由海军军医大学(第二军医大学)实验动物中心提供,动物许可证号为SCXK(沪)2013-0016;人乳腺癌细胞系SUM149(三阴型)、MCF-7(luminal A型)、ZR-75-1(luminal B型)、SK-BR-3(HER2阳性型)均购于美国模式菌种收集中心(ATCC)。
1.4 月腺大戟素A的制备取30 kg干燥狼毒药材,用100 L 80%乙醇回流提取2次,每次2 h,趁热过滤,合并提取液,浓缩至无乙醇残留(浓缩体积至8 L)。取2 L浓缩液加1 L水稀释,乙酸乙酯每次萃取体积均为3 L,减压回收溶剂,乙酸乙酯部分160 g。乙酸乙酯部分过正相硅胶柱,以石油醚︰乙酸乙酯(20︰1)洗脱,得洗脱物。过正相柱,石油醚︰乙酸乙酯︰甲酸(15︰1︰0.1)洗脱,得单一化合物,通过质谱(MS)和核磁共振(NMR)谱测定其结构。
1.5 细胞培养SUM149细胞培养基:Ham’s F12培养基,含0.4%庆大霉素、0.2%氢化可的松、0.5%胰岛素和5%胎牛血清。MCF-7细胞培养基:DMEM培养基,含10%胎牛血清。ZR-75-1细胞培养基:RPMI 1640培养基,含0.4%庆大霉素和10%胎牛血清。SK-BR-3细胞培养基:RPMI 1640培养基,含10%胎牛血清。以上4种培养基均含有100 U/mL青霉素和100 μg/mL链霉素。细胞均于37 ℃、5% CO2培养箱中常规传代培养。
1.6 MTT法检测月腺大戟素A对乳腺癌细胞增殖的影响取对数生长期细胞,以每孔5×103个细胞的密度接种于96孔培养板,置于37 ℃、5% CO2孵箱中培养24 h后,分别加入含月腺大戟素A浓度为0、1、2、5、7.5、10、12.5、15、20 μmol/L(含0.1% DMSO)的培养基,每个剂量设6个平行孔。72 h后每孔加入MTT溶液(5 g/L)20 μL,继续培养4 h,吸去上清液,每孔加入100 μL DMSO,避光,低速震荡15 min,使结晶充分溶解。用酶标仪(波长492 nm)测定光密度(D)值,计算不同浓度的月腺大戟素A对乳腺癌细胞的生长抑制率。抑制率(%)=[1-(加药组D值-调零孔D值)/(对照组D值-调零孔D值)]×100%。用PASW Statistics 18.0软件计算半数抑制浓度(half maximal inhibitory concentration,IC50)。
1.7 流式细胞术检测月腺大戟素A对乳腺癌细胞周期的影响取对数生长期的SUM149细胞,以每孔1×105个细胞的密度接种于6孔板,置于37 ℃、5% CO2孵箱中培养24 h后,分别加入浓度为2.5、5、10 μmol/L的月腺大戟素A,实验对照组为含等量药物溶媒的培养液。在37 ℃、5% CO2孵箱中继续培养细胞12、24和48 h后,先用胰酶消化分散均匀,之后移入离心管中。800×g离心5 min,然后用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤2次,调整细胞密度为1×105~5×105/mL。用流式细胞仪对细胞样品进行分析,计算细胞周期。
1.8 裸鼠肿瘤模型的建立收集1×106个SUM149细胞,混悬于50 μL PBS中,加入50 μL基质胶后混匀,置冰上,将细胞悬液注射于雌性BALB/c裸鼠左腋皮下乳腺脂肪垫。注射SUM149细胞1周后,在裸鼠皮下可见实体瘤形成,每天称量1次裸鼠体质量,测量1次肿瘤大小。待肿瘤长至100 mm3(肿瘤体积=1/2×长度×宽度×宽度)时,将裸鼠随机分成月腺大戟素A(35 mg/kg)组、紫杉醇(15 mg/kg)组和模型对照组,每组12只,3组裸鼠的肿瘤相对体积无明显差异。模型对照组、月腺大戟素A组每天腹腔注射给药1次,紫杉醇组每5 d腹腔注射给药1次(其余时间每天给予等剂量溶媒),每天测量1次各组裸鼠的肿瘤体积,绘制肿瘤生长曲线。10 d后处死裸鼠,剥离肿瘤组织,称量瘤质量。计算月腺大戟素A对肿瘤的生长抑制率,抑制率(%)=[1-给药组瘤体积(质量)/模型对照组瘤体积(质量)]×100%。
1.9 统计学处理应用SPSS 19.0软件进行统计分析,数据以x±s表示。多组间差异比较采用单因素方差分析,两组间差异比较采用LSD法。检验水准(α)为0.05。
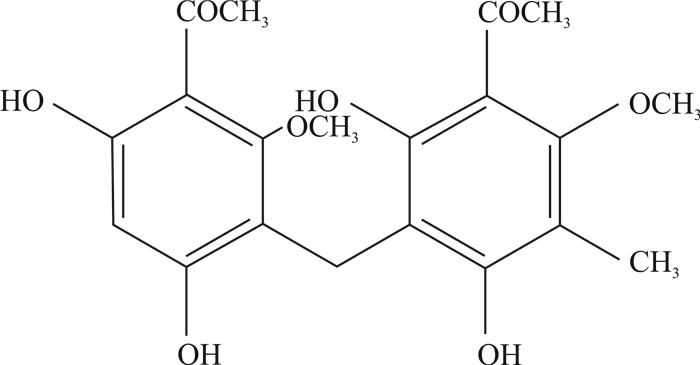
2 结果 2.1 月腺大戟素A的制备与鉴别从30 kg药材中提取得到17 mg黄色针晶。ESI-MS m/z:391[M+H]+,ESI-MS m/z:389[M-H]-, 结合1HNMR和13CNMR数据分析,化合物为3, 3’-二乙酰基-2, 4’-二甲氧基-2’, 4, 6, 6’-四羟基-5’-甲基二苯基甲烷,化学结构式如图 1所示。1HNMR (600 MHz, CDCl3): 16.16 (1H, s, 2’-OH), 13.2 (1H, s, 4-OH), 9.15 (1H, s, 6-OH), 8.82 (1H, s, 6’-OH), 6.02 (1H, s, 5-CH), 3.96 (3H, s, 2-OCH3), 3.84 (3H, s, 4’-OCH3), 3.74 (2H, s, CH2), 2.69 (3H, s, 3-COCH3), 2.62 (3H, s, 3’-COCH3), 2.05 (3H, s, 5’-CH3)。13CNMR (150 MHz, CDCl3): 205.2 (3-CO), 203.7 (3’-CO), 164.1(4-C), 164.1 (4’-C), 164.1 (6’-C), 163.9 (2’-C), 157.1 (2-C), 112.1 (5’-C), 109.0 (1’-C), 106.6 (1-C), 106.6 (3-C), 106.6 (3’-C), 66.1 (4’-OCH3), 57.1 (2-OCH3), 33.9 (3-COCH3), 31.9 (3’-COCH3), 17.6 (1-CCH2), 9.3 (5’-CH3)。
|
图 1 月腺大戟素A化学结构式 Fig 1 Chemical structure of ebracteolatain A |
2.2 月腺大戟素A对乳腺癌细胞增殖的影响
不同浓度的月腺大戟素A作用于乳腺癌细胞72 h后,SUM149、MCF-7、ZR-75-1和SK-BR-3细胞的生长均受到不同程度影响,IC50分别为5.50、6.16、7.08、8.64 μmol/L。结果表明月腺大戟素A对4种亚型乳腺癌细胞均有明显的增殖抑制作用,各细胞系对其敏感程度排序为SUM149>MCF-7>ZR-75-1>SK-BR-3。
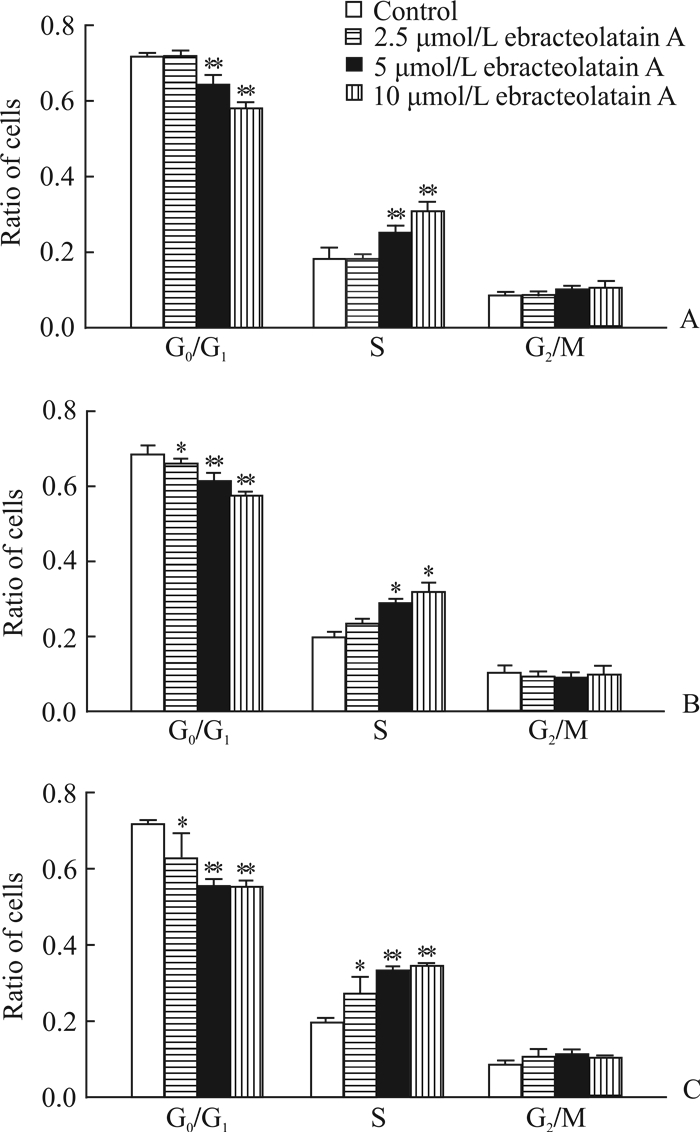
2.3 月腺大戟素A对乳腺癌细胞周期的影响月腺大戟素A处理SUM149细胞后,采用流式细胞术分析细胞周期的变化,结果(图 2)表明,随月腺大戟素A浓度的增加,G0/G1期细胞比例下降(P<0.05,P<0.01),S期细胞比例上升(P<0.05,P<0.01),提示月腺大戟素A抑制SUM149细胞周期从S期到G2/M期的转换。
|
图 2 月腺大戟素A对乳腺癌细胞SUM149细胞周期的影响 Fig 2 2 Effect of ebracteolatain A on cell cycle of breast cancer cell line SUM149 A: 12 h; B: 24 h; C: 48 h. *P<0.05, **P<0.01 vs control. n=3, x±s |
2.4 肿瘤的生长曲线及抑制率
模型对照组裸鼠肿瘤生长速度较快,而月腺大戟素A组和紫杉醇组肿瘤生长缓慢(图 3);给药第10天后剥离各组裸鼠皮下肿瘤,称质量并比较。与模型对照组相比,月腺大戟素A组和紫杉醇组裸鼠肿瘤体积与质量均减小(P<0.01),月腺大戟素A组肿瘤体积和质量的抑制率分别为37.94%和41.38%,紫杉醇组肿瘤体积和质量的抑制率分别为45.77%和48.28%,见表 1。结果表明月腺大戟素A能够抑制裸鼠SUM149细胞移植肿瘤的生长。

|
图 3 各组裸鼠SUM149细胞移植肿瘤生长曲线 Fig 3 Growth curves of transplanted-SUM149 cell tumor in nude mice in each group **P<0.01 vs ebracteolatain A group or paclitaxel group. n=12, x±s |
|
|
表 1 各组裸鼠SUM149细胞移植肿瘤生长的抑制率 Tab 1 Inhibition rates of transplanted-SUM149 cell tumor in nude mice in each group |
3 讨论
研究表明中药狼毒提取物有较好的抗肿瘤效果,其对Lewis肺癌、艾氏腹水癌、肝癌、腹水瘤S180细胞株、人组织细胞淋巴瘤细胞株U937、人宫颈癌细胞株HeLa、肝癌细胞株QRH-7701均有不同程度的抑制作用[7-9],但是目前关于狼毒中化学成分抗乳腺癌作用的研究鲜有报道。本研究从狼毒药材中分离得到一种乙酰间苯三酚类天然产物月腺大戟素A,通过MS结合1HNMR和13CNMR数据分析得其结构为3, 3’-二乙酰基-2, 4’-二甲氧基-2’, 4, 6, 6’-四羟基-5’-甲基二苯基甲烷,通过MTT法检测月腺大戟素A对乳腺癌细胞增殖的影响,证明其对4种乳腺癌细胞株SUM149、MCF-7、ZR-75-1、SK-BR-3均具有增殖抑制作用。
三阴性乳腺癌具有侵袭早、转移快、病死率高的特点,是乳腺癌中预后最差的亚型[10],本研究发现三阴性乳腺癌细胞SUM149对月腺大戟素A最敏感。因此选用SUM149作为研究对象,通过裸鼠移植肿瘤实验发现月腺大戟素A具有抑制肿瘤生长的作用,流式细胞术检测结果提示月腺大戟素A能阻滞SUM149细胞周期于S期,阻滞DNA合成。本研究关于月腺大戟素A抗乳腺癌活性的结果尚属首次报道,其抑制肿瘤生长的机制可能与抑制细胞周期从S期到G2/M期的转换有关,这为进一步探讨月腺大戟素A的药理作用机制和抗乳腺癌新药开发奠定了基础。
| [1] |
RIVERA-FRANCO M M, LEON-RODRIGUEZ E. Delays in breast cancer detection and treatment in developing countries[J/OL]. Breast Cancer (Auckl), 2018, 12: 1178223417752677. doi: 10.1177/1178223417752677.
|
| [2] |
NOUNOU M I, ELAMRAWY F, AHMED N, ABDELRAOUF K, GODA S, SYED-SHA-QHATTAL H. Breast cancer:conventional diagnosis and treatment modalities and recent patents and technologies[J]. Breast Cancer (Auckl), 2015, 9(Suppl 2): 17-34. |
| [3] |
宣雯霞, 郭泰, 王伏生. 乳腺癌的治疗进展[J]. 中国药物与临床, 2015, 15: 203-205. |
| [4] |
MAKUBATE B, DONNAN P T, DEWAR J A, THOMPSON A M, MCCOWAN C. Cohort study of adherence to adjuvant endocrine therapy, breast cancer recurrence and mortality[J]. Br J Cancer, 2013, 108: 1515-1524. DOI:10.1038/bjc.2013.116 |
| [5] |
李伟, 潘燕, 李学军. HER2阳性乳腺癌治疗药物曲妥珠单抗耐药机制及新一代靶向药物研究进展[J]. 中国临床药理学杂志, 2014, 30: 48-51. |
| [6] |
夏青, 徐柯心, 张文婷, 王雨彤, 黄碗贞, 罗隽, 等. 中药狼毒化学成分与药理作用概述[J]. 环球中医药, 2017, 10: 927-932. DOI:10.3969/j.issn.1674-1749.2017.08.039 |
| [7] |
姜红. 狼毒大戟对小鼠Lewis肺癌增殖及转移的影响[J]. 实用医药杂志, 2013, 30: 808-810. DOI:10.3969/j.issn.1671-4008.2013.09.029 |
| [8] |
LIU Z G, LI Z L, BAI J, MENG D L, LI N, PEI Y H, et al. Anti-inflammatory diterpenoids from the roots of Euphorbia ebracteolata[J]. J Nat Prod, 2014, 77: 792-799. DOI:10.1021/np400873v |
| [9] |
沈佳钰. 瑞香狼毒药理活性研究进展[J]. 内蒙古中医药, 2017, 36: 151-152. |
| [10] |
李甜, 周钱梅, 张卫红. PI3K/Akt/mTOR信号通路在三阴性乳腺癌治疗中的研究进展[J]. 中国肿瘤, 2018, 27: 40-45. |
 2018, Vol. 39
2018, Vol. 39


