肝细胞癌(hepatocellular carcinoma,HCC)是最常见的消化道恶性肿瘤之一,在所有恶性肿瘤中其发病率及病死率分别位居第5位和第3位,由于早期缺乏特异性症状和体征,多数患者确诊时已属晚期,预后极差[1]。据报道,我国HCC发病人数占全球新发病例的一半以上,严重威胁国民的生命健康[2-3]。目前HCC的治疗方式仍以手术切除局部病灶为主[4],术前或术后辅以肝动脉化学治疗栓塞术或放射治疗[5-6],对于无法行手术治疗的患者可行单纯的放射治疗或口服靶向药物索拉非尼[7]。但这些治疗方式的患者获益较小,HCC极易复发、转移是主要原因之一[8]。随着医学的发展,肝移植在HCC治疗中的应用越来越广泛,HCC被认为是行肝移植的主要适应证之一[9]。
目前公认的HCC肝移植标准有up-to-seven(Up7)标准、上海复旦标准、加利福尼亚大学旧金山分校(University of California,San Francisco;UCSF)标准、意大利米兰(Milan)标准。符合上述标准的肝移植HCC患者预后优于不符合标准的患者,因此通常在术前对HCC患者进行评估,优先对符合标准的患者进行肝移植[10-13]。例如Milan标准的应用使HCC患者肝移植术后5年生存率达70%,5年复发率低于15%[14-15]。
本研究纳入251例符合Up7标准接受肝移植手术的HCC患者,分析其临床资料和随访资料,建立了基于Up7标准HCC肝移植术后长期生存的Cox回归预测模型,同时根据上海复旦标准、UCSF标准、Milan标准验证预测模型的预测效能,以更准确地评估HCC患者的肝移植术后获益。
1 资料和方法 1.1 研究对象与资料收集本研究通过我院伦理委员会审批,纳入2009年1月至2012年12月于我院行肝移植术的251例HCC患者(均为受者)。纳入标准:(1)符合Up7标准;(2)术前影像学检查提示肝占位,且术后病理明确诊断为HCC。排除标准:(1)肝硬化;(2)心血管并发症;(3)多器官功能衰竭;(4)移植肝衰竭;(5)出血;(6)神经系统并发症,如肝性脑病。HCC肝移植标准[13]:(1)Up7标准。肿瘤最大径(cm)与肿瘤数目之和≤7。(2)上海复旦标准。①单个肿瘤最大径≤9 cm,或多发肿瘤≤3个且单个肿瘤最大径≤5 cm,所有肿瘤最大径之和≤9 cm;②无大血管侵犯、淋巴结转移及肝外转移。(3)UCSF标准。①单个肿瘤最大径≤6.5 cm,或肿瘤数目为2~3个且单个肿瘤最大径≤4.5 cm,所有肿瘤最大径之和≤8 cm;②不伴有大血管侵犯及淋巴结转移。(4)Milan标准。①单个肿瘤最大径<5 cm,或肿瘤数目为2~3个且单个肿瘤最大径≤3 cm;②不伴有微血管侵犯(microvascular invasion,MVI)和肝外转移。
1.2 随访通过医院随访登记或电话随访收集纳入患者肝移植术后死亡时间和原因。肝移植术后患者及时门诊复查,每月复查项目包括肝功能检查、免疫抑制剂和甲胎蛋白(α-fetoprotein,AFP)等血清学指标。对于怀疑复发转移的患者复查B超、胸部X线片、计算机断层扫描(computed tomography,CT),必要时行正电子发射计算机断层扫描(positron emission computed tomography,PET-CT)全身检查。影像学检查发现有癌灶特点的结节,且经病理活组织检查证实的为HCC肝移植术后肿瘤复发。随访起始时间为肝移植手术时间,截止时间为2017年12月31日。6个月未复查视为失访。详细记录无瘤生存期、肿瘤复发时间、肿瘤复发部位、患者死亡时间、最后一次随访状态、最后一次随访时间等。
1.3 统计学处理应用R 3.4.3软件进行统计学分析。首先对计量资料进行正态性检验,若服从正态分布,则以x±s表示,组间比较采用方差分析;若不服从正态分布,则以中位数(下四分位数,上四分位数)表示,组间比较采用非参数Kruskal-Wallis H检验。计数资料以例数和百分数表示,组间比较采用χ2检验。对患者术前血清学指标和影像学指标进行单因素Cox回归模型分析,以确定患者生存预后的预测因素;将差异有统计学意义的指标纳入多因素Cox回归模型,进行逐步回归向前法分析,以确定生存预后的独立预测因素,并建立Cox回归预测模型。使用R 3.4.3软件模拟获得模型评分,采用生存决策树确定模型的截断值。绘制患者术后总体生存期的Kaplan-Meier曲线,并用log-rank检验分析高危和低危组间差异。以病理结果为金标准,使用R 3.4.3软件绘制受试者工作特征(receiver operating characteristic,ROC)曲线并对年度死亡和未死亡的比例进行分析。检验水准(α)为0.05。
2 结果 2.1 一般资料纳入符合Up7标准的行肝移植术HCC患者251例。所有病例均行原位全肝移植术,皆采用a经典原位式。其中177例符合上海复旦标准,163例符合UCSF标准,160例符合Milan标准。符合4个标准的HCC肝移植患者的肿瘤多发性、MVI以及大血管侵犯指标差异有统计学意义(P均<0.01),而患者的年龄、性别、乙型病毒性肝炎病史、是否肝衰竭、脾切除术史、上消化道出血史、肿瘤治疗史、是否腹腔静脉曲张、肿瘤是否有典型的“快进快出”、肿瘤包膜情况、术前血清学指标等差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 符合不同标准的HCC肝移植患者的临床资料比较 Tab 1 Comparison of clinical information of HCC liver transplantation patients under different criteria |
2.2 HCC患者肝移植术后长期生存的预测因素分析
见表 2。通过单因素Cox回归分析发现,肿瘤最大径、MVI、大血管侵犯、lg AFP水平、白蛋白水平、总胆红素(total bilirubin,T-Bil)水平和谷氨酰转肽酶水平是HCC患者肝移植术后长期生存的预测因素;多因素Cox回归分析发现,肿瘤最大径、MVI、lg AFP水平和T-Bil水平是HCC患者肝移植术后长期生存的独立预测因素。根据多因素Cox回归分析结果,建立HCC患者肝移植术后长期生存的Cox回归预测模型:h(t,x)=h0(t)exp [0.284×肿瘤最大径(Diameter,cm)+0.773×MVI(是=1;否=0)+0.404×lg AFP(ng/mL)+0.003×T-Bil(μmol/L)],命名该模型为ATMD(AFP,T-Bil,MVI,Diameter)模型。
|
|
表 2 HCC患者肝移植术前血清学和影像学指标对预后影响的单因素和多因素Cox回归分析 Tab 2 Predictive value of ATMD models for long-term survival in HCC patients undergoing liver transplantation with different criteria |
2.3 ATMD模型对HCC患者肝移植术后生存情况的预测效能
对纳入的所有HCC患者进行ATMD评分,根据判别生存树设定ATMD模型截断值为1.44,评分>1.44为高危组,≤1.44为低危组。符合Up7标准高危组和低危组的肝移植术后HCC患者分为87例和164例,符合上海复旦标准的分别为33例和144例,符合UCSF标准的分别为29例和134例,符合Milan标准的分别为29例和131例。图 1所示为ATMD模型在不同标准下HCC肝移植术后患者的Kaplan-Meier生存曲线,经log-rank检验发现,在Up7标准、上海复旦标准、UCSF标准和Milan标准下,ATMD模型高危组和低危组HCC患者肝移植术后累积生存率差异均有统计学意义(P<0.001,P=0.008,P<0.001,P=0.001)。

|
图 1 不同标准下HCC肝移植术后患者的ATMD模型的Kaplan-Meier曲线及log-rank检验 Fig 1 Kaplan-Meier curve and log-rank test of ATMD models for HCC patients undergoing liver transplantation with different criteria A: Up7 criteria; B: Shanghai Fudan criteria; C: UCSF criteria; D: Milan criteria. HCC: Hepatocellular carcinoma; ATMD: AFP, T-Bil, MVI, Diameter; AFP: α-Fetoprotein; T-Bil: Total bilirubin; MVI: Microvascular invasion; Up7: Up-to-seven; UCSF: University of California, San Francisco |
Up7标准下,ATMD模型预测1、3、5年HCC患者肝移植术后长期生存的曲线下面积(area under curve,AUC)分别为72.37%、76.63%和70.78%;上海复旦标准下,AUC分别为64.00%、75.87%和67.18%;UCSF标准下,AUC分别61.07%、73.32%和64.71%;Milan标准下AUC分别为64.65%、69.41%和62.79%。ATMD模型预测HCC患者肝移植术后3年生存情况的结果较为稳定,AUC均大于69.00%。见图 2。
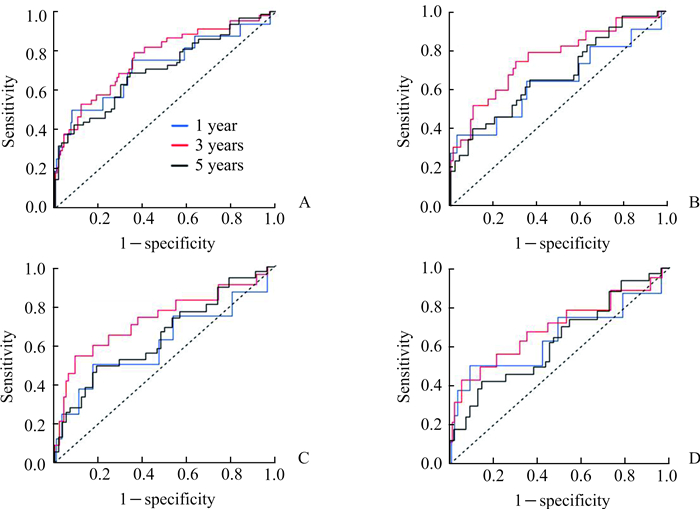
|
图 2 不同标准下HCC肝移植术后患者长期生存情况ATMD模型的预测价值分析 Fig 2 Predictive value of ATMD models for long-term survival in HCC patients undergoing liver transplantation with different criteria A: Up7 criteria; B: Shanghai Fudan criteria; C: UCSF criteria; D: Milan criteria. HCC: Hepatocellular carcinoma; ATMD: AFP, T-Bil, MVI, Diameter; AFP: α-Fetoprotein; T-Bil: Total bilirubin; MVI: Microvascular invasion; Up7: Up-to-seven; UCSF: University of California, San Francisco |
3 讨论
我国是HCC的高发大国,每年至少有30万人死于HCC,约占全球HCC死亡人数的50%,除手术及其他综合治疗方案外,肝移植术作为HCC的治疗手段之一已经逐渐得到认可[16]。据报道,截至2014年4月,我国肝移植注册网站登记的肝移植人数就已达到26 751例[17],并且呈逐年递增趋势,移植数量及质量也均不断提高。随之面临的主要问题是供体稀缺和受体获益。供体稀缺已经成为各国的主要难题;而如何对患者进行筛选,使稀缺的供体为合适的患者带来最大的生存获益也是目前移植领域最严峻的问题[18-19]。通过过去几十年的研究,在不断总结以及循证医学证据下,临床上制定了各种肝移植标准,并认为符合此类标准的患者肝移植后获益最大,因此通过这些标准对患者进行筛选,提高了肝移植术后患者的总体生存时间[20]。目前对HCC行肝移植的入选标准主要有Up7标准、上海复旦标准、UCSF标准及Milan标准,这些标准均依据肿瘤大小和肿瘤数目的不同界值制定[21]。
在所有肝移植标准中,肿瘤最大径作为一个极其重要的指标,对入选病例均有决定性的意义。Metroticket 2.0模型将患者术前AFP水平及肿瘤最大径和肿瘤数目作为判断预后的重要指标,对HCC肝移植术后5年生存率具有重要的预测价值,在验证组中准确度为0.721(0.648~0.793)[22]。Notarpaolo等[23]对移植前末次AFP水平在HCC肝移植患者生存预测中的价值进行研究,发现AFP评分≤2和>2的HCC肝移植患者的5年总体生存率分别为(71.7±2.2)%和(42.2±8.3)%(HR=2.14,P<0.001),5年复发率分别为(13.2±1.8)%和(49.8±8.7)%(HR=4.98,P<0.001)。陈达伟等[24]对肝移植术后HCC生存及复发的危险因素进行分析,发现MVI是HCC术后复发及生存率的独立危险因素(HR=2.553,95% CI:1.342~4.856,P=0.004;HR=2.890,95% CI:1.464~5.704,P=0.002),且术前AFP水平、肿瘤数目、结节最大径、大血管侵犯和Milan标准也与术后复发相关。
本研究基于Up7标准的HCC肝移植患者资料,以AFP、T-Bil、MVI和肿瘤最大径建立了ATMD模型,用于预测患者的预后,通过绘制Kaplan-Meier曲线并经log-rank检验分析发现,尽管HCC患者肝移植术前符合Up7标准,但与低危组相比,高危组患者的生存预后仍较差(P<0.01),且在上海复旦标准、UCSF标准及Milan标准下同样如此。目前肝移植术后HCC患者的总体生存率仍较低,即使是符合上述标准的患者,其获益依然不同,说明目前制定的标准并不够精准化、个体化,因此迫切需要对符合标准的患者进行二次评估,以更好地为患者提供最佳的治疗手段,并更准确地判断预后。而ATMD模型可以协助临床做出有利于患者的辅助决策,并可对预后进行更准确的判断,从而为患者提供最佳的治疗手段。但与Montano-Loza等[25]建立的肝移植术后判别模型相比,本研究患者的部分指标如是否存在MVI,未在术前获得,这是本研究的局限性,今后需重点关注。
| [1] |
FARES N, PÉRON J M. Epidemiology, natural history, and risk factors of hepatocellular carcinoma][J]. Rev Prat, 2013, 63: 216-217, 220-212. |
| [2] |
MCGLYNN K A, PETRICK J L, LONDON W T. Global epidemiology of hepatocellular carcinoma:an emphasis on demographic and regional variability[J]. Clin Liver Dis, 2015, 19: 223-238. DOI:10.1016/j.cld.2015.01.001 |
| [3] |
ASHTARI S, POURHOSEINGHOLI M A, SHARIFIAN A, ZALI M R. Hepatocellular carcinoma in Asia:prevention strategy and planning[J]. World J Hepatol, 2015, 7: 1708-1717. DOI:10.4254/wjh.v7.i12.1708 |
| [4] |
BHANDARE M S, PATKAR S, SHETTY N, POLNAYA A, KULKARNI S, DUSANE R R, et al. Liver resection for HCC outside the BCLC criteria[J]. Langenbecks Arch Surg, 2018, 403: 37-44. DOI:10.1007/s00423-017-1640-3 |
| [5] |
LISCHALK J W, REPKA M C, UNGER K. Radiation therapy for hepatobiliary malignancies[J]. J Gastrointest Oncol, 2017, 8: 279-292. DOI:10.21037/jgo |
| [6] |
LI K W, LI X, WEN T F, LU W S. The effect of postoperative TACE on prognosis of HCC:an update[J]. Hepatogastroenterology, 2013, 60: 248-251. |
| [7] |
YOSHIMOTO T, IMURA S, MORINE Y, IKEMOTO T, ARAKAWA Y, IWAHASHI S, et al. The outcome of sorafenib therapy on unresectable hepatocellular carcinoma:experience of conversion and salvage hepatectomy[J]. Anticancer Res, 2018, 38: 501-507. |
| [8] |
HAO S, FAN P, CHEN S, TU C, WAN C. Distinct recurrence risk factors for intrahepatic metastasis and multicenter occurrence after surgery in patients with hepatocellular carcinoma[J]. J Gastrointest Surg, 2017, 21: 312-320. DOI:10.1007/s11605-016-3311-z |
| [9] |
STARZL T E, TODO S, TZAKIS A G, GORDON R D, MAKOWKA L, STIEBER A, et al. Liver transplantation:an unfinished product[J]. Transplant Proc, 1989, 21(1 Pt 2): 2197-2200. |
| [10] |
樊嘉, 周俭, 徐泱, 邱双健, 吴志全, 余耀, 等. 肝癌肝移植适应证的选择:上海复旦标准[J]. 中华医学杂志, 2006, 86: 1227-1231. DOI:10.3760/j:issn:0376-2491.2006.18.002 |
| [11] |
HIROSE R, YAO F, STOCK P, ROBERTS J, ASCHER N. Liver transplantation at UCSF-a 20-year experience[J]. Clin Transpl, 2008, 119-125. |
| [12] |
KWON C H, KIM D J, HAN Y S, PARK J B, CHOI G S, KIM S J, et al. HCC in living donor liver transplantation:can we expand the Milan criteria?[J]. Dig Dis, 2007, 25: 313-319. DOI:10.1159/000106911 |
| [13] |
LEI J Y, WANG W T, YAN L N. Up-to-seven criteria for hepatocellular carcinoma liver transplantation:a single center analysis[J]. World J Gastroenterol, 2013, 19: 6077-6083. DOI:10.3748/wjg.v19.i36.6077 |
| [14] |
BELGHITI J, DURAND F. Criteria for liver transplantation for hepatocellular carcinoma:what is an acceptable outcome?[J]. Liver Int, 2011, 31(Suppl 1): 161-163. |
| [15] |
WASHBURN K, HALFF G. Hepatocellular carcinoma and liver transplantation[J]. Curr Opin Organ Transplant, 2011, 16: 297-300. DOI:10.1097/MOT.0b013e3283465756 |
| [16] |
DI SANDRO S, GIACOMONI A, SLIM A, LAUTERIO A, MANGONI I, MIHAYLOV P, et al. Living donor liver transplantation for hepatocellular carcinoma:the impact of neo-adjuvant treatments on the long term results[J]. Hepatogastroenterology, 2012, 59: 505-510. |
| [17] |
郑树森, 徐骁, 李建辉, 高峰, 陈峻, 舒哲悦, 等. 中国肝癌肝移植临床实践指南[J]. 中华危重症医学杂志(电子版), 2014, 7: 410-415. |
| [18] |
DE'ANGELIS N, LANDI F, CARRA M C, AZOULAY D. Managements of recurrent hepatocellular carcinoma after liver transplantation:a systematic review[J]. World J Gastroenterol, 2015, 21: 11185-11198. DOI:10.3748/wjg.v21.i39.11185 |
| [19] |
WANG Z Y, GENG L, ZHENG S S. Current strategies for preventing the recurrence of hepatocellular carcinoma after liver transplantation[J]. Hepatobiliary Pancreat Dis Int, 2015, 14: 145-149. DOI:10.1016/S1499-3872(15)60345-9 |
| [20] |
SAPISOCHIN G, BRUIX J. Liver transplantation for hepatocellular carcinoma:outcomes and novel surgical approaches[J]. Nat Rev Gastroenterol Hepatol, 2017, 14: 203-217. DOI:10.1038/nrgastro.2016.193 |
| [21] |
PIARDI T, GHEZA F, ELLERO B, WOEHL-JAEGLE M L, NTOURAKIS D, CANTU M, et al. Number and tumor size are not sufficient criteria to select patients for liver transplantation for hepatocellular carcinoma[J]. Ann Surg Oncol, 2012, 19: 2020-2026. DOI:10.1245/s10434-011-2170-9 |
| [22] |
MAZZAFERRO V, SPOSITO C, ZHOU J, PINNA A D, DE CARLIS L, FAN J, et al. Metroticket 2.0 model for analysis of competing risks of death after liver transplantation for hepatocellular carcinoma[J]. Gastroenterology, 2018, 154: 128-139. DOI:10.1053/j.gastro.2017.09.025 |
| [23] |
NOTARPAOLO A, LAYESE R, MAGISTRI P, GAMBATO M, COLLEDAN M, MAGINI G, et al. Validation of the AFP model as a predictor of HCC recurrence in patients with viral hepatitis-related cirrhosis who had received a liver transplant for HCC[J]. J Hepatol, 2017, 66: 552-559. DOI:10.1016/j.jhep.2016.10.038 |
| [24] |
陈达伟, 樊军卫, 刘双海. 联合米兰标准及微血管侵犯预测肝移植术后肝癌复发[J]. 河南医学研究, 2015, 24: 1-3. |
| [25] |
MONTANO-LOZA A J, MAZURAK V C, EBADI M, MEZA-JUNCO J, SAWYER M B, BARACOS V E, et al. Visceral adiposity increases risk for hepatocellular carcinoma in male patients with cirrhosis and recurrence after liver transplant[J]. Hepatology, 2018, 67: 914-923. DOI:10.1002/hep.v67.3 |
 2018, Vol. 39
2018, Vol. 39


