2. 上海交通大学生物医学工程学院纳米生物医学工程研究所, 上海 200240
2. Institute of Nano Biomedicine and Engineering, School of Biomedical Engineering, Shanghai Jiao Tong University, Shanghai 200240, China
主动脉夹层(aortic dissection)起始于主动脉血管内膜的破损,在反复高压血流的冲击下,内膜破损进一步沿此层扩大、撕裂,造成血管壁内膜与中膜分离,最终导致主动脉内形成真假两腔即夹层主动脉瘤。在主动脉病变引起的疾病中,主动脉夹层是最凶险的疾病之一,也是病死率最高的疾病之一[1-4]。因此,探寻与主动脉夹层的早期诊断、预后判断或疗效评估密切相关的标志物具有重要意义。
外泌体是细胞经内源性途径分泌的微小囊泡,粒径一般为30~200 nm,形态上呈凹陷的半球形或半杯托状[5-6]。近年来,外泌体因在细胞间相互作用、细胞间通讯、疾病诊断和疾病治疗与预后判断等方面的作用[5-7]而逐渐成为研究热点。外泌体可存在于体液或细胞培养上清液中,其主要来源体液有血液、尿液、腹水、唾液、羊水、乳汁、精液或脑脊液等[8-10]。尿液具有获取方便、无创、易保存等优点,是临床检验中重要的样本来源。但尿液中外泌体含量较低,其提取与分离一直是相关研究中的一个难点。本研究采用超速离心法、透析超滤法和沉淀试剂盒法提取主动脉夹层患者尿液外泌体并进行表征,探讨分离主动脉夹层患者尿液来源外泌体的适宜方案,为后续外泌体的相关实验奠定基础。
1 材料和方法 1.1 样本来源尿液样本来自2017年7月至12月在海军军医大学(第二军医大学)长海医院确诊并接受手术治疗的20例主动脉夹层患者,所有患者均自愿参加本研究,并签署知情同意书。尿液样本采集:征求研究对象同意后,在相对固定的时间点,如每日16:00(非晨尿)收集患者尿液至少150 mL,样本在4 ℃静置30 min后,4 ℃ 1 000×g离心15 min,取上清液,分装后立即置于-80 ℃冰箱中备用。
1.2 仪器与试剂Optima XPN型超速离心机及其配套的超速离心管(美国贝克曼库尔特有限公司),Kit-exo试剂盒(上海吉泰依科赛生物科技有限公司),Tecnai G2 SpiritBioTWIN生物型透射电子显微镜(美国FEI公司),支持膜(北京新兴百瑞技术有限公司),NanoSight NS300型纳米颗粒跟踪分析仪(英国马尔文仪器有限公司)。
1.3 尿液外泌体分离方法 1.3.1 超速离心法提取尿液外泌体从-80 ℃冰箱中取出分装好的装有50 mL尿液的离心管,梯度解冻。4 ℃ 2 000×g离心10 min后,取上清置于另一个50 mL离心管中;再次4 ℃ 3 500×g离心20 min后,取上清置于新的50 mL离心管中;第3次4 ℃ 10 000×g离心60 min后,取上清置于超速离心机配套离心管中,在天平上仔细配平后置于超速离心机中,4 ℃ 120 000×g离心70 min。弃上清,用磷酸盐缓冲液(phosphate buffer solution,PBS)重悬沉淀,补充适量PBS,经0.22 μm无菌滤器过滤后再次置于超速离心机配套离心管中,4 ℃ 120 000×g离心70 min。分步弃去上清,得到的离心管底部微量液体即为尿液外泌体。用50~100 μL的PBS吹打离心管底部,并吸取至合适的离心管中,分离出的尿液外泌体悬液置于4 ℃冰箱内短期保存。
1.3.2 透析超滤法提取尿液外泌体[11]从-80 ℃冰箱中取出分装好的装有50 mL尿液的离心管,梯度解冻。4 ℃ 2 000×g离心10 min,取上清,再次4 ℃ 3 500×g离心20 min,将上清置于新的50 mL离心管中,通过0.22 μm滤器过滤,得到滤液约40 mL。将此滤液加入到截留相对分子质量为300 000的透析袋中。在新鲜配制的细胞级PBS中透析6~9 h,每2~3 h更换1次PBS,PBS用量共计为3 L。将得到的液体加入截留相对分子质量为100 000的超滤管中,2 000×g超滤15 min,得到的产物即为尿液外泌体。
1.3.3 沉淀试剂盒法提取尿液外泌体从-80 ℃冰箱中取出分装好的装有50 mL尿液的离心管,梯度解冻。4 ℃ 3 000×g离心30 min后取上清液,用0.45 μm滤器过滤;向过滤后的尿液样本中加入Kit-exo试剂盒中的试剂(样本体积:试剂体积=10:1),混匀。将此混合液置于4 ℃冰箱中,静置20 h以上;4 ℃ 2 000×g离心30 min,弃去上清液,留下沉淀;再次4 ℃ 1 500×g离心10 min,充分去除上清液;用50~100 μL的PBS清洗残留的液体,1 500×g离心5 min,再次充分去除上清液,保留的沉淀即为尿液外泌体。用PBS重悬沉淀并吸取至离心管中,置于4 ℃冰箱内短期保存。
1.4 生物透射电子显微镜下观察尿液外泌体的形态取以上述3种方法获得的产物各20 μL,用移液枪混匀。然后吸取10 μL外泌体悬液,滴至电子显微镜铜网上,静置10 min,用磷钨酸负染固定,室温自然晾干,上样到120 kV生物透射电子显微镜下观察并拍照。
1.5 纳米颗粒跟踪分析仪测量尿液外泌体的粒径大小、颗粒分布与浓度取以上述3种方法获得的产物各10 μL,用去离子水稀释至1 000 μL(具体稀释倍数需要参照样本实际情况)。用1 mL注射器上样,设置循环次数(一般为3次)和时间(每次30 s),上机检测。
2 结果 2.1 不同分离方法提取的尿液外泌体形貌生物透射电子显微镜观察结果显示,超速离心法获得的尿液外泌体呈典型半杯托状或凹陷的半球状,背景干净,可三三两两地聚集在一起(图 1A);用透析超滤法获得的尿液外泌体形态较好,且数量多,背景干净(图 1B);而用沉淀试剂盒法获得产物在生物透射电子显微镜下未观察到明显的外泌体结构,且有一些杂质,背景杂乱(图 1C)。

|
图 1 透射电子显微镜下观察不同分离方法提取的尿液外泌体形貌(负染) Fig 1 Morphology of urine-derived exosomes under transmission electron microscope by different methods (negative staining) A: Exosomes derived from urine by ultracentrifugation; B: Exosomes derived from urine by dialysis-ultrafiltration; C: Exosomes derived from urine by precipitation kit. Arrows indicate exosomes |
2.2 不同分离方法提取的尿液外泌体粒径大小、颗粒分布与浓度
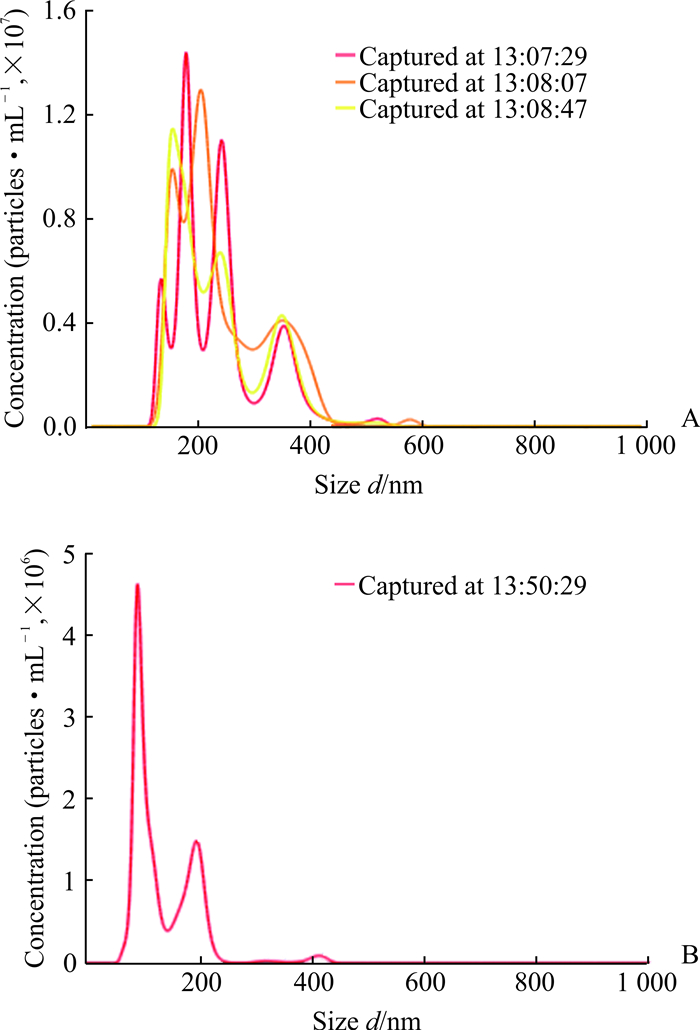
纳米颗粒跟踪分析仪测量结果显示,超速离心法得到的尿液外泌体的粒径较大,分布较均匀;粒径范围较宽,平均值为(236.4±46.5)nm;浓度较低,为(2.82±0.21)×1012个/mL(图 2A)。透析超滤法获得的尿液外泌体粒径较小,分布较集中;粒径范围较窄,平均值为(128.7±6.3)nm;浓度较高,为(2.16±0.15)×1014个/mL(图 2B)。沉淀试剂盒法获得的产物于生物透射电子显微镜下未观察到明显的外泌体结构,故未能测量粒径大小、颗粒分布与浓度。
|
图 2 纳米颗粒跟踪分析仪测量不同方法提取的尿液外泌体粒径分布与浓度 Fig 2 Particle size distribution and concentration of urine-derived exosomes by nanoparticle tracking analysis A: Exosomes derived from urine by ultracentrifugation (sample was diluted 2 000 times); B: Exosomes derived from urine by dialysis-ultrafiltration (sample was diluted 1 000 000 times) |
3 讨论
外泌体的内容物十分丰富,包括脂质、蛋白质、核酸等多种生物活性分子,这些物质作为细胞内的生物信号被外泌体运送到靶细胞或靶组织,参与多种生理、病理过程,在细胞间通讯中发挥着重要作用[12-13]。近年来,越来越多的研究关注外泌体的特征及其对疾病诊疗和预后判断的作用[14-17],然而,对不同来源外泌体的分离一直是外泌体研究中的一个重要问题。目前外泌体的提纯方法包括超速离心法、基于粒径大小的层析排阻法、透析超滤法、磁珠免疫捕获法和沉淀试剂盒法等,但尚无一种方法能够满足各种组织来源外泌体的提取要求。
本研究利用超速离心法、透析超滤法及沉淀试剂盒法分离提取主动脉夹层患者尿液来源的外泌体,比较了3种方法的分离提纯效果。超速离心法提取的外泌体数量一般但形态良好,具备外泌体典型的半杯托状或凹陷的半球状结构,背景干净,并三三两两地聚集在一起;外泌体的粒径较大,分布较均匀,粒径范围较宽[平均值为(236.4±46.5)nm];用纳米颗粒跟踪分析仪测量的浓度较小,为(2.82±0.21)×1012个/mL。此方法是外泌体分离提取的经典方法[11],但需要用到超速离心机及配套的离心管和适配器,不适合于多样本的提取。采用透析超滤法获得的尿液外泌体形态较好,数量多,背景干净。其粒径分布较集中,粒径范围较窄[平均值为(128.7±6.3)nm],用纳米颗粒跟踪分析仪测量的浓度较大,为(2.16±0.15)×1014个/mL。此方法是一种经济、便捷的外泌体分离提纯方法,超滤的作用主要是浓缩尿液体积和部分截留所需粒径大小的微粒,透析是为了除去杂质[11]。而采用沉淀试剂盒法提取的外泌体结构不明显,背景杂乱有干扰。我们推测可能是沉淀试剂盒的主要成分聚乙二醇6000在过夜孵育待分离外泌体时,同时包裹了外泌体与其他杂质,所以在透射电子显微镜下很难观察到外泌体结构。
综上所述,对于分离提纯主动脉夹层患者尿液来源的外泌体,在对外泌体的纯度要求不是特别高的情况下,用透析超滤法较为适宜。这为进一步研究主动脉夹层患者尿液来源外泌体的其他性质和功能奠定了良好的基础。
| [1] |
陆清声, 谢永富, 景在平. 主动脉夹层的腔内治疗进展[J]. 国际外科学杂志, 2016, 43: 801-804. DOI:10.3760/cma.j.issn.1673-4203.2016.12.003 |
| [2] |
徐昶, 贺行巍, 李柱锡, 乔平, 刘婉君, 刘玉建, 等. 主动脉夹层症状与原发破口位置、撕裂范围关系的探讨[J]. 内科急危重症杂志, 2015, 21: 266-268. |
| [3] |
TOKUDA N, KOGA M, OHARA T, MINATOYA K, TAHARA Y, HIGASHI M, et al. Urgent detection of acute type A aortic dissection in hyperacute ischemic stroke or transient ischemic attack[J]. J Stroke Cerebrovasc Dis, 2018, 27: 2112-2117. DOI:10.1016/j.jstrokecerebrovasdis.2018.03.010 |
| [4] |
段旭洲, 陈佳, 徐志云. 急性A型主动脉夹层术前低氧血症危险因素分析[J]. 第二军医大学学报, 2016, 37: 111-114. DUAN X Z, CHEN J, XU Z Y. Risk factors for preoperative hypoxemia in acute type A aortic dissection[J]. Acad J Sec Mil Med Univ, 2016, 37: 111-114. |
| [5] |
PEINADO H, ALEČKOVIĆ M, LAVOTSHKIN S, MATEI I, COSTA-SILVA B, MORENO-BUENO G, et al. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET[J]. Nat Med, 2012, 18: 883-891. DOI:10.1038/nm.2753 |
| [6] |
IERO M, VALENTI R, HUBER V, FILIPAZZI P, PARMIANI G, FAIS S, et al. Tumour-released exosomes and their implications in cancer immunity[J]. Cell Death Differ, 2008, 15: 80-88. DOI:10.1038/sj.cdd.4402237 |
| [7] |
YANG T, MARTIN P, FOGARTY B, BROWN A, SCHURMAN K, PHIPPS R, et al. Exosome delivered anticancer drugs across the blood-brain barrier for brain cancer therapy in Danio rerio[J]. Pharm Res, 2015, 32: 2003-2014. DOI:10.1007/s11095-014-1593-y |
| [8] |
THÉRY C, ZITVOGEL L, AMIGORENA S. Exosomes:composition, biogenesis and function[J]. Nat Rev Immunol, 2002, 2: 569-579. DOI:10.1038/nri855 |
| [9] |
LOBB R J, BECKER M, WEN S W, WONG C S, WIEGMANS A P, LEIMGRUBER A, et al. Optimized exosome isolation protocol for cell culture supernatant and human plasma[J/OL]. J Extracell Vesicles, 2015, 4: 27031. doi: 10.3402/jev.v4.27031.
|
| [10] |
LEVY E. Exosomes in the diseased brain: first insights from in vivo studies[J/OL]. Front Neurosci, 2017, 11: 142. doi: 10.3389/fnins.2017.00142.
|
| [11] |
上海交通大学. 一种分离高纯度尿液外泌体的方法和试剂盒: 中国, CN106929467A[P]. 2017-07-07.
|
| [12] |
ZHANG Y Z, LIU F, SONG C G, CAO X L, ZHANG Y F, WU H N, et al. Exosomes derived from human umbilical vein endothelial cells promote neural stem cell expansion while maintain their stemness in culture[J]. Biochem Biophys Res Commun, 2018, 495: 892-898. DOI:10.1016/j.bbrc.2017.11.092 |
| [13] |
王乐, 刘丹, 肖长义, 胡卫. 外泌体及其在乳腺癌发生发展中的作用[J]. 生命的化学, 2017, 37: 777-781. |
| [14] |
ZABEO D, CVJETKOVIC A, LÄSSER C, SCHORB M, LÖTVALL J, HÖÖG J L. Exosomes purified from a single cell type have diverse morphology[J/OL]. J Extracell Vesicles, 2017, 6: 1329476. doi: 10.1080/20013078.2017.1329476.
|
| [15] |
COOPER M, LI X C, ADAMS A B. What's hot, what's new:report from the American Transplant Congress 2017[J]. Am J Transplant, 2018, 18: 308-320. DOI:10.1111/ajt.14628 |
| [16] |
ZONG S, ZONG J, CHEN C, JIANG X, ZHANG Y, WANG Z, et al. Single molecule localization imaging of exosomes using blinking silicon quantum dots[J/OL]. Nanotechnology, 2018, 29: 065705. doi: 10.1088/1361-6528/aaa375.
|
| [17] |
GARCIA-ROMERO N, ESTEBAN-RUBIO S, RACKOV G, CARRIÓN-NAVARRO J, BELDA-INIESTA C, AYUSO-SACIDO A. Extracellular vesicles compartment in liquid biopsies:clinical application[J]. Mol Aspects Med, 2018, 60: 27-37. DOI:10.1016/j.mam.2017.11.009 |
 2018, Vol. 39
2018, Vol. 39


