2. 海军军医大学(第二军医大学)基础医学院学员二大队, 上海 200433;
3. 海军军医大学(第二军医大学)转化医学院转化研究中心, 上海 200433
2. The Second Student Team, College of Basic Medical Sciences, Navy Medical University(Second Military Medical University), Shanghai 200433, China;
3. Center of Translational Medicine, Institute of Translational Medicine, Navy Medical University(Second Military Medical University), Shanghai 200433, China
细胞外囊泡是由活细胞分泌的具有完整脂质双分子层膜结构的纳米囊泡状小体,包括微囊泡、外泌体等多种类型,通常呈杯托状、球形、椭球形或类球形[1-2]。细胞外囊泡内通常富含蛋白质、信使RNA(messenger RNA,mRNA)及微RNA(microRNA,miRNA),通过体液转运到特定部位[3-4]。近年研究发现,细胞外囊泡尤其是外泌体在疾病的临床诊断、损伤组织修复、免疫相关抗原递呈及肿瘤靶向治疗等领域都发挥着重要作用[5-9]。目前对于细胞外囊泡的研究主要集中在细胞培养基上清、血液以及其他体液中,直接对组织微环境或细胞外基质来源的成分研究甚少[10]。根据生物学一般原理,组织细胞分泌的细胞外囊泡首先进入细胞外的组织微环境,经组织液过渡后再进入血液、淋巴液等体液循环,进而影响全身其他组织和器官,因此组织微环境内细胞外囊泡的分离纯化及分析具有重要意义[11]。本研究分别采用德国Qiagen外泌体抽提试剂盒、美国SBI外泌体抽提试剂盒、超速离心法3种抽提方法,从肾脏、前列腺、皮肤和胃组织中抽提细胞外囊泡,比较不同组织采用不同抽提方法获得的细胞外囊泡的粒径和浓度差异,并对不同组织微环境中存在的细胞外囊泡的特点进行初步分析,为组织微环境外泌体研究提供实验支持。
1 材料和方法 1.1 实验样本、试剂及仪器本研究通过海军军医大学(第二军医大学)长海医院伦理委员会审核,实验样本均来自于长海医院的患者,患者均签署知情同意书。主要试剂:含10%胎牛血清的DMEM培养基、血清、胰蛋白酶均购自美国Gibco公司,磷酸盐缓冲液(phosphate buffer solution,PBS)购自生工生物工程(上海)股份有限公司,胶原蛋白酶、庆大霉素和两性霉素B均购自美国Sigma公司,50 mL离心管购自美国Corning公司,Qiagen76064外泌体快速抽提试剂盒为德国Qiagen公司产品,EXOQ5A-1沉淀法外泌体快速提取试剂为美国SBI公司产品。主要仪器:超速离心机为日本日立公司产品,二氧化碳恒温培养箱为美国Thermo公司产品,台式高速冷冻离心机为美国Beckman公司产品,组织温和破碎分离仪为德国美天旎生物技术有限公司产品,qNano ATS粒度分析仪为加拿大ATS公司产品。
1.2 不同组织细胞外基质悬液提取于活组织检查或手术治疗时,无菌取患者肾脏、前列腺、皮肤和胃组织(均经病理证实为正常组织),剪碎成2 mm见方的碎块后,加入含1%胶原蛋白酶的PBS,37 ℃消化过夜,次日组织溶解成稀糊状后,经过研磨和过滤,使用组织温和破碎分离仪进行组织破碎,获得单细胞悬液。低速离心(300×g,10 min)除去细胞碎片,得组织的细胞外基质悬液。
1.3 Qiagen试剂盒法提取细胞外囊泡将XBP缓冲液以1:1的体积比加入组织悬液中,轻轻倒转离心管5次混匀,放置至室温。将混合液添加到exoEasy旋转柱上,以500×g离心1 min。弃去流通液,将exoEasy旋转柱放回同一收集管,加入10 mL XWP缓冲液,5 000×g离心5 min除去残留的缓冲液,与收集管一起弃去流通液。将exoEasy旋转柱转移到新的收集管中,加入200 μL XE缓冲液到膜上,孵育1 min。以500×g离心5 min收集洗脱液。将洗脱液重新加入exoEasy旋转柱膜并孵育1 min。以5 000×g离心5 min,收集洗脱液并转移到合适的管中。
1.4 SBI试剂盒法提取细胞外囊泡收集30 mL组织悬液,3 000×g离心15 min除去细胞碎片。将上清液转移至无菌容器中,并将适量的ExoQuick外泌体沉淀溶液加入到生物流体中,4 ℃下冷冻过夜(至少12 h),1 500×g离心30 min。随后吸出上清液,1 500×g离心5 min去除残留的ExoQuick溶液。抽吸去除所有痕量液体,将颗粒沉淀重悬于200 μL无菌1×PBS,-80 ℃保存备用。
1.5 超速离心法分离细胞外囊泡收集30 mL组织悬液,首先在4 ℃下进行高速离心(10 000×g 1.5 h),收集上清进一步超速离心。将上清转移至超速离心塑料离心管中,4 ℃ 100 000×g离心2.5 h。转移时严格配平样品,要求离心管两两之间质量误差≤0.2 g,凹液面高度差≤2 mm。若样品较少,用PBS补足,保证每管液体量一致。离心结束后小心弃上清,加200 μL PBS。
1.6 qNano ATS粒度分析仪检测细胞外囊泡采用ATS粒度分析仪qNano技术,根据仪器说明书的标准流程检测细胞外囊泡的粒度和浓度。ATS粒度分析仪qNano技术采用可调电阻脉冲感测,利用纳米孔使粒子在纳米级上一颗一颗地被显现,获取有关纳米粒子的大小、浓度、电荷和动态信息。对单一粒子的粒径、分布和浓度进行精确分析并计数。其检测直径范围为50~10 000 nm,粒子浓度范围为105~1012个/mL。样品测量以40 μL的流体为基础样品,平均采集时间为5 min。
1.7 统计学处理应用SPSS 21.0软件进行数据分析。实验结果至少独立重复3次,数据以x±s表示,组间差异的比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 3种抽提方法获得的细胞外囊泡特征对比首先采用Qiagen试剂盒法、SBI试剂盒法和超速离心法分别对肾脏组织来源的细胞外囊泡进行分离纯化,并采用ATS粒度分析仪qNano技术对单一粒子的粒径、分布和浓度进行精确分析并计数。结果发现3种抽提方法均可获得较高浓度的细胞外囊泡,抽提获得的细胞外囊泡粒径主要分布在110~150 nm范围,符合外泌体粒径范围(40~150 nm[12]),提示囊泡类型主要为外泌体。见图 1。
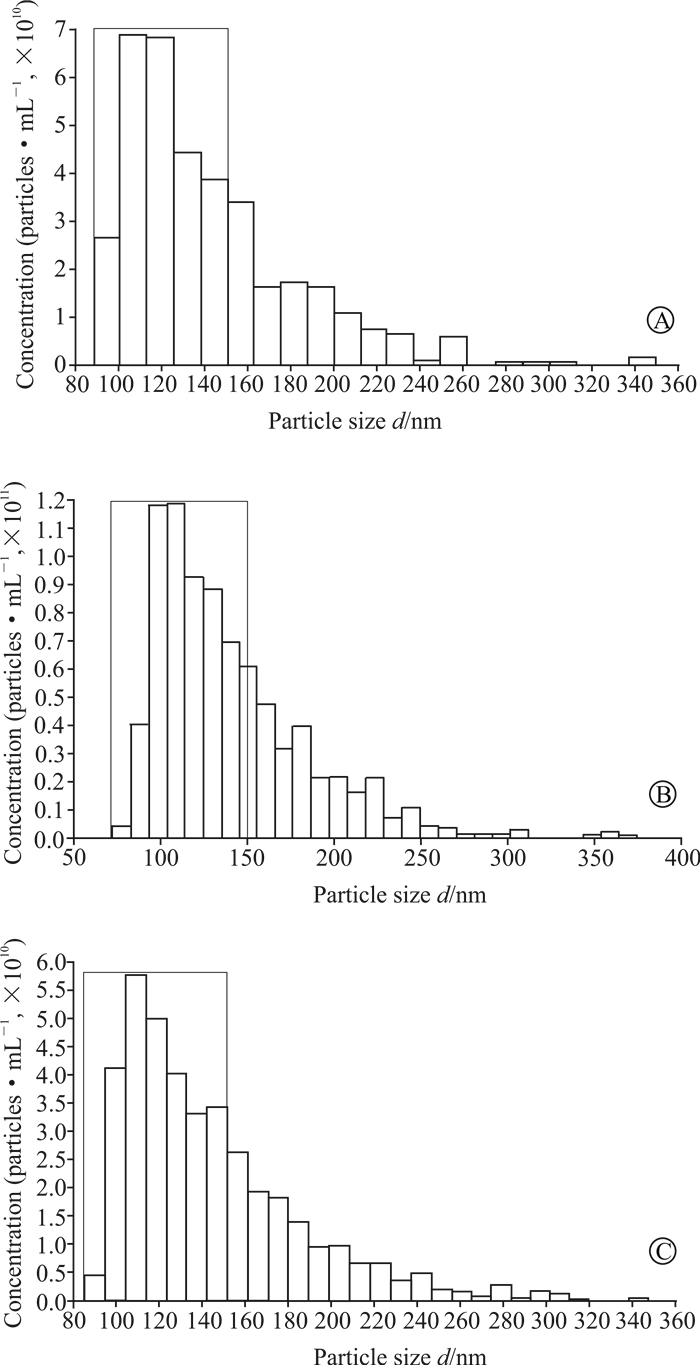
|
图 1 3种方法抽提的肾脏组织来源的细胞外囊泡粒径及浓度分布 Fig 1 Particle size and concentration distribution of extracellular vesicles derived from kidney extracted by three methods A: Qiagen exosome extraction kit; B: SBI exosome extraction kit; C: Ultracentrifugation. The diameter of exosomes was ranged in the rectangular box |
2.2 不同组织来源细胞外囊泡粒径分布比较
对来源于肾脏、前列腺、皮肤、胃4种组织,以上述3种抽提方法分离得到的细胞外囊泡采用ATS粒度分析仪qNano技术进行检测,结果显示,4种组织通过不同抽提方法获得的细胞外囊泡的粒径分布存在差异。如图 2所示,将Qiagen试剂盒法抽提的4种组织来源的细胞外囊泡根据平均粒径大小进行排列,肾脏>前列腺>皮肤>胃;将SBI试剂盒法抽提的4种组织来源的细胞外囊泡根据平均粒径大小进行排列,肾脏>胃>前列腺>皮肤;将超速离心法抽提的4种组织来源的细胞外囊泡根据平均粒径大小进行排列,肾脏>皮肤>前列腺>胃。不同组织使用3种抽提方法获得的细胞外囊泡的粒径大小差异均无统计学意义(P>0.05)。
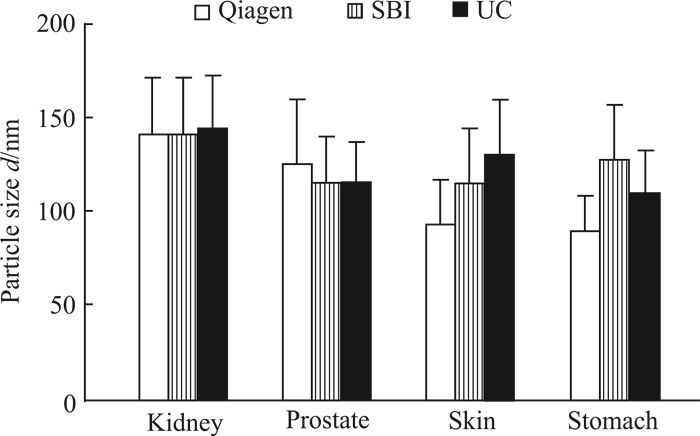
|
图 2 3种抽提方法获得的不同组织来源的细胞外囊泡粒径比较 Fig 2 Comparison of particle sizes of extracellular vesicles from different tissues extracted by three methods Qiagen: Qiagen exosome extraction kit; SBI: SBI exosome extraction kit; UC: Ultracentrifugation. n=3, x±s |
2.3 不同组织来源的细胞外囊泡浓度分析
采用ATS粒度分析仪qNano技术对不同组织来源、不同抽提方法获得的细胞外囊泡的浓度进行检测,结果显示来源于相同组织、以不同抽提方法获得的细胞外囊泡浓度波动较大,但经等质量组织换算后,各种组织来源的细胞外囊泡均以超速离心法抽提得到的浓度最高,肾脏、前列腺、皮肤和胃组织中细胞外囊泡浓度分别为(1.57±0.08)×1010个/mL、(2.23±0.11)×1010个/mL、(4.79±0.24)×109个/mL、(6.27±0.31)×109个/mL,与另外2种抽提方法比较差异有统计学意义(P<0.01)。4种组织间比较,以肾脏和前列腺来源的细胞外囊泡浓度较高,皮肤和胃来源的细胞外囊泡浓度较低,差异有统计学意义(P<0.05)。见图 3。
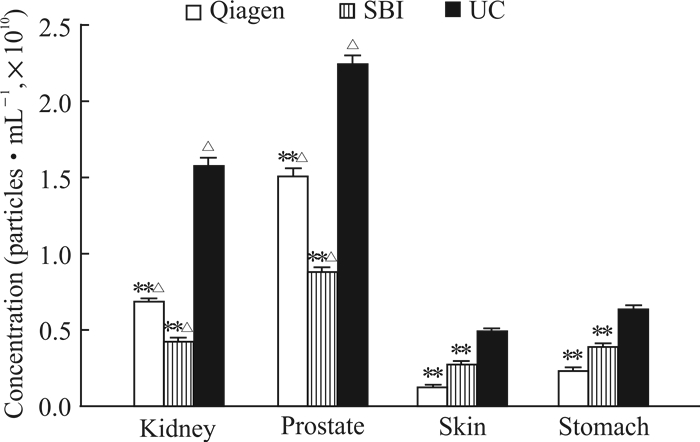
|
图 3 种抽提方法获得的不同组织来源的细胞外囊泡浓度比较 Fig 3 Comparison of concentrations of extracellular vesicles from different tissues extracted by three methods Qiagen: Qiagen exosome extraction kit; SBI: SBI exosome extraction kit; UC: Ultracentrifugation. **P < 0.01 vs UC; △P < 0.05 vs skin and stomach. n=3, x±s |
3 讨论
随着外泌体在生物医药研究领域的蓬勃发展,其价值也受到越来越多的关注,从初步的认识到精确的研究分析、从大致的作用到明确的功能,均提示外泌体有着巨大的研究前景[13]。外泌体应用于诊断研究的主流方向集中在血液以及其他体液中的外泌体分离及功能。但是,血液及其他体液中的外泌体来源复杂,往往是组织细胞、血液细胞、血管内皮细胞等多种层次多种类型细胞分泌的外泌体的混合体系[14-17],难以直观清晰地研究特定器官或组织的功能状态及损伤的诊断价值;此外,目前组织特异性外泌体的分选标志研究还存在一定的局限性。
本研究从肾脏、前列腺、皮肤和胃组织微环境中抽提细胞外囊泡,为了保证囊泡的真实性,取样时严格低温和及时进行相应的处理,并在最短的时间内取得样本。本研究采用Qiagen试剂盒法、SBI试剂盒法和超速离心法分离纯化4种组织微环境来源的细胞外囊泡,使用ATS粒度分析仪qNano技术检测囊泡的粒径和浓度,对不同提取方法和不同组织来源的细胞外囊泡进行比较,结果显示采用3种方法对4种组织的细胞外基质悬液进行抽提,均可获得纯化的细胞外囊泡,通过粒径分析显示其主要囊泡类型为外泌体,提示这3种抽提方法均适合于组织细胞外囊泡的抽提。但是,不同组织选取不同的抽提方案所得到的细胞外囊泡的浓度有所差别。3种方法间的比较结果显示,4种组织均以通过超速离心法得到的细胞外囊泡浓度最高(P<0.01);4种组织间的比较结果显示,以肾脏和前列腺来源的细胞外囊泡浓度较高,皮肤和胃来源的细胞外囊泡浓度较低(P<0.05)。这些结果对类似的研究可能具有一定的参考价值。
综上所述,本研究发现采用常用的抽提方法可以获得相对具有组织特异性的细胞外囊泡,囊泡的主要类型为外泌体。从组织中抽提细胞外囊泡可为组织特异性外泌体的标志物筛选、认识特定组织微环境的外泌体特征、研究组织微环境中的细胞相互作用提供新的研究策略。本研究通过比较Qiagen试剂盒、SBI试剂盒和超速离心法抽提组织中的细胞外囊泡,发现不同抽提方法对于不同组织的抽提效能有较大差别,这对于外泌体的研究,尤其是特异组织选择何种方式抽提外泌体将有一定的借鉴意义。本研究亦存在不足之处,如样本例数比较局限未进行大规模的临床采样;在研究样品性质时未进行电镜下观察,而电镜照片对于外泌体的观察可能会更直观。今后随着外泌体研究的进一步深入,更多、更细的方法及特性研究必然具有更大的意义。
| [1] |
WU Y, DENG W, KLINKE D J. Exosomes:improved methods to characterize their morphology, RNA content, and surface protein biomarkers[J]. Analyst, 2015, 140: 6631-6642. DOI:10.1039/C5AN00688K |
| [2] |
YIN M, LOYER X, BOULANGER C M. Extracellular vesicles as new pharmacological targets to treat atherosclerosis[J]. Eur J Pharmacol, 2015, 763(Pt A): 90-103. |
| [3] |
AZMI A S, BAO B, SARKAR F H. Exosomes in cancer development, metastasis, and drug resistance:a comprehensive review[J]. Cancer Metastasis Rev, 2013, 32(3/4): 623-642. |
| [4] |
COUMANS F A W, BRISSON A R, BUZAS E I, DIGNAT-GEORGE F, DREES E E E, EL-ANDALOUSSI S, et al. Methodological guidelines to study extracellular vesicles[J]. Circ Res, 2017, 120: 1632-1648. DOI:10.1161/CIRCRESAHA.117.309417 |
| [5] |
LANCASTER G I, FEBBRAIO M A. Exosome-dependent trafficking of HSP70:a novel secretory pathway for cellular stress proteins[J]. J Biol Chem, 2005, 280: 23349-23355. DOI:10.1074/jbc.M502017200 |
| [6] |
LENER T, GIMONA M, AIGNER L, BÖRGER V, BUZAS E, CAMUSSI G, et al. Applying extracellular vesicles based therapeutics in clinical trials-an ISEV position paper[J/OL]. J Extracell Vesicles, 2015, 4: 30087. doi: 10.3402/jev.v4.30087.
|
| [7] |
ROBBINS P D, MORELLI A E. Regulation of immune responses by extracellular vesicles[J]. Nat Rev Immunol, 2014, 14: 195-208. DOI:10.1038/nri3622 |
| [8] |
ONG S G, WU J C. Exosomes as potential alternatives to stem cell therapy in mediating cardiac regeneration[J]. Circ Res, 2015, 117: 7-9. DOI:10.1161/CIRCRESAHA.115.306593 |
| [9] |
SKOG J, WÜRDINGER T, VAN RIJN S, MEIJER D H, GAINCHE L, SENA-ESTEVES M, et al. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers[J]. Nat Cell Biol, 2008, 10: 1470-1476. DOI:10.1038/ncb1800 |
| [10] |
RAPOSO G, STOORVOGEL W. Extracellular vesicles:exosomes, microvesicles, and friends[J]. J Cell Biol, 2013, 200: 373-383. DOI:10.1083/jcb.201211138 |
| [11] |
XU R, GREENING D W, ZHU H J, TAKAHASHI N, SIMPSON R J. Extracellular vesicle isolation and characterization:toward clinical application[J]. J Clin Invest, 2016, 126: 1152-1162. DOI:10.1172/JCI81129 |
| [12] |
GREENING D W, GOPAL S K, XU R, SIMPSON R J, CHEN W. Exosomes and their roles in immune regulation and cancer[J]. Semin Cell Dev Biol, 2015, 40: 72-81. DOI:10.1016/j.semcdb.2015.02.009 |
| [13] |
LÄSSER C, ALIKHANI V S, EKSTRÖM K, ELDH M, PAREDES P T, BOSSIOS A, et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages[J/OL]. J Transl Med, 2011, 9: 9. doi: 10.1186/1479-5876-9-9.
|
| [14] |
SKRINER K, ADOLPH K, JUNGBLUT P R, BURMESTER G R. Association of citrullinated proteins with synovial exosomes[J]. Arthritis Rheum, 2006, 54: 3809-3814. DOI:10.1002/(ISSN)1529-0131 |
| [15] |
CABY M P, LANKAR D, VINCENDEAU-SCHERRER C, RAPOSO G, BONNEROT C. Exosomal-like vesicles are present in human blood plasma[J]. Int Immunol, 2005, 17: 879-887. DOI:10.1093/intimm/dxh267 |
| [16] |
RECORD M, CARAYON K, POIROT M, SILVENTE-POIROT S. Exosomes as new vesicular lipid transporters involved in cell-cell communication and various pathophysiologies[J]. Biochim Biophys Acta, 2014, 1841: 108-120. DOI:10.1016/j.bbalip.2013.10.004 |
| [17] |
PISITKUN T, SHEN R F, KNEPPER M A. Identification and proteomic profiling of exosomes in human urine[J]. Proc Natl Acad Sci USA, 2004, 101: 13368-13373. DOI:10.1073/pnas.0403453101 |
 2018, Vol. 39
2018, Vol. 39


