自1922年利用胰岛素治疗糖尿病以来,胰岛素已成为各类糖尿病患者控制血糖和缓解病程的首选用药。由于胰岛素口服给药易受胃肠道pH和酶的影响而降解,同时因其相对分子质量较大很难通过小肠上皮细胞被吸收进入体循环[1],导致胰岛素口服给药的生物利用度较低,因此临床上通常采取注射方式给药。鉴于胰岛素注射给药方式存在诸多不良反应[2-3],目前生物医学工程科学家们致力于使用物理技术促进胰岛素的透皮吸收,其中大部分研究主要集中于利用外电场促进胰岛素的作用效果[4-7]。但外电场作用对胰岛素结构等方面的影响少有报道,而后者直接影响胰岛素透皮给药系统的部分机制和疗效。为了更直观探索外电场对胰岛素降糖效果的影响及其相关机制,本研究通过介电常数d33 系数、核磁共振和凝胶电泳等方法研究经外电场处理后胰岛素的极化规律,并将携带不同表面电位的驻极体作用后的胰岛素注入糖尿病模型大鼠以观察其降糖效果。
1 材料和方法 1.1 实验材料与设备聚丙烯膜(PP膜,膜厚13 µm;日本东丽株式会社)。猪胰岛素(江苏万邦生化医药股份有限公司),链脲佐菌素(streptozotocin,STZ;美国Sigma公司),丙烯酸树脂(Eudragit E100,德国Röhm公司),标准蛋白(聚丙烯酰胺凝胶电泳低相对分子量标准蛋白,检测的相对分子质量范围为14 400~97 400;上海升正生物技术有限公司)。磷酸二氢钾、氢氧化钠、柠檬酸、柠檬酸钠、氯化钠、柠檬酸丁三酯、乙醇等均购自国药集团化学试剂有限公司,pH 7.4磷酸盐缓冲液(phosphate buffer solution,PBS)按《中华人民共和国药典》配制。栅控恒压电晕充电系统(大连理工大学静电与特种电源研究所),ESR102A型振动电容静电计(北京华晶汇科技有限公司),ZJ-3A型准静态d33测量仪(中国科学院声学研究所),AC-300P型核磁共振谱仪(德国Buruker公司),OneTouch®UtraEasyTM血糖仪(美国Johnson公司),DYCZ-30C型凝胶电泳仪、垂直板电泳槽及其附件等(北京六一生物科技有限公司)。
1.2 驻极体制备及等效表面电位的测量采用栅控恒压电晕充电系统对PP膜进行充电,电晕电压为-15 kV,充电时间为5 min,制备成-500、-1 000、-1 500 V的负极性驻极体。使用振动电容静电计通过补偿法测量实验各驻极体在48 h内的等效表面电位。
1.3 经驻极体处理的胰岛素溶液的表面电位测定将封装有1 mL胰岛素溶液的PP小袋分别置于-500、-1 000和-1 500 V驻极体充电面上12 h,使用振动电容静电计通过补偿法进行表面电位测定。
1.4 d33系数测量丙烯酸树脂用乙醇溶解后放置过夜,加入柠檬酸丁三酯,边搅拌边加入胰岛素溶液(pH 7.4),混合均匀后铺于PP膜(背衬层)上,自然干燥12 h,制备得胰岛素贴剂。将胰岛素贴剂的背衬层分别放置在-500、-1 000、-1 500 V驻极体的充电面上24 h,利用准静态d33测量仪测量0~24 h内胰岛素的极化规律与外静电场的关系。
1.5 核磁共振测量与凝胶电泳分别取pH 7.4的胰岛素溶液和经-1 000 V驻极体作用12 h的胰岛素溶液30 µL,经制胶、电泳、染色和脱色等过程行凝胶电泳实验[8],研究外电场对胰岛素分子聚合的影响。用氘代试剂配制胰岛素溶液,并取1 mL胰岛素溶液封装于PP小袋中经-1 000 V驻极体作用12 h,运用核磁共振谱仪测定未经驻极体作用和经驻极体作用后胰岛素的氢核磁共振谱,研究外电场对胰岛素分子结构的影响。
1.6 实验动物与降糖实验清洁级成年雄性SD大鼠,体质量(200±20)g,由海军军医大学(第二军医大学)实验动物中心提供[动物生产许可证号:SCXK(沪)2013-0016]。参考文献[9]构建糖尿病模型大鼠,并按体质量将大鼠随机配对分组,设无驻极体作用胰岛素组、-500 V驻极体作用胰岛素组、-1 000V驻极体作用胰岛素组和-1 500 V驻极体作用胰岛素组,以正常SD大鼠作为对照组。对照组大鼠皮下注射0.9%生理盐水溶液1 mL/kg。取胰岛素配制成浓度为0.1 mg/mL(2.8 IU/kg,pH 7.4)的注射液,给予无驻极体作用胰岛素组糖尿病大鼠皮下注射无驻极体作用的胰岛素溶液(1 mL/kg),3个驻极体作用胰岛素组糖尿病大鼠分别皮下注射-500、-1 000和-1 500 V驻极体作用的胰岛素(1 mL/kg)。0、0.5、1.5、3、4.5、6、8 h后测定各组大鼠的血糖含量。
1.7 统计学处理应用SPSS 17.0软件行数据处理。所有数据均以x±s表示,组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 胰岛素溶液两侧静电场随时间的变化规律研究测量胰岛素溶液的驻极体外静电场和作用于胰岛素溶液两侧静电场的变化规律(胰岛素溶液两侧静电场可依据驻极体等效表面电位和透过胰岛素溶液的驻极体等效表面电位的差值来确定),结果如图 1所示。-500、-1 000、-1 500 V驻极体在12 h内分别有约290、480、920 V的电位差作用于胰岛素溶液,表明驻极体的等效表面电位越高,作用于胰岛素溶液的外静电场强度越强。不同表面电位负极性驻极体的等效表面电位随时间延长具有相似的变化规律:0~4 h内呈近似指数规律上升,4~48 h内基本保持不变。考虑到PP驻极体的表面电位在12 h内衰减很少,实验结果表明透过胰岛素溶液的负极性驻极体的等效表面电位具有良好的稳定性,胰岛素在驻极体外静电场作用下可被极化。
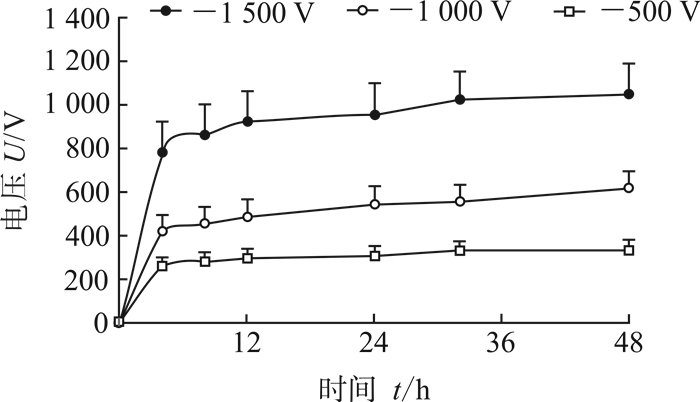
|
图 1 不同表面电位负极性驻极体作用时胰岛素溶液两侧静电场的变化规律 n=3, x±s |
2.2 外静电场引起胰岛素的极化
为进一步探究不同表面电位负极性驻极体引起胰岛素的极化规律以及胰岛素的极化程度与驻极体外静电场的关系,本研究利用准静态d33测量仪测量无驻极体作用及经-500、-1 000、-1 500 V驻极体作用24 h 4组胰岛素贴剂的d33值。结果(图 2)显示,不同表面电位负极性驻极体作用胰岛素贴剂的d33值在0~8 h内无明显变化,8 h后均随时间延长呈指数规律上升。与无驻极体作用胰岛素组相比,-500、-1 000、-1 500 V驻极体作用12 h时胰岛素贴剂的d33值分别提高了14.7倍、26.7倍和45.0倍。胰岛素受外静电场作用而极化,其极化程度与驻极体表面电位的绝对值成正比。外电场作用12~24 h后,不同表面电位负极性驻极体作用胰岛素贴剂的d33值略有增加,但差异均无统计学意义(P>0.05),表明此时间段内胰岛素的极化基本趋于饱和。
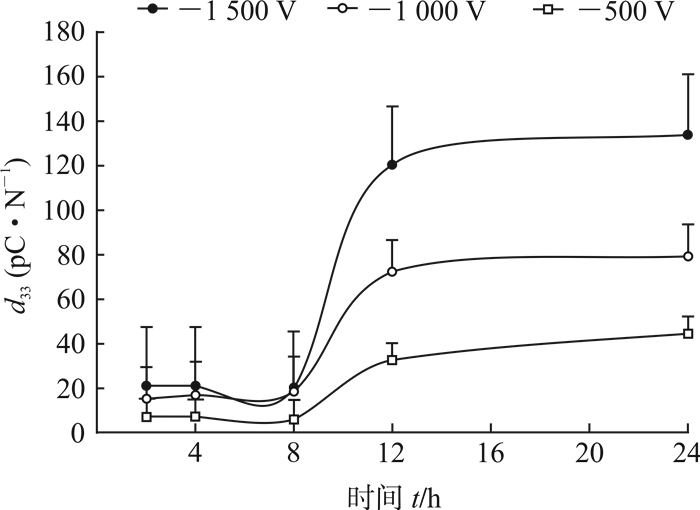
|
图 2 不同表面电位负极性驻极体作用胰岛素贴剂的d33值随时间的变化 n=6, x±s |
2.3 外静电场对胰岛素结构的影响
通过核磁共振谱比较未经驻极体作用和经-1 000 V驻极体作用12 h后胰岛素的核磁共振氢谱,探讨外静电场引起胰岛素极化的形成机制。结果(图 3)显示,-1 000 V驻极体作用12 h后胰岛素各峰群的化学位移值较未经驻极体作用胰岛素组没有发生明显偏移,表明-1 000 V驻极体处理不改变胰岛素的化学环境,胰岛素的空间结构也未发生明显变化。除峰位位于2.41和2.50的峰值略有增加外,其他峰及其峰群的峰值和峰面积均有不同程度的减少,其中化学位移为0.73的峰面积明显减少,提示经电场作用后胰岛素中大部分基团的氢键含量有所减少,如胰岛素分子氢键网络中色氨酸(Tyr)和苯丙氨酸(Phe)的甲基减少以及赖氨酸、精氨酸、酪氨酸和组氨酸等的β-、γ-、δ-CH2减少,但谷氨酸的β-、γ-CH2增加,整体减少的氢键改变了胰岛素的极化状态和胰岛素分子间的静电相互作用,提高了胰岛素结构中单聚体的比例。
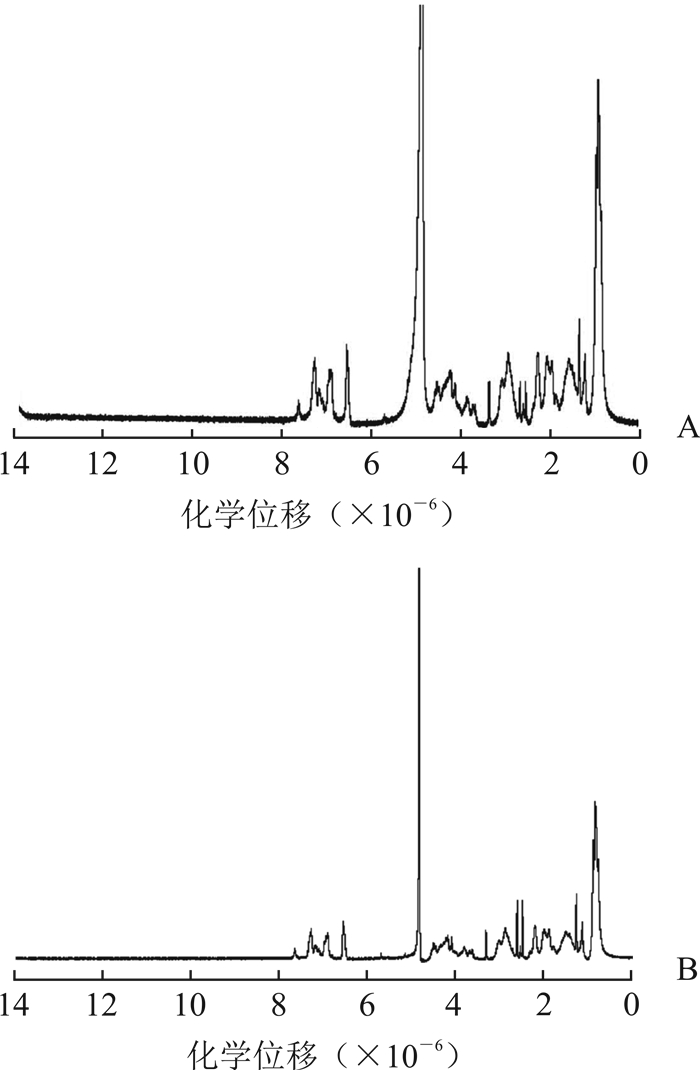
|
图 3 未经驻极体作用(A)和经-1 000 V驻极体作用(B)胰岛素的核磁共振氢谱 |
为深入研究静电场对胰岛素结构的影响,利用蛋白凝胶电泳研究经-500、-1 000、-1 500 V驻极体作用12 h后胰岛素相对分子质量的改变。结果显示,未经驻极体作用的胰岛素多以单聚和二聚体形式存在(猪胰岛素单聚体的相对分子质量约为5 800,二聚体约为11 600),经不同驻极体电场作用后胰岛素的相对分子质量及其存在形式与未经驻极体作用的胰岛素相比无明显差异,表明驻极体外静电场不改变胰岛素的一、二级结构及其聚集状态,经电场作用的胰岛素主要以单聚体和二聚体的形式存在。
2.4 经外静电场作用后胰岛素的降糖效果各组糖尿病大鼠血糖含量随时间的变化规律如图 4所示。经不同表面电位负极性驻极体作用的胰岛素的降糖规律与未经驻极体作用胰岛素相似。0~3 h内-1 000 V驻极体作用胰岛素的降糖效果最佳,8 h时-500 V和-1 000 V驻极体作用胰岛素组大鼠的血糖含量分别为(5.96±1.60)mmol/L和(7.88±2.99)mmol/L,与无驻极体作用胰岛素组[(10.11±6.66) mmol/L]相比分别下降了50.9%和22.1%(P<0.05),表明-500 V和-1 000 V驻极体作用后的胰岛素均具有良好的降糖效果。-1 500 V驻极体作用后胰岛素的降糖效果劣于无驻极体作用胰岛素组,提示电场对胰岛素的降糖效果存在窗口范围,并不是驻极体携带电压越高降糖效果越好。
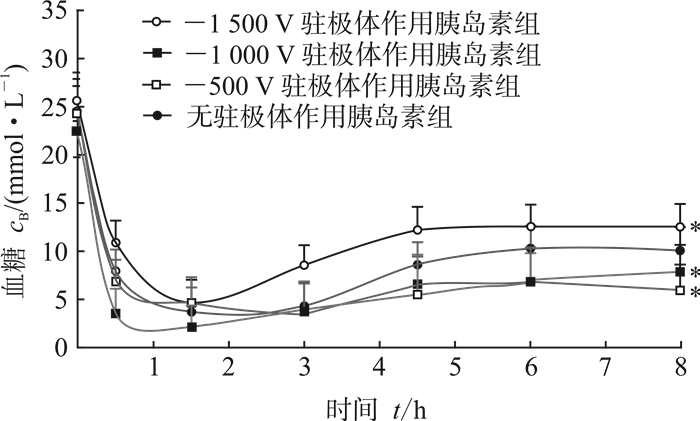
|
图 4 不同表面电位负极性驻极体作用胰岛素的降糖规律 *P<0.05与无驻极体作用胰岛素组相比. n=6, x±s |
3 讨论
本研究将PP膜制备成不同电压的负极性驻极体,并以其产生的稳定外静电场作为电场源作用于胰岛素溶液。实验结果显示,不同表面电位负极性驻极体作用胰岛素溶液48 h时,胰岛素溶液两侧的电位差均随时间延长呈指数规律上升,4 h后逐渐趋于恒定。这说明在外电场作用下胰岛素分子被极化,极化的胰岛素分子沿外电场方向取向,宏观上呈现出胰岛素两侧电位差呈指数规律上升,且胰岛素分子的极化程度与驻极体的表面电位呈正相关;d33值的测量结果也进一步显示了胰岛素的极化规律。
核磁共振氢谱显示经外静电场作用的胰岛素的空间结构没有发生明显变化,但部分基团氢键含量发生了变化,改变了胰岛素结构中氢键网络和胰岛素的极化状态,进一步影响胰岛素二聚体的结构稳定性,从而提高了胰岛素结构中单聚体的比例,有效提高了胰岛素的降糖效果。凝胶电泳实验也证实了驻极体外电场作用并未增加胰岛素的聚集性,电场作用后胰岛素仍以单聚体和二聚体形式存在。
动物实验进一步说明经-500、-1 000 V驻极体处理的胰岛素的空间结构没有发生改变。胰岛素可能在外静电场作用下被极化,导致胰岛素单体和单体接触界面上的静电电势分布及其静电作用力产生变化,进而出现大量胰岛素单体[10-11]。此外,-1 500 V驻极体作用胰岛素的降糖效果劣于未经驻极体作用的胰岛素,说明电场作用提高胰岛素的降糖效果具有电压窗口效应,但相关机制需进一步研究。
综上所述,负极性驻极体产生的静电场可引起胰岛素的弱极化,改变胰岛素的带电特性,增加胰岛素单体间的静电排斥力,从而减弱胰岛素单体间的凝聚力和聚合程度,有利于胰岛素单体的形成,促进胰岛素的降糖作用。合理选择不同表面电位驻极体可有效提高胰岛素的降糖效果。
| [1] |
SHAH R B, PATEL M, MAAHS D M, SHAH V N. Insulin delivery methods:past, present and future[J]. Int J Pharm Investig, 2016, 6: 1-9. DOI:10.4103/2230-973X.176456 |
| [2] |
MARWAH H, GARG T, RATH G, GOYAL A K. Development of transferosomal gel for transdermal delivery of insulin using iodine complex[J]. Drug Deliv, 2016, 23: 1636-1644. DOI:10.3109/10717544.2016.1155243 |
| [3] |
FEISZTHUBER H, BHATNAGAR S, GYÖNGY M, COUSSIOS C C. Cavitation-enhanced delivery of insulin in agar and porcine models of human skin[J]. Phys Med Biol, 2015, 60: 2421-2434. DOI:10.1088/0031-9155/60/6/2421 |
| [4] |
MOHAMMAD E A, ELSHEMEY W M, ELSAYED A A, ABD-ELGHANY A A. Electroporation parameters for successful transdermal delivery of insulin[J/OL]. Am J Ther, 2016, 23: e1560-e1567. doi: 10.1097/MJT.0000000000000198.
|
| [5] |
HERMANNS N, LILLY L C, MADER J K, ABERER F, RIBITSCH A, KOJZAR H, et al. Novel simple insulin delivery device reduces barriers to insulin therapy in type 2 diabetes:results from a pilot study[J]. J Diabetes Sci Technol, 2015, 9: 581-587. DOI:10.1177/1932296815570709 |
| [6] |
HADEBE S I, NGUBANE P S, SERUMULA M R, MUSABAYANE C T. Transdermal delivery of insulin by amidated pectin hydrogel matrix patch in streptozotocin-induced diabetic rats: effects on some selected metabolic parameters[J/OL]. PLoS One, 2014, 9: e101461. doi: 10.1371/journal.pone.0101461.
|
| [7] |
DONNELLY R F, GARLAND M J, ALKILANI A Z. Microneedle-iontophoresis combinations for enhanced transdermal drug delivery[J]. Methods Drug Deliv, 2014, 1141: 121-132. |
| [8] |
孟庆石, 张光祥, 潘映红. 蛋白质复合体非变性凝胶电泳技术及其应用新进展[J]. 生物技术通报, 2010, 6: 57-64. |
| [9] |
王美玲, 黄平, 梁媛媛, 苑旺, 郭鑫, 江键. 正极性驻极体对胰岛素降糖效果影响的动物实验研究[J]. 高电压技术, 2014, 40: 3816-3821. |
| [10] |
CISZAK E, BEALS J M, FRANK B H, BAKER J C, CARTER N D, SMITH G D. Role of C-terminal B-chain residues in insulin assembly:the structure of hexameric LysB28ProB29-human insulin[J]. Structure, 1995, 3: 615-622. DOI:10.1016/S0969-2126(01)00195-2 |
| [11] |
BRANGE J, RIBEL U, HANSEN J F, DODSON G, HANSEN M T, HAVELUND S, et al. Monomeric insulins obtained by protein engineering and their medical implications[J]. Nature, 1988, 333: 679-682. DOI:10.1038/333679a0 |
 2018, Vol. 39
2018, Vol. 39


