2. 海军军医大学(第二军医大学)附属公利医院耳鼻咽喉科, 上海 200135;
3. 海军军医大学(第二军医大学)长海医院耳鼻咽喉头颈外科, 上海 200433
2. Department of Otolaryngology, Gongli Hospital, Navy Medical University(Second Military Medical University), Shanghai 200135, China;
3. Department of Otolaryngology Head and Neck Surgery, Changhai Hospital, Navy Medical University(Second Military Medical University), Shanghai 200433, China
鼻咽癌是我国南方地区高发肿瘤之一,占头颈部肿瘤发病率的首位,且其发病率呈不断上升趋势[1]。虽然目前针对鼻咽癌的诊断和治疗手段不断发展,但其5年生存率仍仅为50%~60%,总体治疗效果达不到患者期望[2-3]。由于鼻咽癌位置深在,手术难以彻底切除,目前放射治疗是最主要的治疗手段,但传统放射治疗难以耐受的不良反应和放射治疗抵抗限制了其应用。目前,越来越多的研究发现中药来源的天然化合物在肿瘤治疗方面发挥着重要作用[4-5]。雷公藤红素是从卫矛科植物雷公藤中提取的一种三萜类化合物,其在抗炎、抗肿瘤及免疫抑制等方面发挥重要的药理作用[6-8]。然而,关于雷公藤红素对鼻咽癌细胞增殖、迁移及上皮间质转化(epithelial-mesenchymal transition,EMT)等的作用研究尚未见相关报道。本研究以人鼻咽癌HNE1、CNE2细胞为研究对象,观察雷公藤红素对鼻咽癌细胞增殖、迁移和EMT的影响。
1 材料和方法 1.1 试剂与材料人鼻咽癌HNE1、CNE2细胞购自中国科学院上海生命科学研究院细胞生物学研究所细胞库,均按细胞培养说明使用含10%胎牛血清、1%双抗(100 U/mL青霉素和100 µg/mL链霉素)的RPMI 1640培养液于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。雷公藤红素(C0869,纯度≥98%)、二甲基亚砜(DMSO)购自美国Sigma公司;E-钙黏蛋白、β-连环蛋白、N-钙黏蛋白、波形蛋白、内参蛋白甘油醛-3-磷酸脱氢酶(GAPDH)抗体均购自美国Cell Signaling Technology公司。细胞划痕实验小皿购自德国Ibidi公司;CCK-8试剂盒购自日本同仁化学研究所;结晶紫染色液购自生工生物工程(上海)股份有限公司,蛋白质印迹实验试剂盒购自碧云天生物技术研究所。
1.2 雷公藤红素药物安全剂量筛选取对数生长期细胞悬液100 µL,按30%~50%的浓度比例铺于96孔板,培养24 h待细胞贴壁后分别加入10 µL浓度为0.6、0.9、1.2、1.5、1.8、2.1、2.4 µmol/L的雷公藤红素溶液,以仅加入RPMI 1640培养液为空白对照组,以加入含等体积DMSO的培养液(不含雷公藤红素)为对照组,37 ℃培养24 h,PBS清洗3次。每孔加入10 µL浓度为5 mg/mL的CCK-8溶液,37 ℃水浴箱中孵育3 h,用酶标仪检测450 nm波长的光密度(D)值,计算各组细胞存活率:细胞存活率(%)=(D实验组-D空白对照组)/(D对照组-D空白对照组)×100%。每组实验重复3次。发现雷公藤红素浓度为2.1 µmol/L时,HNE1、CNE2细胞存活率相比对照组(0 µmol/L雷公藤红素)均降低,而雷公藤红素浓度为0.6~1.8 µmol/L时,两种细胞存活率与对照组相比无明显差异。因此,选用浓度为1.8 µmol/L雷公藤红素行后续实验。
1.3 细胞增殖活性检测取对数生长期细胞悬液100 µL,按30%~50%的浓度比例铺于96孔板,培养24 h待细胞贴壁后加入1.8 µmol/L的雷公藤红素10 µL,以仅加入RPMI 1640培养液为空白对照组,以加入含等体积DMSO的培养液为对照[9]。37 ℃培养12、24、48、72 h后,每孔加入10 µL浓度为5 mg/mL的CCK-8溶液,37 ℃水浴箱中孵育3 h,用酶标仪检测450 nm波长的D值,计算细胞存活率,绘制细胞相对数量曲线。每组实验重复3次。
1.4 细胞划痕实验取对数生长期细胞以每孔3×104个细胞的密度铺于细胞划痕小皿中,培养24 h待细胞贴壁后移去小皿,加入RPMI 1640完全培养液3 mL、1.8 µmol/L雷公藤红素溶液30 µL,以加入含等体积DMSO的培养液为对照组,培养48 h后拍照记录,与加药前进行比较并计算迁移宽度。计算公式:相对迁移宽度=拍照时迁移宽度/加药前平均划痕宽度。
1.5 细胞克隆形成实验取对数生长期细胞以每孔500个细胞的密度接种于6孔板中,加入RPMI 1640完全培养液3 mL、1.8 µmol/L雷公藤红素溶液30 µL,培养2周,每日更换含有药物的培养液,以加入含等体积DMSO的培养液为对照。培养结束后用0.1%的结晶紫染色液固定染色,染色结束后显微镜下观察克隆细胞数。
1.6 细胞黏附实验取对数生长期细胞以每孔5×104个细胞的密度接种于24孔板中,加入RPMI 1640完全培养液1 mL、1.8 µmol/L雷公藤红素溶液10 µL培养,以加入含等体积DMSO的培养液为对照,1 h后洗去未贴壁细胞。贴壁细胞用胰酶消化后计数,计算细胞黏附率:黏附率(%)=(贴壁细胞数/细胞总数)×100%。
1.7 细胞分离实验取对数生长期细胞以每孔5×104个细胞的密度接种于24孔板,加入RPMI 1640完全培养液1 mL、1.8 µmol/L雷公藤红素溶液10 µL处理24 h,以加入含等体积DMSO的培养液为对照。胰酶消化3 min,加入完全培养液终止消化,收集消化脱落的细胞进行计数。继续加入胰酶消化剩余细胞至完全脱落,收集细胞并计数。计算细胞分离率:分离率(%)=[0.025%的胰酶首次消化的细胞/(0.025%胰酶首次消化的细胞+0.025%胰酶再次消化的细胞)]×100%。
1.8 蛋白质印迹实验取对数生长期细胞,以每孔1×106个细胞的密度接种于6孔板中,加入RPMI 1640完全培养液3 mL、1.8 µmol/L雷公藤红素溶液10 µL处理6 h,以加入含等体积DMSO的培养液为对照,提取蛋白,BCA法测定蛋白浓度。配制10%分离胶进行电泳,转膜后加入一抗(1:1 000稀释)4 ℃孵育过夜,TBST清洗3次,加入相应二抗(1:2 000稀释)室温孵育2 h,用TBST清洗3次,采用凝胶图像处理系统分析目的条带灰度值。
1.9 统计学处理使用SPSS 22.0软件进行数据分析。数据以x±s表示,组间比较采用单因素方差分析或两样本均数比较的t检验。检验水准(α)为0.05。
2 结果 2.1 雷公藤红素对鼻咽癌细胞增殖的影响细胞增殖实验结果显示,与DMSO对照组比较,采用1.8 µmol/L雷公藤红素处理24、48、72 h后,鼻咽癌细胞HNE1的增殖能力均降低(P均 < 0.05);1.8 µmol/L雷公藤红素处理48、72 h后,鼻咽癌细胞CNE2的增殖能力均降低(P均 < 0.05)。见图 1。
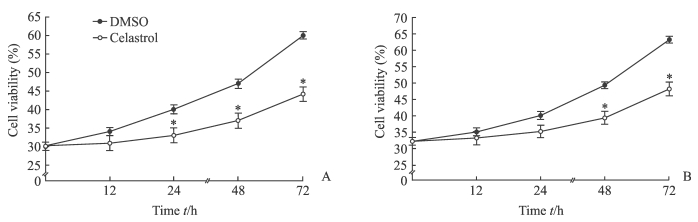
|
图 1 雷公藤红素(1.8 µmol/L)对鼻咽癌细胞HNE1、CNE2增殖的影响 Fig 1 ffect of celastrol (1.8 µmol/L) on proliferation of nasopharyhgeal carcinoma cell lines HNE1 and CNE2 A: HNE1 cells; B: CNE2 cells. DMSO: Dimethyl sulfoxide. *P < 0.05 vs DMSO (control) group. n=3, x±s |
2.2 雷公藤红素对鼻咽癌细胞侵袭、转移能力的影响
细胞划痕实验结果(图 2)显示,1.8 µmol/L雷公藤红素处理48 h后,鼻咽癌细胞HNE1和CNE2的相对迁移宽度均大于相应DMSO对照组(P均 < 0.05),表明雷公藤红素可有效抑制细胞迁移。

|
图 2 雷公藤红素(1.8 µmol/L)对鼻咽癌细胞HNE1、CNE2侵袭、转移能力的影响 Fig 2 Effect of celastrol (1.8 µmol/L) on invasion and metastasis of nasopharyngeal carcinoma cell lines HNE1 and CNE2 A, B: HNE1 cells; C, D: CNE2 cells. DMSO: Dimethyl sulfoxide. Original magnification: ×400 (A, C). *P < 0.05 vs DMSO (control) group at same time. n=3, x±s |
2.3 雷公藤红素对鼻咽癌细胞HNE1、CNE2克隆形成能力及黏附、分离能力的影响
细胞克隆实验结果(图 3)显示,与DMSO对照组相比,1.8 µmol/L雷公藤红素处理细胞2周后,鼻咽癌细胞HNE1、CNE2的克隆形成数均减少(372±36 vs 1 487±47,201±21 vs 1 583±32;P均 < 0.05)。
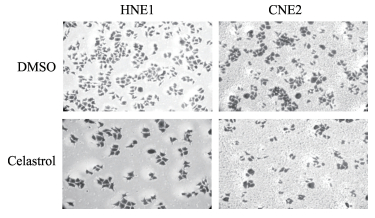
|
图 3 雷公藤红素(1.8 µmol/L)对鼻咽癌细胞HNE1、CNE2克隆形成能力的影响 Fig 3 Effect of celastrol (1.8 µmol/L) on clone formation of nasopharyngeal carcinoma cell lines HNE1 and CNE2 DMSO: Dimethyl sulfoxide. Original magnification: ×400 |
进一步验证雷公藤红素对鼻咽癌细胞黏附、分离能力的影响,结果显示,1.8 µmol/L雷公藤红素处理后,HNE1细胞的黏附率为(51.25±1.39)%、分离率为(41.35±1.66)%,均低于相应DMSO对照组[(89.32±1.53)%,(77.82±2.73)%;P均 < 0.05];CNE2细胞的黏附率为(44.12±1.19)%、分离率为(38.98±2.14)%,均低于相应DMSO对照组[(83.22±2.21)%,(71.42±2.41)%;P均 < 0.05]。
2.4 雷公藤红素对鼻咽癌细胞HNE1、CNE2 EMT标志蛋白表达的影响蛋白质印迹结果(图 4)显示,与DMSO对照组相比,1.8 µmol/L雷公藤红素处理6 h后,HNE1、CNE2细胞中E-钙黏蛋白、β-连环蛋白的表达均升高(P < 0.05),N-钙黏蛋白、波形蛋白的表达均降低(P < 0.05)。

|
图 4 雷公藤红素(1.8 µmol/L)对鼻咽癌细胞HNE1、CNE2 EMT相关蛋白表达的影响 Fig 4 Effect of celastrol (1.8 µmol/L) on expression of EMT in nasopharyngeal carcinoma cell lines HNE1 and CNE2 A, B: HNE1 cells; C, D: CNE2 cells. EMT: Epithelial-mesenchymal transition-related protein; DMSO: Dimethyl sulfoxide; GAPDH: Glyceraldehyde 3-phosphate dehydrogenase. *P < 0.05 vs DMSO (control) group. n=3, x±s |
3 讨论
鼻咽癌主要以低分化鳞癌为主,因其病变部位隐匿,早期不易被发现,故临床就诊时约60%的患者已出现颈部淋巴结转移,20%因颅神经受累而就诊,影响患者预后[1]。目前放射治疗是鼻咽癌的主要治疗手段,尽管近年来临床采用了同步放射化学治疗、调强适形放射治疗等新的治疗措施,但放射治疗抵抗和并发症的发生仍使鼻咽癌的疗效不尽人意。因此,研究鼻咽癌发生、发展的分子机制,开发新的鼻咽癌治疗手段,对改善鼻咽癌预后具有十分重要的意义。
雷公藤红素是雷公藤单体之一,其抗肿瘤作用已被国内外学者证实。国内有学者报道雷公藤红素可明显抑制肝癌HepG2细胞、胆囊癌NOZ细胞的增殖并诱导其凋亡,其机制可能与雷公藤红素增强线粒体通透性、促使凋亡诱导因子释放有关[10-11]。国外亦有学者研究发现,雷公藤红素对子宫癌、乳腺癌、胰腺癌、前列腺癌等肿瘤的增殖和转移均有较强的抑制作用[12-14]。但有关雷公藤红素对鼻咽癌作用的研究国内外报道较少。
细胞凋亡是一种基因控制的细胞程序性自杀过程。在正常生理条件下,细胞增殖和凋亡处于平衡状态,一旦这种平衡被破坏,细胞凋亡失控,无限增殖的细胞不能分化成熟,即产生了肿瘤细胞;肿瘤细胞克隆性异常增殖就形成了肿瘤。目前临床上主要通过抑制肿瘤细胞的增殖和诱导其凋亡来实现抗肿瘤的目的。湛达河等[15]研究提示雷公藤红素对鼻咽高分化鳞癌CNE1细胞有明显的增殖抑制及放射增敏作用,其增殖抑制机制可能是通过上调细胞膜表面的Fas抗原表达进而激活凋亡相关蛋白caspase,从而导致鼻咽癌细胞凋亡[16]。本研究通过细胞增殖实验筛选雷公藤红素药物的安全有效剂量,结果发现当雷公藤红素浓度大于1.8 µmol/L时细胞存活率明显下降,因此本研究选用1.8 µmol/L浓度的雷公藤红素作为后续研究的使用浓度。本研究用1.8 µmol/L的雷公藤红素处理鼻咽癌HNE1、CNE2细胞后,细胞的增殖能力受到较强的抑制,与国内对鼻咽高分化鳞癌CNE1细胞的研究结果[15]一致。同时雷公藤红素对HNE1、CNE2细胞的侵袭、转移、克隆形成、细胞黏附和分离能力均有显著的抑制作用。
EMT是上皮细胞失去细胞极性并获得间充质表型,从而诱导细胞增殖、迁移的过程,是肿瘤发生增殖转移的关键机制之一[17],其中E-钙黏蛋白和波形蛋白是肿瘤EMT过程中最可靠的标志蛋白[18-19]。EMT受多种因素的调控,经典刺激因素包括转化生长因子β家族(transforming growth factor β,TGF-β)[20-21]和低氧微环境[22]等,该过程涉及一系列信号通路的交互作用。以经典的TGF-β-Smad信号通路为例,TGF-β作用细胞后,细胞膜表面受体转化生长因子β受体(transforming growth factor β receptor,TβR)Ⅰ与TβRⅡ形成异源性二聚体,随后募集细胞内效应蛋白,引起Smad2和Smad3磷酸化,后两者再与Smad4形成异源性三聚体,转位进入细胞核,导致上皮标记物E-钙黏蛋白的转录抑制因子Snail、Slug等表达增加,降低E-钙黏蛋白的表达水平,同时上调间质蛋白的表达[23]。肿瘤侵袭及转移是一个复杂且多步骤的过程:肿瘤细胞从原发灶脱离,首先黏附到细胞外基质表面,随后释放降解酶以降解细胞外基质,侵袭细胞外基质并向周围组织浸润生长;肿瘤细胞穿透细胞外基质后与局部毛细血管、毛细淋巴管接触,进而穿透血管壁,进入循环系统迁移至新的部位,最终形成转移灶[24]。
有研究表明,雷公藤红素能上调肿瘤细胞中的E-钙黏蛋白的表达,且雷公藤红素的抗肿瘤活性与肿瘤细胞内E-钙黏蛋白的表达密切相关[25]。这一调控作用主要依赖于雷公藤红素激活p38的作用。在TGF-β诱导的EMT模型中,雷公藤红素能抑制Smad信号通路,下调Slug/Snail的转录及蛋白表达水平,进而上调细胞内的E-钙黏蛋白并干扰间质标志物的表达,抑制EMT的发生。雷公藤红素还能通过靶向β1整合素通路抑制Fibronectin(FN)介导的细胞―细胞外基质黏附,进而抑制肿瘤细胞的运动迁移和侵袭能力,而p38的激活参与其中。本研究发现雷公藤红素处理可以导致HNE1、CNE2细胞中E-钙黏蛋白、β-连环蛋白的表达升高,而N-钙黏蛋白、波形蛋白的表达下降,表明雷公藤红素可抑制鼻咽癌细胞EMT的发生,并抑制鼻咽癌细胞的增殖、迁移能力。
综上所述,雷公藤红素可能通过调节人鼻咽癌HNE1、CNE2细胞的EMT,从而抑制细胞增殖并诱导细胞凋亡。本研究初步证实了雷公藤红素对人鼻咽癌HNE1、CNE2细胞具有一定杀伤作用及可能的分子机制,为进一步开展动物实验以及临床试验提供了数据支持。
| [1] | TANG L L, CHEN W Q, XUE W Q, HE Y Q, ZHENG R S, ZENG Y X, et al. Global trends in incidence and mortality of nasopharyngeal carcinoma[J]. Cancer Lett, 2016, 374: 22–30. DOI: 10.1016/j.canlet.2016.01.040 |
| [2] | ZHANG L N, GAO Y H, LAN X W, TANG J, OUYANG P Y, XIE F Y. Effect of taxanes-based induction chemotherapy in locoregionally advanced nasopharyngeal carcinoma:a large scale propensity-matched study[J]. Oral Oncol, 2015, 51: 950–956. DOI: 10.1016/j.oraloncology.2015.07.004 |
| [3] | CHEN Y P, GUO R, LIU N, LIU X, MAO Y P, TANG L L, et al. Efficacy of the additional neoadjuvant chemotherapy to concurrent chemoradiotherapy for patients with locoregionally advanced nasopharyngeal carcinoma:a bayesian network meta-analysis of randomized controlled trials[J]. J Cancer, 2015, 6: 883–892. DOI: 10.7150/jca.11814 |
| [4] | 李文全, 曹忠胜, 钱伟. 姜黄素对人鼻咽癌CNE2细胞增殖及凋亡的影响[J]. 重庆医学, 2017, 46: 4917–4919, 4922. DOI: 10.3969/j.issn.1671-8348.2017.35.006 |
| [5] | 李云川, 徐艳微, 黄丹, 姜琳琳, 李克森, 季文樾. 白藜芦醇抑制喉癌Hep-2细胞系的生长[J]. 临床耳鼻咽喉头颈外科杂志, 2007, 21: 1129–1131. |
| [6] | ZHANG Y, GENG C, LIU X, LI M, GAO M, LIU X, et al. Celastrol ameliorates liver metabolic damage caused by a high-fat diet through Sirt1[J]. Mol Metab, 2017, 6: 138–147. DOI: 10.1016/j.molmet.2016.11.002 |
| [7] | WANG Z, ZHAI Z, DU X. Celastrol inhibits migration and invasion through blocking the NF-κB pathway in ovarian cancer cells[J]. Exp Ther Med, 2017, 14: 819–824. DOI: 10.3892/etm.2017.4568 |
| [8] | XU C, WANG X, GU C, ZHANG H, ZHANG R, DONG X, et al. Celastrol ameliorates Cd-induced neuronal apoptosis by targeting NOX2-derived ROS-dependent PP5-JNK signaling pathway[J]. J Neurochem, 2017, 141: 48–62. DOI: 10.1111/jnc.2017.141.issue-1 |
| [9] | 王莹, 陈浩杰, 曹帆帆, 彭彬, 张雪, 张登海. 雷公藤红素对非小细胞肺癌细胞株H1975的增殖抑制及其相关机制研究[J]. 中国现代医生, 2016, 54: 33–36. |
| [10] | 张彦, 祝晨蔯. 雷公藤红素对体外人肝癌HepG2细胞增殖、凋亡的影响及机制研究[J]. 中国药房, 2017, 28: 1342–1345. DOI: 10.6039/j.issn.1001-0408.2017.10.12 |
| [11] | 池小斌, 吕立志, 张小进, 陈永标, 江艺. 雷公藤红素抑制人胆囊癌NOZ细胞增殖及诱导凋亡的研究[J]. 中华肝胆外科杂志, 2016, 22: 340–343. DOI: 10.3760/cma.j.issn.1007-8118.2016.05.015 |
| [12] | NABEKURA T, HIROI T, KAWASAKI T, UWAI Y. Effects of natural nuclear factor-κB inhibitors on anticancer drug efflux transporter human P-glycoprotein[J]. Biomed Pharmacother, 2015, 70: 140–145. DOI: 10.1016/j.biopha.2015.01.007 |
| [13] | JI N, LI J, WEI Z, KONG F, JIN H, CHEN X, et al. Effect of celastrol on growth inhibition of prostate cancer cells through the regulation of hERG channel in vitro[J/OL]. Biomed Res Int, 2015, 2015: 308475. doi: 10.1155/2015/308475. |
| [14] | YOON M J, LEE A R, JEONG S A, KIM Y S, KIM J Y, KWON Y J, et al. Release of Ca2+ from the endoplasmic reticulum and its subsequent influx into mitochondria trigger celastrol-induced paraptosis in cancer cells[J]. Oncotarget, 2014, 5: 6816–6831. |
| [15] | 湛达河, 胡建兵, 达世俭, 翁洁. 雷公藤红素对鼻咽癌CNE-1细胞增殖抑制和放射增敏作用的初步研究[J]. 癌症进展, 2010, 8: 491–499. DOI: 10.3969/j.issn.1672-1535.2010.05.017 |
| [16] | YAO S Q, HE Q C, YUAN J X, CHEN J, CHEN G, LU Y, et al. Role of Fas/FasL pathway-mediated alveolar macrophages releasing inflammatory cytokines in human silicosis[J]. Biomed Environ Sci, 2013, 26: 930–933. |
| [17] | HU Q P, KUANG J Y, YANG Q K, BIAN X W, YU S C. Beyond a tumor suppressor:soluble E-cadherin promotes the progression of cancer[J]. Int J Cancer, 2016, 138: 2804–2812. DOI: 10.1002/ijc.v138.12 |
| [18] | KIM K H, KIM L, CHOI S J, HAN J Y, KIM J M, CHU Y C, et al. The clinicopathological significance of epithelial mesenchymal transition associated protein expression in head and neck squamous cell carcinoma[J]. Korean J Pathol, 2014, 48: 263–269. DOI: 10.4132/KoreanJPathol.2014.48.4.263 |
| [19] | HU Z, QIAN G, MÜLLER S, XU J, SABA N F, KIM S, et al. Biomarker quantification by multiplexed quantum dot technology for predicting lymph node metastasis and prognosis in head and neck cancer[J]. Oncotarget, 2016, 7: 44676–44685. |
| [20] | HUANG S, HÖLZEL M, KNIJNENBURG T, SCHLICKER A, ROEPMAN P, MCDERMOTT U, et al. MED12 controls the response to multiple cancer drugs through regulation of TGF-β receptor signaling[J]. Cell, 2012, 151: 937–950. DOI: 10.1016/j.cell.2012.10.035 |
| [21] | WENDT M K, ALLINGTON T M, SCHIEMANN W P. Mechanisms of the epithelial-mesenchymal transition by TGF-β[J]. Future Oncol, 2009, 5: 1145–1168. DOI: 10.2217/fon.09.90 |
| [22] | SCHIETKE R, WARNECKE C, WACKER I, SCHÖDEL J, MOLE D R, CAMPEAN V, et al. The lysyl oxidases LOX and LOXL2 are necessary and sufficient to repress E-cadherin in hypoxia:insights into cellular transformation processes mediated by HIF-1[J]. J Biol Chem, 2010, 285: 6658–6669. DOI: 10.1074/jbc.M109.042424 |
| [23] | XU J, LAMOUILLE S, DERYNCK R. TGF-β-induced epithelial to mesenchymal transition[J]. Cell Res, 2009, 19: 156–172. DOI: 10.1038/cr.2009.5 |
| [24] | LIOTTA L A, STEEG P S, STETLER-STEVENSON W G. Cancer metastasis and angiogenesis:an imbalance of positive and negative regulation[J]. Cell, 1991, 64: 327–336. DOI: 10.1016/0092-8674(91)90642-C |
| [25] | ZHENG L, FU Y, ZHUANG L, GAI R, MA J, LOU J, et al. Simultaneous NF-κB inhibition and E-cadherin upregulation mediate mutually synergistic anticancer activity of celastrol and SAHA in vitro and in vivo[J]. Int J Cancer, 2014, 135: 1721–1732. DOI: 10.1002/ijc.28810 |
 2018, Vol. 39
2018, Vol. 39


