2. 上海海事大学医院检验科, 上海 201306;
3. 上海市普陀区人民医院药剂科, 上海 200060
2. Department of Clinical Laboratory, Hospital of Shanghai Maritime University, Shanghai 201306, China;
3. Department of Pharmacy, Putuo People's Hospital, Shanghai 200060, China
脑卒中是威胁人类健康的巨大杀手,据调查,全球每年有1 690万人患脑卒中,590万人的死亡与脑卒中有关[1]。脑卒中是一种以脑部缺血和出血性损伤症状为主要临床表现的疾病,研究表明缺血性脑卒中造成脑损伤时有神经细胞发生凋亡[2],且凋亡过程伴随复杂的信号通路[3-5]。银杏内酯A、B混合物(ginkgolide A and ginkgolide B,GKAB)是血小板活化因子的选择性受体阻断剂,可从中草药银杏中提取获得。有研究发现GKAB具有神经保护作用[6-7],但其具体机制尚未完全阐明,如调控凋亡的重要途径线粒体途径[8]和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路[9]是否参与其中?本研究通过检测JNK信号通路和线粒体途径的相关蛋白,观察JNK信号通路是否被激活,旨在探索GKAB对神经细胞具有保护作用的分子机制。
1 材料和方法 1.1 实验试剂与仪器GKAB(银杏内酯A和银杏内酯B以1:1的质量比混合)由中国科学院上海药物研究所提供,4%水合氯醛、4%多聚甲醛[生工生物(上海)工程有限公司]。兔抗鼠p-JNK一抗、鼠抗鼠细胞色素C(cytochrome C,Cyt C)一抗、兔抗鼠caspase-9一抗、兔抗鼠caspase-3一抗(美国Cell Signaling Technology公司),鼠抗鼠β-actin一抗(德国Sigma-Aldrich公司),鼠抗鼠Bcl-2一抗、羊抗兔免疫球蛋白二抗(美国Santa Cruz Biotechnology公司),兔抗鼠免疫球蛋白二抗(丹麦Dako公司)。线粒体分离试剂盒(美国Pierce公司),原位末端标记(TUNEL)试剂盒(美国Promega公司),Bradford蛋白浓度测定试剂盒(碧云天生物技术研究所),ECL显影液(英国Amersham Bioscience公司)。免疫组织化学检测试剂盒[GTVision,基因科技(上海)有限公司]。FA1604S型电子天平(上海精密科学仪器有限公司),SDS-PAGE电泳仪、湿电转膜仪(美国Bio-Rad公司),5415R型离心机(德国Eppendorf公司),CX31型激光共聚焦显微镜(日本Olympus公司),H.SWX-600BS型恒温水浴箱(上海新苗医疗器械制造有限公司),ZD9550型摇床(苏州江东精密仪器有限公司)。
1.2 实验动物与分组清洁级雄性SD大鼠,体质量(290±20)g,由同济医院动物实验中心提供[动物许可证号:SYXK(沪)2012-0031]。将大鼠随机分成5组:假手术组,永久性大脑中动脉栓塞(permanent middle cerebral artery occlusion,pMCAO)模型组,GKAB处理后低剂量组(GT1组,GKAB 12.5 mg/kg)、中剂量组(GT2组,GKAB 25 mg/kg)、高剂量组(GT3组,GKAB 50 mg/kg),每组12只。各组于造模手术10 min后经舌下静脉给药。
1.3 大鼠pMCAO模型的建立4%水合氯醛腹腔注射麻醉大鼠(400 mg/kg),将麻醉后的大鼠仰卧固定于鼠板,颈部正中切口,分离右侧颈内、外动脉并结扎颈外动脉。分离颈总动脉并结扎近心端,在远心端靠近颈内、外动脉分叉处用动脉夹阻断血流。在此之间,45 ℃下剪一小口,将4-0尼龙线(一端预先加热成圆珠状)插入小口,去掉动脉夹,顺着颈内动脉将线栓推入至大脑前动脉起始端(距颈总动脉分叉处约20 mm),阻断大脑中动脉血供,固定线栓,缝合皮肤。假手术组只分离动脉但不插线。
1.4 TUNEL法检测大鼠脑组织半暗带神经细胞凋亡情况造模12 h后,每组取3只大鼠,先以0.9%的生理盐水心脏灌注冲洗,再行4%多聚甲醛溶液灌注固定,取出全脑,切取手术同侧半球梗死灶周围皮质半暗带,石蜡包埋,制成10 μm厚的切片。每只大鼠取3张切片,使用TUNEL法检测神经细胞的凋亡情况。石蜡玻片常规脱蜡、洗涤后用蛋白酶K消化预处理15 min,PBS洗涤、4%多聚甲醛溶液固定,再滴加Buffer缓冲液室温孵育7 min,然后滴加rTDT混合液水浴60 min。将玻片浸入盛有2×SSC溶液的染缸中15 min终止反应,再浸入0.3%过氧化氢溶液中,滴加辣根过氧化物酶标记的链霉亲和素溶液室温放置30 min,PBS洗涤后滴加DAB工作液显色,封片。每张切片光镜下取5个视野(×400)观察,计数凋亡细胞数目并计算凋亡率:细胞凋亡率(%)=凋亡细胞总数/(凋亡细胞总数+正常细胞总数)×100%。
1.5 免疫组织化学检测大鼠神经细胞中磷酸化JNK(p-JNK)水平取石蜡切片脱蜡、脱水后用枸橼酸钠修复抗原,滴加过氧化氢溶液封闭非特异性抗原,PBS洗涤后滴加p-JNK一抗孵育过夜,次日洗涤后滴加相应二抗,再次洗涤后用DAB初染,盐酸乙醇分化后用苏木精复染,各级乙醇脱水后中性树胶封片。显微镜高倍镜下选取5个视野,每个视野计数100个细胞,出现棕黄色颗粒者为阳性细胞,计算阳性细胞百分比。
1.6 蛋白质印迹法检测大鼠脑组织p-JNK、Bcl-2、Cyt C、cleaved caspase-9、cleaved caspase-3蛋白的表达各组大鼠分别于造模、用药12 h后断头取脑,迅速切取缺血半暗带区域置于-80 ℃冷冻备用。使用时取100 g组织加入1 mL RIPA裂解液于冰上匀浆裂解,待充分裂解后,4 ℃ 12 000×g离心10 min,取上清液。使用线粒体分离试剂盒分离线粒体。使用Bradford蛋白浓度测定试剂盒测定蛋白浓度,将蛋白样品与上样缓冲液按照5:1的比例混合,加热煮沸5 min;配制10%~15%的SDS-PAGE分离胶和5%的浓缩胶,上样量400 mg(20 μL),跑胶、转膜;丽春红染色,检查条带后再用三羟甲基氨基甲烷(TBS)缓冲液褪色。用含5%脱脂奶粉的TBS封闭,置于摇床上30 r/min振荡1 h,再分别加入兔抗鼠p-JNK一抗(1:1 000)、鼠抗鼠Bcl-2一抗(1:5 000)、鼠抗鼠Cyt C一抗(1:2 000)、兔抗鼠caspase-9一抗(1:1 000)、兔抗鼠caspase-3一抗(1:1 000)和鼠抗鼠β-actin一抗(1:10 000),4 ℃ 15 r/min振荡孵育过夜;TBST洗去一抗,加入羊抗兔免疫球蛋白二抗(1:2 000)、兔抗鼠免疫球蛋白二抗(1:1 000),15 r/min室温振荡孵育1 h,TBST洗去二抗后行ECL显影。
1.7 统计学处理采用SPSS 20.0软件进行数据分析。数据均以x±s表示,两组间比较采用两样本均数比较的t检验,多组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 各组大鼠脑组织半暗带神经细胞凋亡情况与假手术组相比,造模12 h后pMCAO模型组大鼠半暗带神经细胞凋亡率增加[(31.89±1.76)% vs(0.64±0.16)%,P < 0.01];GKAB处理后低、中、高剂量组大鼠半暗带神经细胞凋亡率分别为(23.92±1.29)%、(20.16±1.11)%、(13.09±0.68)%,与pMCAO模型组相比均下降(P均 < 0.01)。见图 1。
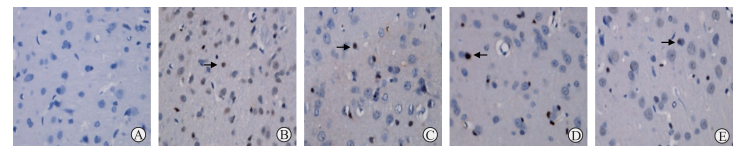
|
图 1 TUNEL法检测各组大鼠神经细胞凋亡情况 Fig 1 Neuronal cell apoptosis of rats by TUNEL A: Sham group; B: pMCAO model group; C: GT1 group (pMCAO+GKAB 12.5 mg/kg); D: GT2 group (pMCAO+GKAB 25 mg/kg); E: GT3 group (pMCAO+GKAB 50 mg/kg). The arrows indicate positive cells. TUNEL: Terminal-deoxynucleoitidyl transferase mediated nick end labeling; pMCAO: Permanent middle cerebral occlusion; GKAB: Ginkgolide A and ginkgolide B. Original magnification: ×400 |
2.2 各组大鼠脑组织中p-JNK水平
免疫组织化学结果(图 2A~2E)显示,与假手术组相比,pMCAO模型组大鼠神经细胞p-JNK的表达水平增加[(64.3±2.80)% vs(0.31±0.11)%,P < 0.01]。GKAB处理后低、中、高剂量组大鼠神经细胞p-JNK的表达水平分别为(43.7±2.31)%、(26.61±1.78)%、(14.52±1.59)%,与pMCAO模型组相比均降低(P均 < 0.01),且各组间差异有统计学意义(P < 0.01)。蛋白质印迹结果(图 2F)显示,各组大鼠脑组织中JNK蛋白水平相对恒定,而pMCAO模型组p-JNK蛋白水平较假手术组增高(P < 0.01),GKAB处理后各剂量组p-JNK蛋白水平均低于pMCAO模型组(P < 0.01),且随剂量的增加呈下降趋势,各组间差异有统计学意义(P < 0.01)。
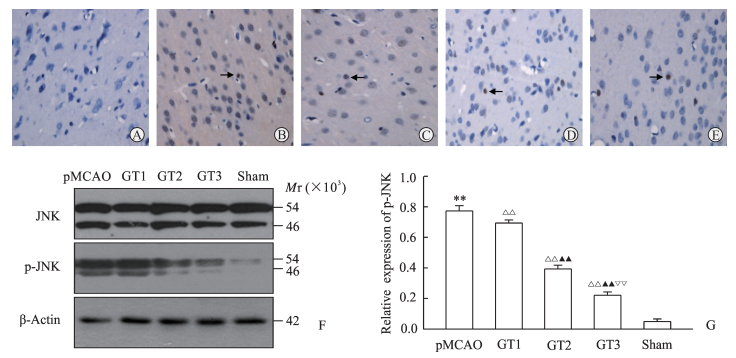
|
图 2 各组大鼠脑组织p-JNK的表达水平 Fig 2 Expression of p-JNK protein of rats in each group A-E: Expression of p-JNK protein by immunohistochemistry (the arrows indicate positive cells). A: Sham group; B: pMCAO model group; C: GT1 group (pMCAO+GKAB 12.5 mg/kg); D: GT2 group (pMCAO+GKAB 25 mg/kg); E: GT3 group (pMCAO+GKAB 50 mg/kg). F, G: Detection of p-JNK and JNK by Western blotting. pMCAO: Permanent middle cerebral occlusion; GKAB: Ginkgolide A and ginkgolide B; JNK: c-Jun N-terminal kinase; p-JNK: Phosphorylated c-Jun N-terminal kinase. Original magnification: ×400 (A-E). **P < 0.01 vs sham group; △△P < 0.01 vs pMCAO group; ▲▲P < 0.01 vs GT1 group; ▽▽P < 0.01 vs GT2 group. n=9, x±s |
2.3 各组大鼠神经细胞内线粒体信号通路蛋白及相关凋亡蛋白的表达
蛋白质印迹分析结果(图 3)表明,pMCAO模型组大鼠神经细胞内促凋亡蛋白Bax、cleaved caspase-9、cleaved caspase-3和p-JNK的表达水平较假手术组均升高(P < 0.01),而GKAB处理后低、中、高剂量组大鼠上述蛋白的表达水平与pMCAO模型组相比逐渐降低,且各组间差异有统计学意义(P < 0.01);Bcl-2则呈现相反的变化(P < 0.01)。Cyt C分析结果(图 4)显示,与假手术组相比,pMCAO模型组大鼠线粒体内Cyt C和胞质内Cyt C的表达发生了倒置(P < 0.01),而GKAB处理后随着剂量的加大这种倒置又逐渐被逆转(P < 0.05,P < 0.01)。
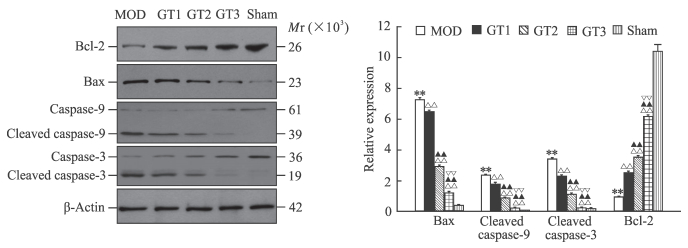
|
图 3 蛋白质印迹法检测各组大鼠脑组织Bax、cleaved caspase-9、cleaved caspase-3和Bcl-2的表达 Fig 3 Expressions of Bax, cleaved caspase-9, cleaved caspase-3, and Bcl-2 in brain tissue of rats in each group by Western blotting Sham: Sham group; MOD: pMCAO model group; GT1: pMCAO+GKAB 12.5 mg/kg group; GT2: pMCAO+GKAB 25 mg/kg group; GT3: pMCAO+GKAB 50 mg/kg group. pMCAO: Permanent middle cerebral occlusion; GKAB: Ginkgolide A and ginkgolide B. **P < 0.01 vs sham group; △△P < 0.01 vs MOD group; ▲▲P < 0.01 vs GT1 group; ▽▽P < 0.01 vs GT2 group. n=9, x±s |
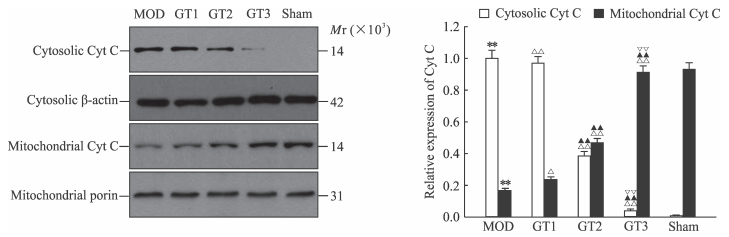
|
图 4 蛋白质印迹法检测大鼠神经细胞线粒体和胞质内Cyt C的表达 Fig 4 Expression of mitochondrial and cytosolic Cyt C in brain neurons of rats in each group by Western blotting Sham: Sham group; MOD: pMCAO model group; GT1: pMCAO+GKAB 12.5 mg/kg group; GT2: pMCAO+GKAB 25 mg/kg group; GT3: pMCAO+GKAB 50 mg/kg group. Cyt C: Cytochrome C; pMCAO: Permanent middle cerebral occlusion; GKAB: Ginkgolide A and ginkgolide B. **P < 0.01 vs sham group; △P < 0.05, △△P < 0.01 vs MOD group; ▲▲P < 0.01 vs GT1 group; ▽▽P < 0.01 vs GT2 group. n=9, x±s |
3 讨论
脑卒中多由脑动脉栓塞所致,伴随着脑卒中的发生和发展,梗死灶中心的组织细胞会发生水肿、坏死并逐步向周围蔓延。而在梗死灶边缘区域,尚存有大量处于休眠状态或半休眠状态的神经细胞,这些细胞具有双向发展的可能,该区域被称为半暗带[10],通常半暗带的存在可维持6~24 h。有研究发现,缺血性卒中的半暗带是神经细胞凋亡发生最多的区域[11],这些神经细胞具有可逆性,若抢救及时可向正常组织转化,这对于减小缺血性卒中的脑梗死面积和后续治疗具有积极意义。因此,尽早采取有效的干预措施,使处于过渡态的细胞恢复正常的神经功能已成为临床治疗缺血性卒中的神经保护策略之一[12]。
本课题组前期工作已证明GKAB对神经细胞具有保护作用,并且这种保护作用与GKAB对NF-κB的表达抑制有关[7]。缺血性卒中引起的神经细胞凋亡是一系列酶促反应的结果,受多条细胞信号通路控制[13],已知细胞凋亡途径主要有3条:死亡受体途径、线粒体途径和内质网途径。死亡受体途径是细胞表面的死亡受体通过结合特定的配体而引起细胞凋亡。线粒体途径是线粒体在促凋亡蛋白(如Bax、Bak等)的作用下,通过开放线粒体膜上的通透性孔道(permeability transition pore,PTP)释放Cyt C而引起细胞凋亡。Cyt C的释放被认为是细胞线粒体凋亡途径启动的标志之一[14],Cyt C被释放到胞质后与caspase-9结合后作用于caspase-3,激活caspase-3并与底物结合引起细胞凋亡。内质网途径是内质网应激所导致的caspase-12的活化,从而导致细胞凋亡。对于缺血性卒中引起神经细胞的凋亡机制已有研究,但仍没有明确的阐述,有学者在研究缺血处理的沙鼠海马神经元时发现,死亡受体途径和线粒体途径都参与了神经细胞的凋亡;同时利用JNK抑制剂AS601245抑制JNK后,Cyt C的释放也受到抑制[15]。这些研究表明线粒体介导的细胞凋亡途径在缺血性神经细胞的凋亡中具有重要作用,同时JNK对Cyt C的释放具有积极意义。本研究在pMCAO模型大鼠实验中发现,大鼠脑组织中Bcl-2、Bax及神经细胞胞质Cyt C均发生了明显改变,pMCAO模型大鼠中促凋亡蛋白Bax水平升高而抗凋亡蛋白Bcl-2水平降低,通常认为Bcl-2/Bax比值降低是细胞启动线粒体凋亡途径的关键因素[16]。同时本研究发现,在胞质Cyt C升高的同时JNK也被激活,且这种激活可被GKAB抑制。以上研究结果表明,在pMCAO大鼠模型中,线粒体途径的凋亡可能是神经细胞凋亡的一条重要路径,而GKAB对脑的保护作用也可能与其能够抑制线粒体Cyt C的释放和JNK的激活有密切关系。
JNK是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族的一员。MAPK家族是一类高度保守的丝/苏氨酸蛋白激酶,存在于大多数细胞内,由MAPK激酶(MAPKK)激酶(MAPKKK)、MAPKK和MAPK 3级激酶链组成,它是信号从细胞表面进入核内的重要传递者,目前已发现MAPK家族成员主要有细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、JNK及p38。MAPK家族在细胞的增殖分化、应激刺激、肿瘤以及细胞凋亡等多种生理和病理过程中发挥着重要作用。自1993年Hibi等[17]发现JNK至今,其生理病理及调控机制的研究已成为热点。目前已知的JNK家族的10种异构体分别由JNK1、JNK2和JNK3基因编码。JNK1和JNK2在多种组织中广泛表达,JNK3则主要在神经组织中表达。在外界因素如紫外线、高渗、再灌注损伤和某些细胞因子的刺激下,JNK可以被激活。越来越多的研究发现,当神经细胞受到损伤时,JNK处于激活状态[18-19];同时,大脑损伤后能通过下调JNK3的表达保护神经细胞[20]。JNK活化后的信号转导较为多样,已有研究表明,活化后的JNK既可以移位到细胞核通过调节核转录因子和非转录因子参与调节细胞凋亡[21];还可以经由线粒体途径即活化的JNK移至线粒体附近,通过抑制线粒体膜上Bcl-2的表达提高Bax、Bak等的表达,改变Bcl-2/Bax的结合状态,进而打开线粒体膜通透性孔道,释放Cyt C进入胞质[22],通过线粒体途径引起细胞凋亡。JNK在线粒体功能失调和线粒体介导的细胞凋亡过程中起着关键作用[23]。本研究发现,对于pMCAO大鼠,神经细胞的凋亡与JNK的激活、JNK-线粒体凋亡途径的启动关系密切,而GKAB对神经细胞的保护作用很可能与其抑制JNK的激活,减少线粒体Cyt C的释放,从而抑制神经细胞凋亡有关。JNK介导的信号通路在神经细胞的凋亡中起着重要作用,JNK可能是GKAB保护神经细胞的一个潜在作用靶点。
综上所述,神经细胞的凋亡涉及MAPK家族、Bcl-2家族蛋白、Cyt C、caspase家族等一系列蛋白和细胞因子,受多条信号通路的调控,不同的级联通路之间存在复杂的交叉和整合。了解这些信号转导机制有助于更好地了解细胞凋亡的基本生理过程,探索凋亡机制有助于寻找针对性的治疗靶点和治疗措施,为临床治疗提供更好的借鉴和参考。同时,由于MAPK家族与上游激活物之间相互作用的具体机制非常复杂,对于pMCAO大鼠神经细胞凋亡时JNK的激活机制以及是否有其他信号通路参与目前并不清楚,这将是下一步的研究方向。
| [1] | BÉJOT Y, DAUBAIL B, GIROUD M. Epidemiology of stroke and transient ischemic attacks:current knowledge and perspectives[J]. Rev Neurol, 2016, 172: 59–68. DOI: 10.1016/j.neurol.2015.07.013 |
| [2] | CHARRIAUT-MARLANGUE C, REMOLLEAU S, AGGOUN-ZOUAOUI D, BEN-ARI Y. Apoptosis and programmed cell death:a role in cerebral ischemia[J]. Biomed Pharmacother, 1998, 52: 264–269. DOI: 10.1016/S0753-3322(98)80012-7 |
| [3] | HOU S T, MACMANUS J P. Molecular mechanisms of cerebral ischemia-induced neuronal death[J]. Int Rev Cytol, 2002, 221: 93–148. DOI: 10.1016/S0074-7696(02)21011-6 |
| [4] | SIMS N R, MUYDERMAN H. Mitochondria, oxidative metabolism and cell death in stroke[J]. Biochim Biophys Acta, 2010, 1802: 80–91. DOI: 10.1016/j.bbadis.2009.09.003 |
| [5] | DAVE K R, BHATTACHARYA S K, SAUL I, DEFAZIO R A, DEZFULIAN C, LIN H W, et al. Activation of protein kinase C delta following cerebral ischemia leads to release of cytochrome C from the mitochondria via bad pathway[J/OL]. PLoS One, 2011, 6: e22057. doi: 10.1371/journal.pone.0022057. |
| [6] | 王旋, 顾振纶, 秦振红, 张慧灵. 银杏内酯A和B混合物对大鼠永久性局灶性脑缺血的保护作用[J]. 中草药, 2007, 38: 241–244. DOI: 10.3321/j.issn:0253-2670.2007.02.032 |
| [7] | WANG X, QIN Z H, SHI H, SAVITZ S I, QIN A P, JIANG Y, et al. Protective effect of ginkgolide (A+B) is associated with inhibition of NIK/IKK/IkappaB/NFkappaB signaling pathway in a rat model of permanent focal cerebral ischemia[J]. Brain Res, 2008, 1234: 8–15. DOI: 10.1016/j.brainres.2008.07.102 |
| [8] | VITALE I, MANIC G, KROEMER G, GALLUZZI L. Mitochondria in cell death regulation. Reference module in biomedical sciences[J]. Encyclopedia Cell Biol, 2016, 3: 341–353. |
| [9] | NIJBOER C H, BONESTROO H J, ZIJLSTRA J, AVELAARS A, HEIJNEN C J. Mitochondrial JNK phosphorylation as a novel therapeutic target to inhibit neuroinflammation and apoptosis after neonatal ischemic brain damage[J]. Neurobiol Dis, 2013, 54: 432–444. DOI: 10.1016/j.nbd.2013.01.017 |
| [10] | BROUGHTON B R, REUTENS D C, SOBEY C G. Apoptotic mechanisms after cerebral ischemia[J/OL]. Stroke, 2009, 40: e331-e339. doi: 10.1161/STROKEAHA.108.531632. |
| [11] | BERETTA S, CUCCIONE E, VERSACE A, CARONE D, RIVA M, PADOVANO G. Cerebral collateral flow defines topography and evolution of molecular penumbra in experimental ischemic stroke[J]. Neurobiol Dis, 2015, 74: 305–313. DOI: 10.1016/j.nbd.2014.11.019 |
| [12] | WALCOTT B P, STAPLETON C J. Clinical status of neuroprotection in cerebral ischemia primer on cerebrovascular diseases[J]. Cerebrovasc Dis, 2017, 142: 745–748. |
| [13] | ZHANG H Y, OFENGEIM D, SHI Y J, ZHANG F, HWANG J Y, CHEN J, et al. Molecular and cellular mechanisms of ischemia-induced neuronal death[J]. Stroke, 2016, 6: 60–79. |
| [14] | GARRIDO C, GALLUZZI L, BRUNET M, PUIG P E, DIDELOT C, KROEMER G. Mechanisms of cytochrome C release from mitochondria[J]. Cell Death Differ, 2006, 13: 1423–1433. DOI: 10.1038/sj.cdd.4401950 |
| [15] | WANG Y, JI H X, XING S H, PEI D S, GUAN Q H. SP600125, a selective JNK inhibitor, protects ischemic renal injury via suppressing the extrinsic pathways of apoptosis[J]. Life Sci, 2007, 80: 2067–2075. DOI: 10.1016/j.lfs.2007.03.010 |
| [16] | FAN Y C, LIU K, WANG Q P, RUAN Y Y, ZHANG Y, YE W. Exendin-4 protects retinal cells from early diabetes in Goto-Kakizaki rats by increasing the Bcl- 2/Bax and Bcl-xL/Bax ratios and reducing reactive gliosis[J]. Mol Vis, 2014, 20: 1557–1568. |
| [17] | HIBI M, LIN A, SMEAL T, MINDEN A, KARIN M. Identification of an oncoprotein- and UV-responsive protein kinase that binds and potentiates the c-Jun activation domain[J]. Genes Dev, 1993, 7: 2135–2148. DOI: 10.1101/gad.7.11.2135 |
| [18] | BENAKIS C, BONNY C, HIRT L. JNK inhibition and inflammation after cerebral ischemia[J]. Brain Behav Immun, 2010, 24: 800–811. DOI: 10.1016/j.bbi.2009.11.001 |
| [19] | GUO D, WANG Y W, MA J, YAN L, LI T F, HAN X W, et al. Study on the role of Cathepsin B and JNK signaling pathway in the development of cerebral aneurysm[J]. Asian Pac J Trop Med, 2016, 9: 499–502. DOI: 10.1016/j.apjtm.2016.03.020 |
| [20] | QI S H, LIU Y, HAO L Y, GUAN Q H, GU Y H, ZHANG J, et al. Neuroprotection of ethanol against ischemia/reperfusion-induced brain injury through decreasing c-Jun N-terminal kinase 3(JNK3) activation by enhancing GABA release[J]. Neuroscience, 2010, 167: 1125–1137. DOI: 10.1016/j.neuroscience.2010.02.018 |
| [21] | AMEYAR M, WISNIEWSKA M, WEITZMAN J B. A role for AP-1 in apoptosis:the case for and against[J]. Biochimie, 2003, 85: 747–752. DOI: 10.1016/j.biochi.2003.09.006 |
| [22] | AKHTAR R S, NESS J M, ROTH K A. Bcl-2 family regulation of neuronal development and neurodegeneration[J]. Biochim Biophys Acta, 2004, 1644(2/3): 189–203. |
| [23] | ZHOU Y, ZHAO W, XIE G, HUANG M, HU M, JIANG X, et al. Induction of Nur77-dependent apoptotic pathway by a coumarin derivative through activation of JNK and p38 MAPK[J]. Carcinogenesis, 2014, 35: 2660–2669. DOI: 10.1093/carcin/bgu186 |
 2018, Vol. 39
2018, Vol. 39


