甲状腺相关眼病(thyroid associated ophthalmopathy,TAO)是一种自身免疫性疾病,发病机制尚未完全明了,目前发现氧化应激参与了TAO的发病过程,试验性的抗氧化剂对治疗轻、中度TAO取得了比较理想的效果。Ohsawa等[1]在2007年研究发现氢分子具有选择性抗氧化作用,其可以通过选择性地中和羟自由基(•OH)和过氧亚硝基阴离子(peroxynitrite anion,ONOO-)治疗氧化损伤相关疾病,有效保护细胞功能。富氢水作为抗氧化剂的一种,因几乎无毒副作用,近年来广受关注,研究发现其可以通过抗氧化、抗凋亡、抗炎作用有效治疗氧化应激导致的器官损伤[2]。本研究用富氢水处理体外培养的TAO患者眼眶成纤维细胞,探讨其对TAO的抗氧化应激作用。
1 材料和方法 1.1 标本与来源选择2016年3月至2016年6月于我院行眼眶减压术的TAO患者,共4例4只眼,男性3例、女性1例,年龄为36~68岁,均符合TAO的Bartly和Gorman诊断标准[3]且排除其他自身免疫性疾病,术中取眼眶脂肪结缔组织标本。以上操作均经海军军医大学(第二军医大学)长征医院医学伦理委员会审批,取得患者及家属知情同意并签署知情同意书。
1.2 试剂与仪器过氧化氢(H2O2)购自国药集团化学试剂有限公司,小鼠抗人波形蛋白(vimentin)单克隆抗体、细胞角蛋白19(cytokeratin 19,CK19)单克隆抗体、结蛋白(desmin)单克隆抗体、S-100单克隆抗体购自英国Abcam公司,丙二醛(malondialdehyde,MDA)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒购自南京建成生物工程研究所,活性氧(reactive oxygen species,ROS)检测试剂盒购自上海碧云天生物技术有限公司,人透明质酸检测试剂盒购自上海信裕生物科技有限公司。
酶标分析仪(北京普朗新技术有限公司),流式细胞仪(美国BD公司),CO2恒温培养箱(美国Thermo Forma公司),细胞培养耗材(美国Trueline公司),显微镜(上海蔡康光学仪器有限公司),离心机(上海卢湘仪离心机仪器有限公司),镁棒(Premium FDR,日本FriendEar公司)。
1.3 实验方法 1.3.1 眼眶成纤维细胞的培养保持无菌状态从手术台上将标本转移至含青霉素/链霉素双抗的PBS(双抗:PBS=1:50,体积比;青霉素和链霉素原始浓度分别为1×104 U/mL和10 g/L)的离心管中,将离心管置入0 ℃冰水混合物中快速转运(1 h内)至细胞培养室。采用组织块培养法培养细胞并传代,第4~9代细胞用于实验。采用形态学以及用免疫组织化学法检测细胞波形蛋白、CK19、S-100、结蛋白的表达鉴定细胞。
1.3.2 CCK-8实验取对数生长期的眼眶成纤维细胞用胰蛋白酶消化,于显微镜下计数并制成5×104/mL的细胞悬液。以每孔100 µL接种至96孔板,每组设3复孔,以100 µL培养液作为空白对照,37 ℃培养过夜,分别在加入不同浓度的H2O2(0、100、200、300、400、500、550、600 μmol/L)后0、18 h,按体积比1:10混合CCK-8试剂和无血清培养液,以每孔100 µL加入待测孔中,在37 ℃、5% CO2培养箱中孵育1 h后,用酶标分析仪检测450 nm波长处的光密度(D)值。根据该实验结果选择合适浓度的H2O2开展后续实验。
1.3.3 富氢水的制备使用镁棒制备富氢水。镁棒的长度为14.5 cm、直径为1.8 cm。将镁棒放入密封的聚乙烯对苯二甲酸乙二醇酯瓶(碳酸饮料瓶级)内,镁棒被600 mL的超轻水(deuterium depleted water,DDW)完全浸透至少2 h,2 h后产生副产物——氢氧化镁沉淀,后者会在镁棒表面呈膜样或颗粒样附着而不污染富氢水。
1.3.4 实验分组将TAO患者眼眶成纤维细胞分为4组。空白组:正常培养。氧化损伤模型组(H2O2组):正常培养细胞6 h后加入H2O2处理18 h,之后去除H2O2正常培养,每12 h换液1次。富氢水+氧化损伤模型组(HW+H2O2组):用加入富氢水的培养液预处理细胞6 h后,加入H2O2处理细胞18 h后去除H2O2,每12 h更换富氢水培养液1次。其中富氢水培养液的制备方法为:用100 mL富氢水溶解1.04 g固体培养基、0.2 g碳酸氢钠。地塞米松+氧化损伤模型组(DEX+H2O2组):用加入1 μmol/L地塞米松[4]的培养液预处理细胞6 h后,加入H2O2处理18 h后去除H2O2,每12 h更换含地塞米松培养液1次。
1.3.5 流式细胞术检测细胞ROS荧光强度TAO患者眼眶成纤维细胞用含10%胎牛血清、1%青链霉素双抗混合液的DMEM-F12培养液于37 ℃、5% CO2的培养箱中培养。显微镜下观察细胞为贴壁细胞,锥虫蓝染色活细胞率达95%以上。取对数生长期的细胞用胰蛋白酶消化后以5×105/孔的密度接种于6孔板。细胞贴壁生长24 h后吸弃原培养液,各组细胞均在处理72 h后用胰蛋白酶消化,收集细胞用流式细胞仪检测,设激发波长为480 nm、发射波长为525 nm,ROS阳性的细胞有较强的绿色荧光。
1.3.6 ELISA检测细胞培养液中MDA、SOD、GSH-Px的含量取对数生长期的细胞用胰蛋白酶消化,于显微镜下计数并制成5×104/mL的细胞悬液。以每孔100 µL接种至96孔板,每组设3个复孔,以100 µL培养液作为空白对照,37 ℃培养过夜。根据分组处理细胞72 h后,分别采用MDA检测试剂盒、SOD检测试剂盒和GSH-Px检测试剂盒检测各组细胞培养液中MDA、SOD和GSH-Px的含量。
1.4 统计学处理使用SPSS 22.0软件进行统计学分析。服从正态分布的计量资料均以x±s表示,多组间比较采用单因素方差分析,两组比较采用t检验。检验水准(α)为0.05。
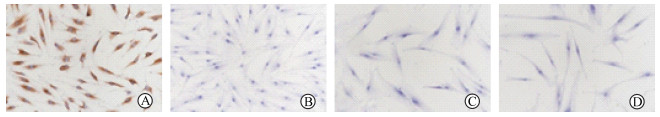
2 结果 2.1 眼眶成纤维细胞的体外培养及鉴定本实验选择的4例TAO患者4只眼的眼眶脂肪结缔组织,1例眼眶脂肪组织未见细胞爬出,可能与术中所取的组织量过少有关。原代培养3 d后,显微镜下见培养皿内有细长梭形的细胞爬出(图 1A)。继续培养可见突起从细胞周围长出,细胞贴壁牢固。约10 d后见细胞密集,开始相互融合,细胞形态良好依然为细长梭形,各细胞间可见颗粒状黑色或透明的分泌物(图 1B),符合成纤维细胞典型的形态学特征及贴壁的生长方式。选取对数生长期的第3代细胞,对其进行波形蛋白、CK19、结蛋白、S-100免疫组织化学染色,发现只有波形蛋白染色呈阳性,细胞质被染成棕色、细胞核未染色(图 2A),其余均为阴性(图 2B~2D)。传代后继续培养,细胞形态无明显改变,平均每周传代1次。

|
图 1 TAO患者眼眶成纤维细胞的体外培养 A:细胞培养的第3天, 少量细胞爬出, 呈细长梭形贴壁生长; B:细胞培养的第10天, 细胞逐渐增多, 密集平铺于培养皿底部且逐渐融合. TAO:甲状腺相关眼病. Original magnification: ×100 |
|
图 2 体外培养TAO患者眼眶成纤维细胞的免疫组织化学染色鉴定 A:波形蛋白染色呈阳性, 细胞质被染成棕色, 细胞核未染色; B:细胞角蛋白19阴性; C:结蛋白阴性; D: S-100阴性. TAO:甲状腺相关眼病. Original magnification: ×100 |
2.2 不同浓度H2O2对眼眶成纤维细胞增殖能力的影响
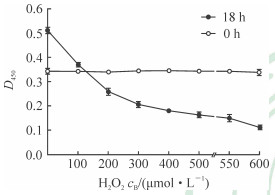
见图 3,100、200、300、400、500、550、600 μmol/L的H2O2刺激TAO患者眼眶成纤维细胞18 h后,450 nm波长处测定的D值随H2O2浓度增加逐渐下降,表明H2O2对眼眶成纤维细胞增殖的抑制率随浓度升高逐渐增大,且在H2O2浓度为100~400 μmol/L时抑制率呈快速增长,浓度为400~600 μmol/L时抑制率增长缓慢。100 μmol/L的H2O2对TAO患者眼眶成纤维细胞的抑制率为27.79%,该浓度已对细胞造成损伤;200 μmol/L的H2O2对细胞的抑制率已达49.41%,对细胞损伤明显,不利于后续眼眶成纤维细胞的培养,故选择100 μmol/L的H2O2进行后续实验。
|
图 3 H2O2对TAO患者眼眶成纤维细胞增殖的抑制效果 TAO:甲状腺相关眼病; H2O2:过氧化氢. n=3, x±s |
2.3 富氢水及地塞米松对氧化损伤TAO患者眼眶成纤维细胞氧化应激的影响
检测各组眼眶成纤维细胞培养72 h后细胞培养液中MDA、SOD、GSH-Px的含量以及细胞的ROS荧光强度,与空白组比较,H2O2组细胞培养液中MDA含量和细胞ROS荧光强度均增加,细胞培养液中SOD和GSH-Px含量均降低(P均<0.01)。与H2O2组相比,富氢水和地塞米松均可降低氧化损伤后眼眶成纤维细胞培养液中MDA含量和细胞中ROS的荧光强度,增加SOD和GSH-Px的含量(P均<0.01),其中地塞米松的作用效果较富氢水更加明显,且两组间各氧化应激指标的比较差异均有统计学意义(P均<0.01)。见表 1。
|
|
表 1 富氢水及地塞米松对TAO患者氧化损伤眼眶成纤维细胞氧化应激的影响 |
3 讨论
自20世纪80年代Wilson等[5]首次发现TAO患者体内自由基堆积、抗氧化酶活性降低,氧化应激与TAO的关系开始得到研究者的关注,越来越多的证据表明氧化应激产物ROS参与了TAO的病理过程[6-7]。研究发现TAO患者眼眶成纤维细胞对氧化应激的反应比正常人更敏感,其可能是因为TAO患者眼眶中抗氧化酶谱以及GSH减少甚至耗竭所致[8]。可见氧化应激与TAO的发病关系密切。目前抗氧化剂富氢水在眼部疾病中的研究较多,涵盖了角膜、葡萄膜、晶状体、视网膜、视神经等多种相关眼部疾病,如Yang等[9]于2013年发现富氢水可通过抗氧化应激预防亚硝酸盐致幼鼠白内障;Yokota等[10]研究发现氧化和硝化过程在青光眼视神经退行性疾病的发病机制中有重要作用,同时发现氢可抑制大鼠视网膜细胞线粒体膜电位的缺失和视网膜细胞的凋亡,降低视网膜细胞中酪氨酸硝化水平,抑制氧化应激损伤,对减缓青光眼视神经退行性改变有重要作用。
眼眶成纤维细胞是TAO发病的主要靶细胞和效应细胞,是近年来TAO相关研究的经典细胞模型。本实验通过体外培养TAO患者的眼眶脂肪结缔组织成纤维细胞,并给予H2O2刺激模拟细胞外源性氧化应激反应。给予富氢水处理氧化损伤细胞,发现富氢水可降低氧化损伤细胞培养液中MDA的含量和细胞ROS的荧光强度、提高细胞培养液中SOD和GSH-PX的含量。虽然其作用不如地塞米松明显,但考虑糖皮质激素有较多的不良反应及其使用限制性,富氢水不失为TAO治疗的一种有效手段。
目前富氢水的临床应用存在两大难点,一是通过何种途径使富氢水到达靶器官后能够发挥期望的治疗作用,二是因氢气难溶于水,富氢水中的氢气易挥发使其浓度降低,因此对富氢水中含氢量的控制较难。有研究表明,富氢水的保存与储存容器无关,与容器中的氢水是否全满、是否震荡或搅拌及氢水储存时间有关[11]。本实验采用的富氢水是将镁棒置于600 mL的DDW中并完全浸透8 h制取,在实验操作时贯彻富氢水制取完成即刻使用的原则,并在培养细胞时每12 h换培养液时更换富氢水,以尽可能保证富氢水中较高的氢浓度。但这一方法无法在临床大规模使用,因此后续实验将继续探索富氢水的临床应用及其治疗效果。
| [1] | OHSAWA I, ISHIKAWA M, TAKAHASHI K, WATANABE M, NISHIMAKI K, YAMAGATA K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13: 688–694. DOI: 10.1038/nm1577 |
| [2] | 李波, 吕国义, 于泳浩, 谢克亮, 王国林. 富氢生理盐水治疗相关疾病机制研究进展[J]. 天津医药, 2016, 44: 250–252. |
| [3] | BARTLEY G B, GORMAN C A. Diagnostic criteria for Graves' ophthalmopathy[J]. Am J Ophthalmol, 1995, 119: 792–795. DOI: 10.1016/S0002-9394(14)72787-4 |
| [4] | 何为民, 罗清礼, 曾继红. 地塞米松对甲状腺相关眼病眼眶成纤维细胞ICAM-1表达的影响[J]. 四川大学学报(医学版), 2007, 38: 113–115. |
| [5] | WILSON R, CHOPRA M, BRADLEY H, McKILLOP J H, SMITH W E, THOMSON J A. Free radicals and Graves' disease:the effects of therapy[J]. Clin Endocrinol (Oxf), 1989, 30: 429–433. DOI: 10.1111/j.1365-2265.1989.tb00442.x |
| [6] | ADEMOĞLU E, ÖZBEY N, ERBIL Y, TANRIKULU S, BARBAROS U, YANIK B T, et al. Determination of oxidative stress in thyroid tissue and plasma of patients with Graves' disease[J]. Eur J Intern Med, 2006, 17: 545–550. DOI: 10.1016/j.ejim.2006.04.013 |
| [7] | ERDAMAR H, DEMIRCI H, YAMAN H, ERBIL M K, YAKAR T, SANCAK B, et al. The effect of hypothyroidism, hyperthyroidism, and their treatment on parameters of oxidative stress and antioxidant status[J]. Clin Chem Lab Med, 2008, 46: 1004–1010. |
| [8] | TSAI C C, WU S B, CHENG C Y, KAO S C, KAU H C, LEE S M, et al. Increased response to oxidative stress challenge in Graves' ophthalmopathy orbital fibroblasts[J]. Mol Vis, 2011, 17: 2782–2788. |
| [9] | YANG C X, YAN H, DING T B. Hydrogen saline prevents selenite-induced cataract in rats[J]. Mol Vis, 2013, 19: 1684–1693. |
| [10] | YOKOTA T, KAMIMURA N, IGARASHI T, TAKAHASHI H, OHTA S, OHARAZAWA H. Protective effect of molecular hydrogen against oxidative stress caused by peroxynitrite derived from nitric oxide in rat retina[J]. Clin Exp Ophthalmol, 2015, 43: 568–577. DOI: 10.1111/ceo.2015.43.issue-6 |
| [11] | 秦秀军, 安全, 张伟, 李建国, 李炜宾, 李幼忱, 等. 富氢水制备及保存方法的初步研究[J]. 癌变·畸变·突变, 2013, 25: 457–460. DOI: 10.3969/j.issn.1004-616x.2013.06.012 |
 2018, Vol. 39
2018, Vol. 39


