腹股沟疝修补术、开胸手术等多种常规临床手术常可诱发术后慢性疼痛综合征(chronic postsurgical pain syndrome,CPPS),主要表现为手术及其邻近部位持续数月乃至数年的痛觉过敏[1-2]。由于发病机制尚不清楚,且常规的非甾类镇痛药和阿片类药物均疗效不佳[3],CPPS严重影响了患者的生命质量和机能恢复。因此,阐明手术诱导痛觉过敏的机制从而寻找到合适的防治手段有重要的临床意义和巨大的社会效益。研究显示,趋化因子家族成员基质细胞衍生因子(stromal cell-derived factor 1,SDF-1)参与了包括病理性疼痛在内的多种神经系统生理、病理过程[4]。但其是否也参与术后慢性疼痛的发生、发展还不清楚,故本研究通过建立大鼠持续性疼痛动物模型探讨SDF-1对皮肤肌肉切口牵拉术(skin/muscle incision and retraction,SMIR)所致痛觉敏化的影响。
1 材料和方法 1.1 动物、试剂与仪器选用8~10周龄、体质量210~220 g、无特定病原体级的健康雄性SD大鼠[海军军医大学(第二军医大学)实验动物中心,动物生产许可证号:SCXK(沪)2012-0003,使用许可证号:SYXK(沪)2012-0003],实验前适应性饲养1周。设动物饲养室温度为20~25 ℃,湿度为20%~30%,每天的光暗周期比为1:1。全部实验步骤均按照实验动物护理与应用指南实施。
SDF-1中和性抗体(AMD3100;Torrey Pines Biolabs,美国),SDF-1兔多克隆抗体(ab9797;Abcam,英国)。实验动物行为学测定采用7370 Von Frey Hair(UgoBasile,美国)。MK3型酶标仪[赛默飞世尔科技(中国)有限公司],电泳电转系统(Bio-Rad,美国),5200型全自动化学发光图像分析系统(Tanon,中国),解剖显微镜(Olympus,日本),微电极操纵器(Narishige,日本),DAM 60放大器(World Precision Instruments,美国),DT2821-F-16SE数模转换器(BrainWave System Corporation,美国),示波器(Hitachi Denshi,日本),刺激器(Nihon Kohden,日本),隔离器(Nihon Kohden,日本),钨丝微电极(World Precision Instruments,美国)。
1.2 实验模型建立与分组构建大鼠SMIR后持续性疼痛动物模型[5]。具体操作步骤如下:用戊巴比妥钠(50 mg/kg)麻醉大鼠,在距离隐静脉4 mm的股内侧切开皮肤,暴露股薄肌并切开浅表肌肉,钝性分离至约8 mm。插入微型解剖牵开器,牵拉皮肤、肌肉1 h;牵拉结束后逐层缝合肌肉及皮肤。
根据SMIR后测定大鼠痛阈和脊髓SDF-1表达的时间,将24只雄性SD大鼠随机分为4组:SMIR后1、5、10和20 d组(每组6只),分别于术后第1、5、10、20天测定痛阈,获得撤足反射阈值1 h后取脊髓组织检测SDF-1的表达。另取12只雄性SD大鼠随机分为假手术组和SMIR+鞘内注射SDF-1中和性抗体组(SMIR+anti-SDF-1组),每组6只。假手术组仅切开皮肤,不执行SMIR,并分别在术后第1、5、10、20天测定痛阈,在第20天获得撤足反射阈值1 h后取脊髓组织检测SDF-1的表达;SMIR+anti-SDF-1组预先鞘内注射1 g/L的SDF-1中和性抗体(注射剂量为10 μL),2 h后行SMIR,并分别于术后第1、5、10、20天测定痛阈。电生理实验中再另取18只雄性SD大鼠随机分为假手术组、SMIR组和SMIR+脊髓表面给予SDF-1中和性抗体组(SMIR+anti-SDF-1组),每组6只,具体干预方法见1.5项。
1.3 蛋白质印迹法检测大鼠脊髓组织中SDF-1表达用戊巴比妥钠麻醉大鼠,迅速取脊髓组织并立即将其浸入预先充有饱和混合氧(95% O2、5% CO2)的1~3 ℃ Krebs液中。然后将脊髓组织固定于琼脂块上,置于切片机载物台上,覆以冷Krebs液,切取层厚为500 μm的脊髓切片。用punch法取脊髓背角组织,添加Tris裂解缓冲液(pH 7.6),在低温条件下匀浆,并实施超声波破碎,12 000 r/min(离心半径为0.1 m)低温离心,取上清。用BCA法检测蛋白质浓度,取50 μg添加上样缓冲液6 μL,混合均匀后,沸水煮沸10 min。进行SDS-PAGE(200 V、45 min)后转移至PVDF膜(100 V、1 h),用5%脱脂奶粉TBST封闭液室温下封闭1 h。4 ℃过夜孵育SDF-1一抗(稀释比例为1:1 000),第2天用TBST洗膜3次,共30 min。用辣根过氧化物酶标记的二抗孵育1 h,洗3次后进行ECL显色,暗室曝光拍照。
1.4 痛行为学测定用up-down法检测撤足反射阈值,观察大鼠痛阈变化及时程。将大鼠置于透明的有机玻璃箱内,箱底为金属网(网格大小为0.8 cm×0.8 cm)。通过网孔用Von Frey hair(0.97、2、3.87、5.9、8.3、10.1、14.4、27.5 g)刺激大鼠后爪底部皮肤。每次刺激持续2~3 s,每两次刺激间隔时间为5 min,每个强度应用10次。大鼠出现快速抬起后爪或舔舐后爪行为表示为阳性反应。计算50%阳性反应阈值为大鼠的撤足反射阈值,50%阳性反应阈值(g)=[10(Xf+kδ)]/10 000,其中Xf为初次测试Von Frey hair的对数值,k值可根据撤足反应模式查表得出,δ为8根Von Fery hairs间对数差值的平均值。预实验结果显示,SMIR后10 d时痛阈最低,且至少维持到20 d,因此本实验确定取样时间为术前1 d和术后1、5、10、20 d。
1.5 在体记录脊髓背角C纤维诱发场电位检测SMIR对大鼠脊髓背角C纤维诱发场电位长时程增强(long-term potentiation,LTP)的影响。方法简述如下:在20%乌拉坦5 mL/kg麻醉下行椎板切除术,暴露脊髓腰膨大部,同时行SMIR。手术暴露一侧坐骨神经,安装一对刺激电极。电刺激(20 V、0.5 ms,每分钟1次)坐骨神经的同时,用微电极记录同侧脊髓背角C纤维诱发场电位LTP。观察并记录脊髓表面局部给予SDF-1中和性抗体50 μg和未给药时SMIR对C纤维诱发场电位LTP的影响。
1.6 统计学处理用SPSS 17.0和GraphPad Prism 5.01软件进行数据分析。先用SPSS 17.0软件实施正态性与方差齐性检验,服从正态分布的计量资料以x±s表示,然后用GraphPad Prism 5.01软件进行t检验。检验水准(α)为0.05。
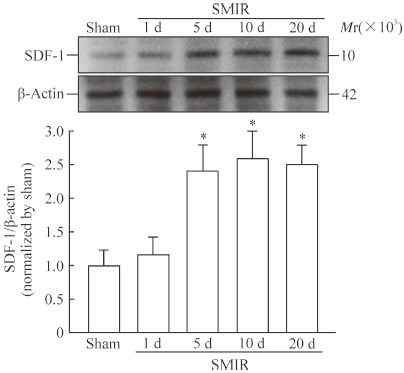
2 结果 2.1 SMIR后大鼠脊髓SDF-1表达水平如图 1所示,SMIR后第5、10、20天大鼠脊髓SDF-1的表达水平均高于假手术组(P均<0.05)。
|
图 1 SMIR后不同时间大鼠脊髓组织SDF-1的表达 Fig 1 Expression of SDF-1 in spinal cord at different phases after SMIR SMIR: Skin/muscle incision and retraction; SDF-1: Stromal cell-derived factor 1. *P < 0.05 vs sham group. n=6, x±s |
2.2 鞘内注射SDF-1中和性抗体后SMIR模型大鼠机械性痛阈的变化
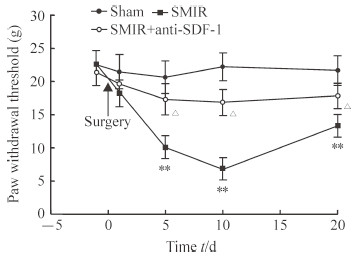
用up-down法检测SMIR后不同时间点大鼠机械性撤足反射阈值,结果(图 2)显示,与假手术组相比,SMIR后第5天开始大鼠机械性撤足反射阈值降低,并持续至术后第20天(P<0.01);鞘内注射SDF-1中和性抗体可缓解大鼠痛阈的降低(P<0.05),提示SDF-1参与SMIR诱导的痛觉过敏。
|
图 2 鞘内注射SDF-1中和性抗体(10 μg)缓解SMIR致大鼠机械性痛觉过敏 Fig 2 Intrathecal injection of SDF-1 neutralizing antibody (10 μg) attenuating rat mechanical allodynia induced by SMIR SMIR: Skin/muscle incision and retraction; SDF-1: Stromal cell-derived factor 1. **P < 0.01 vs sham group; △P < 0.05 vs SMIR group. n=6, x±s |
2.3 SDF-1中和性抗体干预后SMIR模型大鼠脊髓背角C纤维诱发场电位LTP的变化
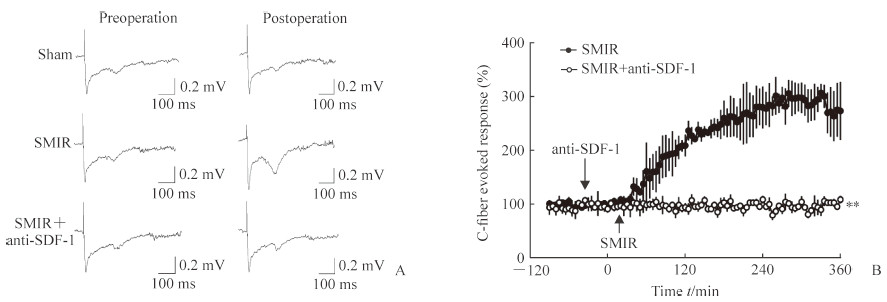
图 3A为电生理变化的原始图,图 3B是数据分析比较图。由图 3B可见,SMIR后60 min大鼠脊髓背角C纤维诱发场电位LTP开始升高,约300 min时达高峰(P<0.01),脊髓表面局部给予SDF-1中和性抗体干预后SMIR所致的LTP升高被逆转(P<0.01)。
|
图 3 脊髓表面局部给予SDF-1中和性抗体(50 μg)后SMIR所致的LTP升高被逆转 Fig 3 Local application of SDF-1 neutralizing antibody (50 μg) on rat spinal cord surface preventing SMIR-induced LTP A: Original graph of electrophysiology; B: Chart of data analysis. SMIR: Skin/muscle incision and retraction; SDF-1: Stromal cell-derived factor 1; LTP: Long-term potentiation. **P < 0.01 vs SMIR group. n=6, x±s |
3 讨论
Flatters[5]在2008年首次提出大鼠SMIR动物模型,该模型可模仿术中切口牵拉外科行为,同时不损伤外周神经,能够形成大约4周的持续性痛觉过敏,现已被广泛应用并作为研究术后慢性疼痛的可靠模型,因此本研究也选择了SMIR模型复制术后慢性疼痛。预实验观察了大鼠的痛阈变化和时程,结果显示SMIR后大鼠痛行为学发生改变,验证了本研究成功建模。紧接着在模型稳定的基础上连续监测大鼠的机械痛阈,结果显示第5天开始降低,至第10天痛阈最低,且至少维持到第20天,因此本研究确定取样时间为术后第1、5、10、20天。
SDF-1是趋化因子家族中的重要成员,既往一直在肿瘤免疫炎性反应中被广泛研究,近年来发现其同样存在于中枢神经系统且可以介导多种原因诱导的痛觉过敏。有研究显示SDF-1介导了神经损伤、炎症等多种原因诱导的痛觉过敏[6-7]。例如,在脊髓损伤、蜂毒注射诱导痛觉过敏模型中均观察到SDF-1显著上调[8-9]。可能原因是炎症、损伤等伤害性刺激激活脊髓背角小胶质细胞从而使SDF-1分泌增多[10-11]。但SDF-1是否也参与了术后慢性疼痛尚不清楚,也未见相关报道。
本实验通过up-down法检测大鼠SMIR后不同时间点的机械性撤足反射阈值,建模成功后大鼠痛阈降低,鞘内注射SDF-1中和性抗体后痛阈升高。表明SDF-1可以干预SMIR所致的痛觉过敏,结合SMIR后大鼠脊髓SDF-1表达水平上调的结果,可以认为SDF-1参与了SMIR所致的术后痛觉过敏。然后本研究通过电生理学实验对这一假设进行验证。LTP对疼痛感知很重要,其异常升高是中枢神经系统慢性疼痛的关键特征之一[12]。本实验结果显示,SMIR后大鼠脊髓背角C纤维诱发场电位LTP升高,脊髓表面局部给予SDF-1中和性抗体干预后这种升高被逆转,进一步表明SDF-1可以干扰SMIR所致的术后痛觉过敏。
综上所述,SDF-1参与了SMIR所致的大鼠痛觉过敏,这一结论为探讨术后慢性疼痛的发生机制提供了新的思路,为防治术后慢性疼痛提供了新的干预靶点。但SDF-1通过何种机制、何种信号通路介导和调节SMIR诱导的痛觉过敏仍有待深入研究。
| [1] | REDDI D, CURRAN N. Chronic pain after surgery:pathophysiology, risk factors and prevention[J]. Postgrad Med J, 2014, 90: 222–227. DOI: 10.1136/postgradmedj-2013-132215 |
| [2] | VAN RIJCKEVORSEL D C, DEVRIES M, SCHREUDER L T, WILDER-SMITH O H, VAN GOOR H. Risk factors for chronic postsurgical abdominal and pelvic pain[J]. Pain Manag, 2015, 5: 107–116. DOI: 10.2217/pmt.14.47 |
| [3] | CHAPARRO L E, SMITH S A, MOORE R A, WIFFEN P J, GILRON I. Pharmacotherapy for the prevention of chronic pain after surgery in adults[J/CD]. Cochrane Database Syst Rev, 2013(7): CD008307. doi: 10.1002/14651858. http://cochranelibrary-wiley.com/doi/10.1002/14651858.CD008307.pub2/full |
| [4] | LUO X, WANG X, XIA Z, CHUNG S K, CHEUNG C W. CXCL12/CXCR4 axis:an emerging neuromodulator in pathological pain[J]. Rev Neurosci, 2016, 27: 83–92. |
| [5] | FLATTERS S J. Characterization of a model of persistent postoperative pain evoked by skin/muscle incision and retraction (SMIR)[J]. Pain, 2008, 135: 119–130. DOI: 10.1016/j.pain.2007.05.013 |
| [6] | REAUX-LE GOAZIGO A, RIVAT C, KITABGI P, POHL M, MELIK PARSADANIANTZ S. Cellular and subcellular localization of CXCL12 and CXCR4 in rat nociceptive structures:physiological relevance[J]. Eur J Neurosci, 2012, 36: 2619–2631. DOI: 10.1111/ejn.2012.36.issue-5 |
| [7] | GOSSELIN R D, DANSEREAU M A, POHL M, KITABGI P, BEAUDET N, SARRET P, et al. Chemokine network in the nervous system:a new target for pain relief[J]. Curr Med Chem, 2008, 15: 2866–2875. DOI: 10.2174/092986708786242822 |
| [8] | YANG F, SUN W, YANG Y, WANG Y, LI C L, FU H, et al. SDF1-CXCR4 signaling contributes to persistent pain and hypersensitivity via regulating excitability of primary nociceptive neurons: involvement of ERK-dependent Nav1. 8 up-regulation[J/OL]. J Neuroinflammation, 2015, 12: 219. doi: 10.1186/s12974-015-0441-2. http://cn.bing.com/academic/profile?id=059883adb04cda05290ce613a0f2568b&encoded=0&v=paper_preview&mkt=zh-cn |
| [9] | KNERLICH-LUKOSCHUS F, VON DER ROPPBRENNER B, LUCIUS R, MEHDORN H M, HELDFEINDT J. Spatiotemporal CCR1, CCL3(MIP-1α), CXCR4, CXCL12(SDF-1α) expression patterns in a rat spinal cord injury model of posttraumatic neuropathic pain[J]. J Neurosurg Spine, 2011, 14: 583–597. DOI: 10.3171/2010.12.SPINE10480 |
| [10] | YANG F, LUO W J, SUN W, WANG Y, WANG J L, YANG F, et al. SDF1-CXCR4 signaling maintains central post-stroke pain through mediation of glial-neuronal interactions[J/OL]. Front Mol Neurosci, 2017, 10: 226. doi: 10.3389/fnmol.2017.00226. https://www.researchgate.net/publication/318636114_SDF1-CXCR4_Signaling_Maintains_Central_Post-Stroke_Pain_through_Mediation_of_Glial-Neuronal_Interactions |
| [11] | BAI L, WANG X, LI Z, KONG C, ZHAO Y, QIAN J L, et al. Upregulation of chemokine CXCL12 in the dorsal root ganglia and spinal cord contributes to the development and maintenance of neuropathic pain following spared nerve injury in rats[J]. Neurosci Bull, 2016, 32: 27–40. DOI: 10.1007/s12264-015-0007-4 |
| [12] | ZHUO M. Long-term potentiation in the anterior cingulate cortex and chronic pain[J/OL]. Philos Trans R Soc Lond B Biol Sci, 2013, 369: 20130146. doi: 10.1098/rstb.2013.0146. http://cn.bing.com/academic/profile?id=fdef23803179572f9ed6599636327718&encoded=0&v=paper_preview&mkt=zh-cn |
 2018, Vol. 39
2018, Vol. 39


