慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是危害人体健康的一种常见的呼吸系统慢性疾病,其全球病死率仍在逐年上升,对社会、家庭和个人带来了沉重的经济负担[1]。COPD急性加重会导致患者的症状明显加重、肺功能进一步恶化,甚至引起呼吸衰竭、肺源性心脏病等严重并发症而危及生命,是COPD患者生存的独立预后因素,且频繁急性加重者病死率较非频繁急性加重者高[2]。寻找易于在临床上开展应用的生物标志物有助于早期发现疾病的易感因素、改善预后,并可为进一步实施个体化治疗、干预、研发新型治疗药物提供理论依据。白细胞介素(interleukin,IL)-8是一种功能强大的中性粒细胞趋化因子,可作为判断COPD急性加重的生物标志物,有文献报道IL-8可作为判断COPD急性加重期无创机械通气治疗预后的独立预测因素[3],但有关IL-8对预测COPD急性加重价值的研究尚未见报道。本研究分析2015年9月至2016年5月在我院初诊或就诊的既往未接受规范化治疗的112例急性加重期COPD患者的病例资料,旨在探讨血清趋化因子IL-8对COPD急性加重的预测价值。
1 对象和方法 1.1 研究对象选取2015年9月至2016年5月在海军军医大学(第二军医大学)长海医院呼吸与危重症医学科门诊初诊或就诊的既往无使用吸入性糖皮质激素、长效β2受体激动剂和长效胆碱能受体阻滞剂史的112例急性加重期COPD患者,均符合慢性阻塞性肺疾病全球创议(global initiative for chronic obstructive lung disease,GOLD)2015年推荐的肺功能诊断标准,即吸入支气管扩张剂后第1秒用力呼气容积(forced expiratory volume in one second,FEV1)/用力呼气容积(forced vital capacity,FVC)<70%[1]。急性加重期COPD定义:依据GOLD 2015指南,符合患者呼吸系统症状恶化、超出日常变异,并且导致需要住院和(或)导致死亡、需要静脉使用抗生素或全身应用糖皮质激素治疗的COPD患者。本研究通过海军军医大学(第二军医大学)长海医院医学伦理委员会审批,所有患者均签署由伦理委员会批准的受试者知情同意书。
1.2 研究方法 1.2.1 基本资料收集患者年龄、既往过敏性鼻炎病史、慢性阻塞性肺疾病评估测试(chronic obstructive pulmonary disease assessment test,CAT)评分、患者就诊前12个月急性加重病史、血常规等。
1.2.2 吸烟情况吸烟量以包年(pack-year)为单位,将完全停止吸烟至少1年以上的患者定义为既往吸烟者。
1.2.3 肺功能检查用肺功能仪(德国耶格公司)测定肺功能。测定前需要常规定标,操作护师需详细和耐心地向患者说明测定过程和注意事项,避免影响测定结果。每项操作程序测定3~5次,选用最佳的一次数据进行统计分析。测定内容包括FEV1、FVC等。
1.2.4 呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)检测采用瑞典尼尔斯FeNO测定系统测定。检测当日所有患者禁止饮用乙醇类、咖啡类饮料,避免剧烈活动,避免吸烟及被动吸烟。检测方法按照美国胸科学会(American Thoracic Society,ATS)/欧洲呼吸学会(European Respiratory Society,ERS)操作标准[4]进行:嘱患者先尽力呼气排空肺内气体,用嘴紧含测定仪滤器,深吸气后以平稳的气流均匀呼气,设定呼气流速为50 mL/s,呼出时间为10 s,随后读取检测数值。
1.2.5 血液生物化学指标采集及检测所有COPD患者均用一次性注射器抽取静脉血2 mL,分离血清,用ELISA检测血清IL-8、IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、免疫球蛋白E(immunoglobulin E,IgE)水平,用比色法检测血清超氧化物歧化酶(superoxide dismutase,SOD)水平,分别按照相应指标检测试剂盒说明书进行操作。本研究使用的检测试剂盒中血清IL-8、IL-6、TNF-α、IgE、SOD的正常参考值分别为<62 pg/mL、<5.9 pg/mL、<8.1 pg/mL、<165 U/mL及129~216 U/mL。
1.2.6 COPD患者分组及随访根据首次测得的血清IL-8水平将COPD患者分为高IL-8(≥62 pg/mL)组和低IL-8(<62 pg/mL)组。患者COPD急性加重得到控制后,根据GOLD 2015指南[1]选择稳定期治疗方案:CAT评分<10分且既往12个月内急性加重次数为0或1次的患者,给予沙丁胺醇按需使用;CAT评分≥10分且既往12个月内急性加重次数为0或1次的患者,给予噻托溴铵(正大天晴药业集团股份有限公司,18 μg;1次/d)+福莫特罗(正大天晴药业集团股份有限公司,4.5 μg;2次/d)吸入治疗;既往12个月内急性加重次数≥2次或FEV<50%预计值的患者,给予布地奈德/福莫特罗(瑞典阿斯利康有限公司,160 μg/4.5 μg;2次/d)或沙美特罗/氟替卡松(英国葛兰素威康公司,500 μg/50 μg;2次/d)+噻托溴铵(正大天晴药业集团股份有限公司,18 μg;1次/d)吸入治疗。治疗持续1年,每2个月进行门诊或电话随访,询问患者的急性加重情况。以患者就诊入组时间为随访开始时间,记录从随访开始至第1次发生中重度急性加重的间隔时间及随访12个月内急性加重次数。
1.3 统计学处理应用GraphPad Prism 5.0软件进行数据分析。呈正态分布的计量资料以x±s表示,组间比较采用两样本均数t检验;非正态分布的计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用Mann-Whitney秩和检验或非配对t检验;计数资料以例数和百分数表示,组间比较采用χ2检验。血清IL-8和各变量之间的单因素分析采用Spearman相关分析,用Cox回归分析两组COPD患者急性加重的相对危险度(related risk,RR),用Kaplan-Meier曲线分析随访12个月两组无急性加重COPD患者所占比例的差异和风险比(hazard ratio,HR)。检验水准(α)为0.05。
2 结果 2.1 血清高IL-8组和低IL-8组COPD急性加重患者一般资料比较本研究共纳入COPD患者112例,年龄为47~80岁,平均为(63.58±8.98)岁。男性97例(86.61%)、女性15例(13.39%),吸烟者108例(96.43%),长期接触甲醛者1例。高IL-8组47例,其中男性40例、女性7例,中位IL-8水平为170.00(111.00,472.00)pg/mL;低IL-8组65例,其中男性57例、女性8例,中位IL-8水平为22.40(7.90,34.45)pg/mL。高IL-8组过敏性鼻炎患者的占比为51.06%(24/47),高于低IL-8组的10.77%(7/65),两组间差异有统计学意义(χ2=24.34,P<0.01);高IL-8组CAT评分高于低IL-8组且差异有统计学意义(24.81±5.10 vs 19.38±4.27,t =3.11,P<0.01);高IL-8组既往急性加重次数多于低IL-8组且差异有统计学意义[1.5(1.0,2.5)vs 1.0(0.0,1.5),t =2.77,P<0.01]。两组患者的年龄,性别,吸烟量,FeNO,血清IgE、SOD、TNF-α和IL-6水平,中性粒细胞计数、中性粒细胞比例以及嗜酸性粒细胞计数、嗜酸性粒细胞比例差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 血清高IL-8组和低IL-8组COPD急性加重患者临床特征比较 Tab 1 Comparison of clinical characteristics of COPD patients with acute exacerbation between high and low IL-8 groups |
2.2 血清IL-8与COPD急性加重患者肺通气、换气功能的关系
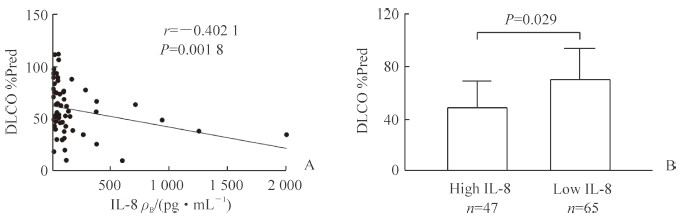
112例COPD急性加重患者吸入支气管扩张剂后平均FEV1/FVC为(55.47±15.43)%。吸入支气管扩张剂前、后高IL-8组和低IL-8组COPD患者FEV1/FVC、FEV1、FEV1占预计值的百分比(FEV1%Pred)差异均无统计学意义(P均>0.05);在小气道功能方面,高IL-8组吸入支气管扩张剂前用力呼气中期流速(forced expiratory flow at 25%-75% of forced vital capacity,FEF25%-75%)、FEF25%-75%占预计值的百分比(FEF25%-75%Pred)、用力呼气75%用力肺活量流速(forced expiratory flow at 75% of forced vital capacity,FEF75%)、FEF75%占预计值的百分比(FEF75%Pred)均低于低IL-8组,差异均有统计学意义(P均<0.05)。见表 2。患者血清IL-8水平与一氧化碳弥散量占预计值的百分比(DLCO%Pred)呈负相关,差异有统计学意义(r=-0.402 1,P=0.001 8);高IL-8组DLCO%Pred低于低IL-8组,差异有统计学意义[(51.52±26.41)% vs(72.98±18.70)%,t =2.33,P=0.029]。见图 1。
|
|
表 2 血清高IL-8组和低IL-8组COPD患者肺功能比较 Tab 2 Comparison of lung function of COPD patients between high and low IL-8 groups |
|
图 1 COPD患者血清IL-8与DLCO%Pred的关系及高、低IL-8组DLCO%Pred的比较 Fig 1 Relationship of serum IL-8 level and DLCO%Pred in COPD patients and comparison of DLCO%Pred between high and low IL-8 groups A: Serum IL-8 level was negatively correlated with DLCO%pred of COPD patients; B: The DLCO%Pred of COPD patients was significantly lower in high IL-8 (≥62 pg/mL) group than that in low IL-8 (< 62 pg/mL) group (x±s). COPD: Chronic obstructive pulmonary disease; IL-8: Interleukin 8; DLCO%Pred: Diffusion capacity for carbon monoxide as percentage of predicted |
2.3 血清高IL-8组和低IL-8组COPD急性加重患者随访时的急性加重情况
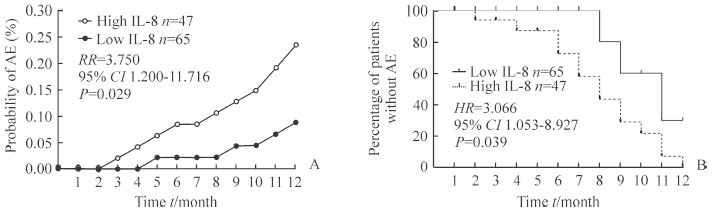
在随访12个月规范化治疗期间,112例COPD患者共出现中重度急性加重15次,其中高IL-8组11次、低IL-8组4次,随时间累积高IL-8组急性加重的风险高于低IL-8组,RR为3.750(95% CI:1.200~11.716,P=0.029),见图 2A。随访期间高IL-8组距离第1次急性加重的中位时间短于低IL-8组[8.00(6.00,10.25)个月vs 11.0(9.00,12.00)个月,HR为3.066(95% CI:1.053~8.927,P=0.039)],见图 2B。
|
图 2 高、低IL-8 组COPD患者随访 12 个月急性加重情况及第1次急性加重时间的比较 Fig 2 Comparison of AE and time to first AE of COPD patients between high and low IL-8 groups during 12 months of follow-up A: Accumulated risk of moderate to severe AE in high IL-8 group was siginificantly more than that in low IL-8 group; B: The percentage of COPD patients without AE during 12 months of follow-up in high IL-8 (≥62 pg/mL) group was less than that in low IL-8 (<62 pg/mL) group. IL-8: Interleukin 8; COPD: Chronic obstructive pulmonary disease; AE: Acute exacerbation; RR: Related risk; CI: Confidence interval; HR: Hazard ratio |
3 讨论
COPD是以气流受限不可逆性进展为主要特征的呼吸系统疾病,已经日益成为造成严重经济负担及社会负担的常见慢性疾病,而COPD的急性加重是影响患者预后的独立危险因素[2],加强对COPD急性加重的防控对改善预后、降低病死率至关重要。因此,寻找能够预测COPD急性加重且在临床上容易获得的指标将有助于及时发现危险人群、开展个体化精准治疗、早期干预、改善预后。目前临床上用于预测COPD急性加重的指标包括患者既往急性加重次数、气流受限程度、生活质量评分及合并胃食管反流[5]。但这些临床指标因受主观判断影响或不易反复进行客观检查等因素而影响其特异度及灵敏度[6],寻找可以预测COPD急性加重的生物标志物近年来备受关注。
用于COPD诊治及判断预后的生物标志物既往主要集中在痰液、诱导痰或支气管肺泡灌洗液等标本,但气道标本留取耗时、送检标本质控要求高、能够开展诱导痰操作的中心及专业人员有限、反复经支气管镜操作取支气管肺泡灌洗液难以实现且存在手术操作风险。采用血清学检测被认为是一种风险小、稳定性好、标本获得容易的替代方法,便于在临床推广应用。
COPD是一种慢性呼吸系统炎性疾病,局部及全身性炎性反应与其发生、发展密切相关,研究发现多种血清炎性生物标志物对COPD急性加重风险预测具有一定作用,例如IL-6[7]、纤维蛋白原和C-反应蛋白[8]、脂联素[9]等。由于不同研究得出的结论不一致,导致迄今指南尚未推荐可在临床上广泛应用的血清标志物,而研究结果的重复性不佳可能主要与大部分研究为回顾性总结分析以及COPD患者异质性明显等有关[10]。目前国内外采用前瞻性研究方法探讨血清标志物对COPD急性加重预测价值的研究不多。本研究则以前瞻性的方法探讨了血清趋化因子IL-8对COPD患者急性加重风险的预测价值,结果发现患者血清IL-8水平增高可增加COPD中重度急性加重风险,尽管本研究样本量小,但结果与国外大样本的COPDGene和ECLIPSE研究结果[11-12]一致,在大样本SPIROMICS研究中也显示出血清IL-8对肺功能2~4级COPD患者重度急性加重具有一定预测价值[13-14],提示血清IL-8对COPD急性加重的预测作用较为稳定且不受人种的影响。另外,本研究中入选患者均为初诊或前期未经COPD规范化治疗的不同程度急性加重期COPD患者,侧重反映了患者血清IL-8的基础水平,而其他研究中多选择已经接受过治疗的稳定期患者[15-16],提示无论急性加重期及稳定期的血清IL-8水平对预后均具有一定的判断价值。
IL-8是一种多细胞来源的、具有多种生物学功能的细胞趋化因子,可作用于不同细胞产生不同的效应,其效应细胞主要包括中性粒细胞、T淋巴细胞、肥大细胞、单核细胞、嗜酸性粒细胞,具有促进炎性反应进程、调节机体免疫功能、刺激毛细血管形成等作用。此外,IL-8是一种强大的中性粒细胞趋化剂,可促使中性粒细胞脱颗粒、释放弹性蛋白酶等多种蛋白水解酶,造成肺局部的蛋白酶-抗蛋白酶失衡,破坏自身组织结构,损伤肺组织和肺泡壁,并引发中性粒细胞呼吸爆发,释放大量氧自由基和花生四烯酸代谢产物,导致呼吸膜通透性增高,引发肺组织的损伤。IL-8还可直接引起支气管平滑肌痉挛[17]、通过上调黏蛋白MUC5AC和MUC5B的基因表达促进气道黏液高分泌[15]。已有文献证实IL-8与COPD关系密切,Shaker等[16]报道COPD患者血清IL-8水平较吸烟无COPD患者明显升高,可与金属蛋白酶组织抑制剂1联合作为筛查吸烟者中COPD患者的有效指标;COPD患者的支气管肺泡灌洗液和痰液中的IL-8水平均有升高,与稳定期相比,急性加重期IL-8水平会进一步升高;贺蓓等[18]研究发现COPD患者肺泡巨噬细胞释放的IL-8不仅与FEV1/FVC呈负相关,且与50%用力肺活量时最大呼气流量(V50)、25%用力肺活量时最大呼气流量(V25)等反映小气道功能的多个指标密切相关,被认为是肺功能下降的重要影响因素。本研究结果为IL-8在COPD中的作用特别是在判断患者预后方面做了进一步补充。
IL-8水平增高与COPD急性加重风险增加的机制在已有文献中尚不明确,结合本研究结果,推测其可能机制包括:(1)肺通气功能差。本研究发现高IL-8组肺通气功能较低水平组有下降趋势,有些指标未达到统计学差异可能与样本量较少有关,高IL-8组的FEV1已接近重度水平并存在小气道功能下降,严重的阻塞性通气功能障碍及小气道功能障碍被认为是COPD急性加重的危险因素。(2)症状重。本研究中IL-8水平≥62 pg/mL的患者CAT评分高、症状重、既往急性加重次数多,后两项已被证实是COPD频繁急性加重的危险因素,因此在临床上应更加重视IL-8水平增高患者的临床症状及生活质量。(3)弥散功能低。本研究发现IL-8水平与COPD患者DLCO%Pred呈负相关,提示IL-8影响患者弥散功能,Motegi等[19]进行了一项为期2年的前瞻性研究,发现COPD急性加重与低弥散功能相关。弥散功能与IL-8相关作用的具体机制及其对COPD患者急性加重的确切影响尚需深入探讨和大样本的进一步研究。(4)过敏性疾病影响。Kumar等[20]报道,伴有过敏体质及上气道症状的COPD患者症状更严重。Guevara-Rattray等[21]发现40岁及以上人群的气流受限与过敏体质密切相关。有关过敏体质对COPD患者急性加重的影响还不清楚,本研究发现急性加重风险增高的高IL-8患者中,血IgE、嗜酸性粒细胞计数等反映变应性体质的指标与低IL-8组无明显差异,但患者的FeNO均高于正常水平(正常值<2.5×10-7)、过敏性鼻炎比例高于低IL-8组,再次提示过敏气道炎症与COPD预后有关,但IL-8在其中发挥的作用有待深入研究。
本研究的局限性包括未同时采用多种可能炎性标志物进行联合评估,尽管有研究推荐联合多种血清学标志物可能对预测价值更大,但如果能用较少的、有意义的指标进行检测不仅可以满足临床需求还有助于节省医疗费用,同时方便医师在临床上应用和解读。另外,本研究发现高、低IL-8组间血清IL-6及TNF-α水平未见明显差异,稳定期IL-6是预测COPD急性加重风险的指标之一,在本研究中未发现类似结果,且IL-6与IL-8无相关性,仅与C-反应蛋白密切相关(数据未发表)。结果的差异可能与本研究纳入患者的标准有关,由于本组COPD患者均处于急性加重期,两组间IL-6未见明显差异提示急性加重期的IL-6水平对预后判断价值与IL-8有所不同,至于IL-8与IL-6或C-反应蛋白对COPD急性加重的潜在影响机制仍需要进一步深入探讨。
综上,血清趋化因子IL-8水平增高的COPD患者急性加重风险增加,可能与这些患者合并过敏体质、小气道功能及弥散功能受损加重有关。血清IL-8作为一种方便、经济的生物标志物,可用于鉴别COPD急性加重高风险患者。后续研究将进一步探讨IL-8水平增高的分子机制,加强对其靶向干预可能有助于改善COPD患者预后。
| [1] | Global Initiative for Chronic Obstructive Lung Disease (GOLD) Global Strategy for Diagnosis, Management, and Prevention of COPD (2016). (2016-01)[2017-11-28] http://www.goldcopd.com. |
| [2] | SOLER-CATALUÑA J J, MARTÍNEZ-GARCÍA M A, ROMÁN SÁNCHEZ P, SALCEDO E, NAVARRO M, OCHANDO R. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease[J]. Thorax, 2005, 60: 925–931. DOI: 10.1136/thx.2005.040527 |
| [3] | JÓNSDÓTTIR B, JAWOROWSKI Å, SAN MIGUEL C, MELANDER O. IL-8 predicts early mortality in patients with acute hypercapnic respiratory failure treated with noninvasive positive pressure ventilation[J/OL]. BMC Pulm Med, 2017, 17: 35. doi: 10.1186/s12890-017-0377-7. http://cn.bing.com/academic/profile?id=ea7c65ce88f95da7f643841ca59ca005&encoded=0&v=paper_preview&mkt=zh-cn |
| [4] | American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide[J]. Am J Respir Crit Care, 2005, 171: 912–930. DOI: 10.1164/rccm.200406-710ST |
| [5] | HURST J R, VESTBO J, ANZUETO A, LOCANTORE N, MÜLLEROVA H, TAL-SINGER R, et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease[J]. N Engl J Med, 2010, 363: 1128–1138. DOI: 10.1056/NEJMoa0909883 |
| [6] | ZEMANS R L, JACOBSON S, KEENE J, KECHRIS K, MILLER B E, TAL-SINGER R, et al. Multiple biomarkers predict disease severity, progression and mortality in COPD[J/OL]. Respir Res, 2017, 18: 117. doi: 10.1186/s12931-017-0597-7. http://cn.bing.com/academic/profile?id=7624c530d82229c51735f6441c8b9aa8&encoded=0&v=paper_preview&mkt=zh-cn |
| [7] | THOMSEN M, INGEBRIGTSEN T S, MAROTT J L, DAHL M, LANGE P, VESTBO J, et al. Inflammatory biomarkers and exacerbations in chronic obstructive pulmonary disease[J]. JAMA, 2013, 309: 2353–2361. DOI: 10.1001/jama.2013.5732 |
| [8] | DICKENS J A, MILLER B E, EDWARDS L D, SILVERMAN E K, LOMAS D A, TAL-SINGER R; Evaluation of COPD Longitudinally to Identify Surrogate Endpoints (ECLIPSE) study investigators. COPD association and repeatability of blood biomarkers in the ECLIPSE cohort[J/OL]. Respir Res, 2011, 12: 146. doi: 10.1186/1465-9921-12-146. http://cn.bing.com/academic/profile?id=fb9f23c9c5ba3ff97dc605e32c3ec39c&encoded=0&v=paper_preview&mkt=zh-cn |
| [9] | KIRDAR S, SERTER M, CEYLAN E, SENER A G, KAVAK T, KARADAĞ F. Adiponectin as a biomarker of systemic inflammatory response in smoker patients with stable and exacerbation phases of chronic obstructive pulmonary disease[J]. Scand J Clin Lab Invest, 2009, 69: 219–224. DOI: 10.1080/00365510802474400 |
| [10] | HURST J R, DONALDSON G C, PERERA W R, WILKINSON T M, BILELLO J A, HAGAN G W, et al. Use of plasma biomarkers at exacerbation of chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2006, 174: 867–874. DOI: 10.1164/rccm.200604-506OC |
| [11] | BRADFORD E, JACOBSON S, VARASTEH J, COMELLAS A P, WOODRUFF P, O'NEAL W, et al. The value of blood cytokines and chemokines in assessing COPD[J/OL]. Respir Res, 2017, 18: 180. doi: 10.1186/s12931-017-0662-2. http://cn.bing.com/academic/profile?id=f8325a5fa91fb3bcab3594b2d1e079ea&encoded=0&v=paper_preview&mkt=zh-cn |
| [12] | FANER R, TAL-SINGER R, RILEY J H, CELLI B, VESTBO J, MACNEE W, et al. ECLIPSE Study Investigators. Lessons from ECLIPSE:a review of COPD biomarkers[J]. Thorax, 2014, 69: 666–672. DOI: 10.1136/thoraxjnl-2013-204778 |
| [13] | KEENE J D, JACOBSON S, KECHRIS K, KINNEY G L, FOREMAN M G, DOERSCHUK C M, et al. Biomarkers predictive of exacerbations in the SPIROMICS and COPDGene cohorts[J]. Am J Respir Crit Care Med, 2017, 195: 473–481. DOI: 10.1164/rccm.201607-1330OC |
| [14] | HAN M K, QUIBRERA P M, CARRETTA E E, BARR R G, BLEECKER E R, BOWLER R P, et al. SPIROMICS investigators. Frequency of exacerbations in patients with chronic obstructive pulmonary disease:an analysis of the SPIROMICS cohort[J]. Lancet Respir Med, 2017, 5: 619–626. DOI: 10.1016/S2213-2600(17)30207-2 |
| [15] | GILOWSKA I. [CXCL8(interleukin 8)-the key inflammatory mediator in chronic obstructive pulmonary disease?] [J/OL]. Postepy Hig Med Dosw (Online), 2014, 68: 842-850. http://cn.bing.com/academic/profile?id=641a87cfce47a4f9de709154b58940fd&encoded=0&v=paper_preview&mkt=zh-cn |
| [16] | SHAKER S B, VON WACHENFELDT K A, LARSSON S, MILE I, PERSDOTTER S, DAHLBÄCK M, et al. Identification of patients with chronic obstructive pulmonary disease (COPD) by measurement of plasma biomarkers[J]. Clin Respir J, 2008, 2: 17–25. DOI: 10.1111/j.1752-699X.2007.00032.x |
| [17] | 侯静静, 朱蕾. 白介素-8与慢性阻塞性肺疾病[J]. 国外医学(呼吸系统分册), 2005, 25: 427–429. DOI: 10.3760/cma.j.issn.1673-436X.2005.06.010 |
| [18] | 贺蓓, 赵鸣武, 王玉柱, 柳晓芳, 姚婉贞. 慢性阻塞性肺疾病患者炎症细胞因子与肺通气功能的相关研究[J]. 中华结核和呼吸杂志, 2003, 26: 22–25. DOI: 10.3760/j:issn:1001-0939.2003.01.007 |
| [19] | MOTEGI T, JONES R C, ISHⅡ T, HATTORI K, KUSUNOKI Y, FURUTATE R, et al. A comparison of three multidimensional indices of COPD severity as predictors of future exacerbations[J]. Int J Chron Obstruct Pulmon Dis, 2013, 8: 259–271. |
| [20] | KUMAR A, KUNAL S, SHAH A. Frequency and effect of type 1 hypersensitivity in patients from India with chronic obstructive pulmonary disease and associated upper airways symptoms[J]. Asia Pac Allergy, 2017, 7: 199–205. DOI: 10.5415/apallergy.2017.7.4.199 |
| [21] | GUEVARA-RATTRAY E M, GARDEN F L, JAMES A L, WOOD-BAKER R, ABRAMSON M J, JOHNS D P, et al. Atopy in people aged 40 years and over:relation to airflow limitation[J]. Clin Exp Allergy, 2017, 47: 1625–1630. DOI: 10.1111/cea.13038 |
 2018, Vol. 39
2018, Vol. 39


