环维黄杨星D(cyclovirobuxine D,CB)是小叶黄杨的主要活性成分[1],其具有行气活血、通络止痛的药理作用[2],临床上主要用于治疗气滞血瘀所致的胸痹心痛、脉结代、冠心病、心律失常等[3]。细胞色素P450(cytochrome P450,CYP450)存在于人体肝脏、肠道和肾脏[4],参与药物等外源性物质的代谢[5]。酮康唑(ketoconazole,KET)为药物代谢实验中CYP450酶系的首选抑制剂[6]。近年来少见对CB及其制剂在体肠吸收特征的研究报道。本研究将CB与羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD)以研磨法制成CB羟丙基-β-环糊精包合物(CBHD),并采用单向肠灌流法考察了KET对CBHD在体肠吸收的影响,探讨了CB及CBHD在肠道的吸收代谢机制,为临床研究提供参考。
1 材料和方法 1.1 仪器Agilent 1260型高效液相色谱(high-performance liquid chromatography,HPLC)仪(美国Agilent公司);AB204S型电子分析天平(瑞士Mettler Toledo仪器公司);HWCL-3型集热式恒温磁力搅拌浴(郑州长城科技工贸有限公司);HL-1型恒流泵(上海青浦沪西仪器厂);HHS-4S型电子恒温不锈钢水浴锅(上海康路仪器设备有限公司);SHZ-D型循环水式真空泵(巩义市予华仪器有限责任公司);VOS-30A型真空干燥箱[施都凯仪器设备(上海)有限公司];VM-02U型旋涡混合器(美国精骐有限公司);G16型医用离心机(北京白洋医疗器械有限公司)。
1.2 药品与试剂CB纯度>99%,购于武汉富驰生物科技有限公司;HP-β-CD购于淄博千汇生物科技有限公司;1-萘基异氰酸酯购于美国Sigma公司;KET购于湖北兴银河化工有限公司;无水氯化钙(CaCl2)、羧甲基纤维素钠(CMC-Na)均购于成都市科龙化工试剂厂;磷酸二氢钾(KH2PO4)购于广东省化学试剂工程技术研究开发中心;氯化钠(NaCl)、碳酸氢钠(NaHCO3)、葡萄糖、七水硫酸镁(MgSO4 • 7H2O)均购于上海泰坦科技股份有限公司;氯化钾(KCl)、二氯甲烷(CH2Cl2)、无水乙醇购于重庆川东化工集团有限公司化学试剂厂;甲醇购于美国天地科技有限公司。
1.3 实验动物清洁级雄性SD大鼠24只,体质量为(200±20)g,由重庆医科大学实验动物中心提供,许可证号:CQLA-2016-164。
1.4 CBHD的制备采用研磨法。精密称取处方量CB、HP-β-CD,混合均匀,CB与HP-β-CD物质的量比为1:1,常温下加少量水研磨1 h,真空干燥2 h(真空度为0.09 MPa,干燥温度40 ℃),干燥物依次用少量乙醇和水洗涤,然后真空干燥12 h(真空度为0.09 MPa,干燥温度40 ℃),即得CBHD[7]。CBHD的平均包载率为95.31%[7]。
1.5 CB含量测定方法 1.5.1 色谱条件色谱仪:Agilent 1260型HPLC仪,荧光检测器(fluorescence detector,FLD);色谱柱:依利特C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水(85︰15,体积比);荧光检测:激发波长为231 nm,发射波长为385 nm;柱温为25 ℃,流速为1.0 mL/min;进样量为20 μL。
1.5.2 对照品溶液的制备精密称取CB 10 mg,以少量甲醇溶解后转移至100 mL容量瓶中,再用甲醇定容至刻度,配制成100 μg/mL的CB对照品溶液,于4 ℃冰箱中保存,备用。
1.5.3 1-萘基异氰酸酯溶液的配制取1-萘基异氰酸酯5 mL置于500 mL容量瓶中,加CH2Cl2稀释、定容至刻度,摇匀即得10 μL/mL的1-萘基异氰酸酯溶液,于4 ℃冰箱中保存,备用。
1.5.4 样品处理取空白灌流液100 μL,加入CH2Cl2 1 mL,旋涡振荡3 min,9 100×g离心10 min,收集下层溶液,加入浓度为10 μL/mL的1-萘基异氰酸酯溶液50 μL,40 ℃反应60 min,氮气吹干,加1 mL甲醇复溶,进样分析。
1.6 方法学考察 1.6.1 专属性分别取空白灌流液、含CB的灌流液、经单向灌流后的样品液,按1.5.4项下方法处理,进样分析,考察专属性。
1.6.2 标准曲线取空白灌流液100 μL,分别加入系列CB对照品溶液100 μL,得到含CB浓度分别为0.5、1、3、5、8、10、20 μg/mL的标准样品溶液,按1.5.4项下方法处理后在1.5.1项色谱条件下分别进样分析,记录色谱图。以CB峰面积(A)对CB浓度(C)进行线性回归。
1.6.3 精密度取空白灌流液100 μL,分别加入系列CB对照品溶液100 μL,配制成低、中、高3个浓度(1.0、5.0、10.0 μg/mL)的标准样品溶液各5份,按1.5.4项下方法处理后进样分析。分别在同一天内测定并连续测定5 d,考察日内和日间精密度。
1.6.4 回收率取空白灌流液100 μL,分别加入系列CB对照品溶液100 μL,配制成低、中、高3个浓度(1.0、5.0、10.0 µg/mL)的标准样品溶液各5份,按1.5.4项下方法处理后进样分析,计算回收率。
1.7 肠灌流液的配制Krebs-Ringer小肠营养液配制:分别称取NaCl 6.92 g、KCl 0.35 g、KH2PO4 0.16 g、NaHCO3 2.1 g、葡萄糖2.0 g、MgSO4 • 7H2O 0.29 g于干燥洁净的烧杯中,加入适量蒸馏水溶解,转入1 000 mL容量瓶中;称取CaCl2 0.35 g于干燥洁净的烧杯中,加入适量蒸馏水溶解后转入上述同一1 000 mL容量瓶中混匀,定容,即得Krebs-Ringer液,放入4 ℃冰箱中备用。
生理盐水配制:精密量取NaCl 9 g,加入少量蒸馏水溶解后,转入1 000 mL容量瓶中,加入蒸馏水并定容至刻度。
3.5%水合氯醛溶液配制:精密称取水合氯醛0.35 g于100 mL容量瓶中,加入蒸馏水溶解并定容至刻度。
0.5% CMC-Na溶液配制:称取0.5 g CMC-Na,先加入50 mL蒸馏水加热溶解,待其冷却后转移至100 mL容量瓶中定容至刻度。
CB循环储备液配制:精密称取CB 25.25 mg,先用20 mL 0.5% CMC-Na溶液充分混匀后转移至250 mL容量瓶中,用Krebs-Ringer液稀释定容至刻度,即得质量浓度为101 µg/mL的CB储备液。
CBHD循环储备液配制:取约10.1 mL CBHD制剂(浓度为2.5 mg/mL),加入Krebs-Ringer液稀释并定容至250 mL,即得质量浓度为101 µg/mL的储备液。
KET储备液配制:精密称取KET 40 mg,加入Krebs-Ringer液溶解并定容至25 mL,配制成质量浓度为1.6 mg/mL的KET储备液。
CB循环液配制:精密称取CB 25 mg,先加入20 mL 0.5 % CMC-Na溶液充分溶解、混匀后转移至250 mL容量瓶中,用Krebs-Ringer液稀释定容至刻度,即得质量浓度为100 µg/mL的CB循环液。
CBHD循环液配制:取约6.25 mL的CBHD制剂(浓度为4 mg/mL),用Krebs-Ringer液稀释并定容至250 mL,即得质量浓度为100 µg/mL的CBHD循环液。
KET+CB循环液和KET+CBHD循环液配制:分别精密量取KET储备液2.5 mL加入250 mL CB、CBHD储备液中,充分混合即得KET+CB、KET+CBHD循环液(CB和CBHD质量浓度均为100 µg/mL,KET质量浓度为16 µg/mL)。
1.8 大鼠肠灌流实验[8-9]实验前动物禁食18 h,不禁水,用3.5%水合氯醛腹腔注射麻醉并固定。沿腹中线切开腹腔约3 cm,在待测肠段的上端和下端分别剪一个小口,插管结扎,用37 ℃生理盐水将肠内容物冲洗干净,再用空气排出生理盐水,并用水浴恒温至37 ℃的空白Krebs-Ringer液以0.25 mL/min流速循环15 min,取样2 mL作为空白。再用空气排出Krebs-Ringer液,换用含药循环液(每肠段15 mL),在灌流液进入肠段时计为0 min,并调节流速至0.25 mL/min,灌流60 min,收集灌流液并测量记录各肠段的流出液体积,待测。测量并记录大鼠各肠段的长度(L)和内径(r),计算药物吸收速率常数(Ka)、有效渗透率(Peff):Ka= Q+(1-CoutVout /CinVin)/ πr2L;Peff =Q+ln(CinVin/CoutVout)/2πrL。其中Vin和Vout分别为每60 min肠道灌入液和流出液的体积(假设灌流液密度为1 g/mL),Cin和Cout分别为肠道灌入液和流出液的浓度,Q为灌流速度。
1.9 统计学处理应用SPSS 18.0软件进行统计学分析。数据以x±s表示,组间比较采用两独立样本比较的t检验。检验水准(α)为0.05。
2 结果 2.1 方法学实验结果在1.5.1项色谱条件下进样分析。CB的HPLC谱图如图 1所示,CB峰形对称,保留时间为8.5 min,大鼠肠液中杂质均不干扰测定,所建立的分析方法专属性强。建立的标准曲线回归方程为A=106.7 C+41.861(R2=0.999 08),表明CB在0.5~20.0 μg/mL范围内具有良好的线性。低、中、高3个浓度样品溶液的日内精密度分别为2.25%、2.44%、3.04%,日间精密度分别为4.22%、2.00%、2.50%,精密度符合方法学要求。低、中、高3个浓度样品溶液的回收率分别为99.08%、98.24%、97.25%,符合方法学要求。
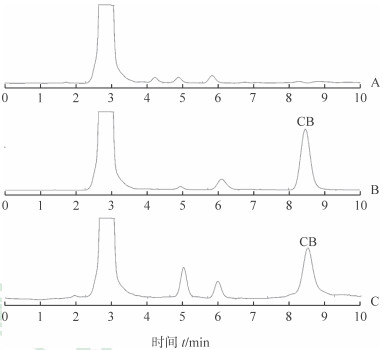
|
图 1 CB的HPLC谱图 A:空白灌流液; B:空白灌流液加CB标准品; C:灌流后样品液. CB:环维黄杨星D; HPLC:高效液相色谱 |
2.2 在体肠吸收评价
CB、CBHD以及加入KET后的CB和CBHD在各个肠段的吸收情况如图 2所示。CBHD在十二指肠、空肠、回肠、结肠的Ka分别为CB的2.77、1.98、1.02、1.21倍,Peff分别为CB的3.01、2.06、1.02、1.22倍。加入CYP450抑制剂KET后,CBHD在十二指肠、空肠、回肠、结肠的Ka分别为CB的4.18、5.05、1.91、2.85倍(P<0.05),Peff分别为CB的4.92、5.98、2.19、3.24倍(P<0.05)。表明CBHD可改善CB在各肠段的吸收情况;加入KET后,CB在各肠段的吸收均提高,说明KET可促进CB在肠道的吸收。
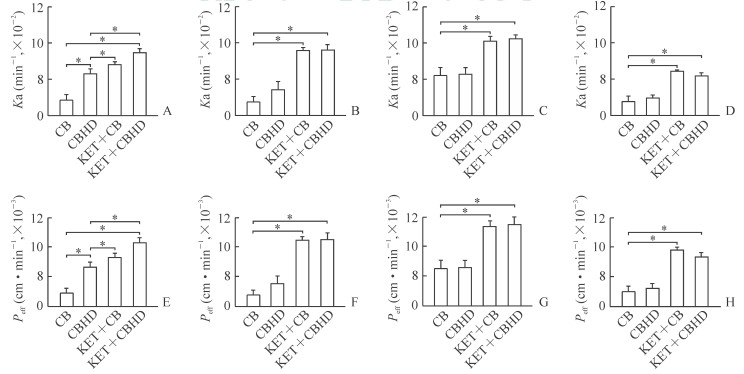
|
图 2 大鼠各肠段的吸收速率常数(Ka,A ~ D)和有效渗透率(Peff,E ~ H) A, E:十二指肠; B, F:空肠; C, G:回肠; D, H:结肠. CB:环维黄杨星D; CBHD:环维黄杨星D羟丙基-β-环糊精包合物; KET:酮康唑. *P<0.05. n=6, x±s |
3 讨论
本研究采用单向肠灌流法考察CB在大鼠各肠段的吸收情况。单向灌流是在体肠灌流法中的一种,是通过测定药物经肠段后灌流液损失的量而计算药物渗透系数的方法,其不仅操作简便,还能保证肠道神经的完整性及体液的供应,所得指标更加真实,对肠黏膜损伤较小[10]。
从实验结果看,CBHD与CB在十二指肠、空肠、回肠和结肠4个肠段均有吸收。且将CB制备成CBHD后能提高CB的吸收,在十二指肠差异有统计学意义(P<0.05),在其他肠段的差异无统计学意义,CBHD与CB的Ka之比与Peff之比都是十二指肠>空肠>结肠>回肠。加入CYP450抑制剂KET后,CBHD在各肠段的吸收较CB提高(P<0.05),KET+CBHD促进空肠吸收的作用大于十二指肠、回肠和结肠,且在空肠部分的Ka与Peff分别为游离CB的5.05和5.98倍。
加入KET可提高CB和CBHD在大鼠各肠段的吸收。CYP3A4占肠道P450酶系总量的70%,是肠道分布最多的P450亚酶体系,通过抑制CYP3A4可能减慢CB的代谢速率。由于CYP3A4阳性抑制剂KET的存在抑制了CYP450酶的活性[11],从而使CB在肠内需要CYP450酶参与的Ⅰ相代谢反应(氧化、还原、水解反应)过程减慢,促进了CB在各肠段的吸收。
本研究应用大鼠小肠在体单向肠灌流模型考察KET对CB在体肠吸收的影响,提示CYP3A4作用可能是导致CB口服生物利用度降低的原因。本研究通过对CB的肠道吸收特征的研究,为以提高CB口服生物利用度为目的的剂型改造提供了一定的实验依据。
| [1] | WU J, TAN Z, CHEN J, DONG C. Cyclovirobuxine D inhibits cell proliferation and induces mitochondriamediated apoptosis in human gastric cancer cells[J]. Molecules, 2015, 20: 20659–20668. DOI: 10.3390/molecules201119729 |
| [2] | 胡江波, 杨林, 王红, 赵德璋, 张景勍. 高效液相色谱法测定环维黄杨星D脂质体的含量[J]. 激光杂志, 2014, 35: 112–113. |
| [3] |
陈静, 张景勍, 何丹, 王红, 雷婷婷, 蒋心惠. 环维黄杨星D磷脂复合物药代动力学评价[J]. 第二军医大学学报, 2016, 37: 17–21.
CHEN J, ZHANG J Q, HE D, WANG H, LEI T T, JIANG X H. Pharmacokinetics evaluation of cyclovirobuxine D phospholipid complex[J]. Acad J Sec Mil Med Univ, 2016, 37: 17–21. |
| [4] | 卜明华, 郑咏秋, 张颖, 李利群, 刘建勋, 刘东春. 参麦注射液和注射用血塞通对大鼠肝脏及肠道药物代谢酶CYP450的影响[J]. 中国临床药理学杂志, 2012, 28: 49–52. DOI: 10.3969/j.issn.1001-6821.2012.01.016 |
| [5] | 侯健, 孙娥, 宋捷, 杨蕾, 张振海, 宁青, 等. 肝脏药物代谢酶CYP450与中药肝毒性的关系[J]. 中国中药杂志, 2016, 41: 2774–2780. |
| [6] | 于敏, 张双庆, 闻镍, 李佐刚. 细胞色素P450酶系体外药物代谢研究方法进展[J]. 中国药事, 2013, 27: 81–87. DOI: 10.3969/j.issn.1002-7777.2013.01.020 |
| [7] | 陈静, 张景勍, 赵华, 王红, 孙全, 袁誉铭, 等. 环维黄杨星D羟丙基-β-环糊精包合物理化性质与大鼠口服生物利用度[J]. 重庆医科大学学报, 2017, 42: 200–204. |
| [8] |
钟萌, 杨林, 杨梅, 胡雪原, 张景勍. 单向灌流法研究阿奇霉素泡囊的大鼠在体肠吸收[J]. 第二军医大学学报, 2014, 35: 419–422.
ZHONG M, YANG L, YANG M, HU X Y, ZHANG J Q. Single-pass intestinal perfusion for studying intestinal absorption of azithromycin niosomes in rats[J]. Acad J Sec Mil Med Univ, 2014, 35: 419–422. |
| [9] | WAN K, SUN L, HU X, YAN Z, ZHANG Y, ZHANG X, et al. Novel nanoemulsion based lipid nanosystems for favorable in vitro and in vivo characteristics of curcumin[J]. Int J Pharm, 2016, 504: 80–88. DOI: 10.1016/j.ijpharm.2016.03.055 |
| [10] | 沈芸, 徐蓓蕾, 杨新宇, 季宇彬. 三种研究药物肠道吸收机制的方法[J]. 哈尔滨商业大学学报(自然科学版), 2016, 32: 11–13. DOI: 10.3969/j.issn.1672-0946.2016.01.003 |
| [11] | 朱倩, 李俊, 汤文建. 中药对细胞色素P450酶活性影响及研究方法进展[J]. 安徽医药, 2013, 17: 1457–1461. DOI: 10.3969/j.issn.1009-6469.2013.09.001 |
 2018, Vol. 39
2018, Vol. 39


