非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是指无过量酗酒史而出现以肝脏细胞脂肪变性和脂肪贮积为特征的临床病理综合征,主要包括非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎和非酒精性脂肪性肝炎相关性肝硬化。随着社会生活水平的提高和饮食结构的改善,其发病率逐年升高且呈低龄化趋势[1]。目前临床用于治疗NAFLD的药物主要是他汀类药物,但动物实验表明,其在改善NAFLD的脂代谢的同时可使血脂更集中于肝脏代谢,反而加重了对肝功能的损害[2]。因此,目前对NAFLD的治疗仍缺乏有效手段。随着传统医药的发展,近年来我国中草药治疗NAFLD逐渐引起了人们的关注。
黄芪多糖(astragalus polysaccharides,APS)是从中药黄芪干燥根中提取的大分子多糖成分,具有免疫调节、抗肿瘤、抗衰老等功效。有研究显示,APS能调节高脂血症大鼠和NAFLD大鼠的血脂水平[3-4],但缺乏进一步的机制研究。研究发现APS注射液能通过降低肝脏的炎性反应治疗NAFLD模型大鼠[5]。近年来有研究显示氧化应激可能与NAFLD的发生密切相关[6],然而APS通过抗氧化途径治疗NAFLD的报道很少。本实验拟通过高脂饮食诱导NAFLD大鼠模型观察APS的治疗作用,并通过抗氧化途径探讨APS对NAFLD大鼠的治疗机制。
1 材料和方法 1.1 试剂与仪器APS(批号:RL20150412,西安瑞林生物科技有限公司)是从陕西黄芪[Astragalus membranaceus (Fisch.) Bge. Shaanxi]中采用超声波水提的方法获得,紫外分光光度法检测其总多糖含量为70%。辛伐他汀片(20 mg/片,批号:M004168,杭州默沙东制药有限公司)。药物配制(日剂量):取辛伐他汀片0.4 g、APS颗粒5.84 g分别溶于19.14 mL、19.2 mL双蒸水中配制成混悬液。
血糖检测试剂盒、总胆固醇(total cholesterol,TC)检测试剂盒、三酰甘油(triglyceride,TG)检测试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol,HDL-C)检测试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)检测试剂盒、丙氨酸转氨酶(alanine aminotransferase,ALT)检测试剂盒、天冬氨酸转氨酶(aspartate transaminase,AST)检测试剂盒均购于深圳迈瑞生物医疗电子股份有限公司。丙二醛(malondialdehyde,MDA)检测试剂盒和总超氧化物歧化酶(total superoxide dismutase,T-SOD)检测试剂盒均购于南京建成生物工程研究所。BS-180型全自动生化分析仪购于深圳迈瑞生物医疗电子股份有限公司,AA63/UV1800型紫外可见分光光度计购于上海棱光技术有限公司。
1.2 实验动物与分组36只无特定病原体级雄性SD大鼠,8周龄,体质量为195~200 g,随机分为正常对照组(8只)和疾病模型组(28只)。疾病模型组大鼠采用高脂饲料喂养6周后,随机选取3只取其肝脏行病理切片观察。单位面积超过1/3的肝细胞发生脂肪变性且肝细胞明显肿大则判定NAFLD大鼠模型构建成功[7]。造模成功后,将25只NAFLD大鼠再随机分为NAFLD模型组(7只)、辛伐他汀组(9只)和APS组(9只)。辛伐他汀组和APS组大鼠分别每天灌胃给予辛伐他汀6.7 mg/kg(按临床剂量每天40 mg/60 kg折算,并结合预实验结果和文献[8]确定)和APS 700 mg/kg(结合预实验结果和文献[9]确定),正常对照组和NAFLD模型组大鼠给予相同体积双蒸水灌胃,连续灌胃8周。实验期间,每3 d测1次体质量和饮食量,每2 d测1次饮水量和排泄量。大鼠实验获得广东药科大学实验动物伦理委员会授权,实验动物由广东药科大学实验动物中心提供[实验动物使用许可证号:SYXK(粤)2012-0125],饲养环境:温度为22~25 ℃,相对湿度为60%~70%,光照周期为12 h:12 h。
1.3 标本采集与处理大鼠连续灌胃8周后,禁食12 h,称体质量;随后用乙醚麻醉大鼠,眼眶取血2 mL,将血液标本于室温静置2 h,600×g离心15 min,取血清于-80 ℃保存备用。取血后处死大鼠,取肝脏和脾脏组织称质量并拍照,计算肝脏指数和脾脏指数,肝脏或脾脏指数(%)=(肝或脾质量/体质量)×100%。将肝脏组织分成2份,1份置于4%的多聚甲醛溶液中固定,另1份和脾脏组织一起直接用液氮速冻后于-80 ℃保存。
1.4 大鼠血清指标测定用BS-180型全自动生化分析仪测定大鼠血清中葡萄糖、TC、TG、HDL-C、LDL-C的含量及ALT和AST的活性,MDA含量的检测采用硫代巴比妥酸法,T-SOD活性的测定采用羟胺法。操作方法均严格按照试剂盒说明和仪器操作说明进行。
1.5 大鼠肝组织中TC、TG含量测定取-80 ℃保存的大鼠肝组织进行匀浆,4 ℃、9 500×g离心10 min,取上清液,按试剂盒操作说明测定肝组织中TC和TG的含量。
1.6 大鼠肝组织结构与形态学观察取4%多聚甲醛溶液固定的大鼠肝脏组织,经脱水、石蜡包埋、切片和展片处理后,行常规H-E染色,于光学显微镜下观察肝组织结构和肝细胞形态。
1.7 大鼠肝细胞脂肪变性等级评价各组取7只大鼠的组织病理切片,每张组织病理切片随机选取5个视野观察并计数,取平均值,评价肝细胞脂滴数目、脂滴面积和脂肪变性程度。肝细胞脂肪变性分级参照文献[10]提出的评价方法:+表示脂肪变性程度≤25%,++表示脂肪变性程度>25%但≤50%,+++表示脂肪变性程度>50%但≤75%,++++表示脂肪变性程度>75%;计分依次为1~4分。
1.8 统计学处理采用ImageJ和Eviews 8.0软件计算肝细胞脂滴数目和面积。应用SPSS 17.0软件对实验数据进行统计学分析。服从正态分布的计量资料以x±s表示,两组间比较采用非配对t检验;等级资料用例数表示,组间比较采用秩和检验。统计结果使用Origin 9.0软件绘图。检验水准(α)为0.05。
2 结果 2.1 APS对NAFLD大鼠日常指标的影响NAFLD模型组大鼠的能量摄入量高于正常对照组(t=4.599,P<0.05),饮食量、饮水量和排泄量均低于正常对照组(t=3.020、2.157、2.602,P均<0.05)。辛伐他汀组和APS组大鼠的饮食量、能量摄入量、饮水量和排泄量与模型组相比差异均无统计学意义,且辛伐他汀组和APS组比较差异也无统计学意义(P均>0.05)。见表 1。
|
|
表 1 各组大鼠血清生物化学指标的比较 |
2.2 APS对NAFLD大鼠血清生物化学指标的影响
NAFLD模型组大鼠血清中TC、TG、LDL-C和MDA含量以及ALT、AST和T-SOD活性均高于正常对照组,且差异有统计学意义(t=2.823、2.899、5.975、3.607、8.243、3.582、2.568,P均<0.05),血清中HDL-C含量低于正常对照组且差异有统计学意义(t=4.051,P<0.05)。与NAFLD模型组相比,辛伐他汀组和APS组大鼠血清中TC、TG、LDL-C和MDA含量以及T-SOD活性均降低,且差异均有统计学意义(t辛伐他汀组=2.320、2.262、4.727、2.743、2.503,tAPS组=2.677、2.405、5.615、3.102、3.452;P均<0.05),血清中HDL-C含量均增加且差异有统计学意义(t辛伐他汀组=2.203,tAPS组=2.128;P均<0.05),但辛伐他汀组和APS组比较差异均无统计学意义(P均>0.05)。与NAFLD模型组相比,APS可降低NAFLD大鼠血清中葡萄糖含量和ALT、AST活性,差异均有统计学意义(t=2.536、2.752、5.356,P均<0.05),而辛伐他汀组与NAFLD模型组比较差异均无统计学意义(P均>0.05)。见表 2。
|
|
表 2 各组大鼠血清生物化学指标的比较 |
2.3 APS对NAFLD大鼠肝脏形态和肝脏、脾脏指数以及肝组织中TC、TG含量的影响
肝脏形态学观察结果如图 1所示。正常对照组大鼠肝脏无异常,色泽鲜红;NAFLD模型组大鼠肝脏质量增加,边缘圆钝,表面呈白色糜烂状,属典型的肝细胞脂肪变性;辛伐他汀组和APS组大鼠肝脏色泽由白色向鲜红色变化。与正常对照组相比,NAFLD模型组大鼠体质量和肝脏指数均增加,且差异均有统计学意义(t=5.376、13.504,P均<0.05);与NAFLD模型组相比,辛伐他汀组和APS组大鼠体质量和肝脏指数均下降,且差异均有统计学意义(t辛伐他汀组=2.478、3.272,tAPS组=4.651、2.799;P均<0.05);各组大鼠的脾脏指数差异均无统计学意义(P均>0.05)。见表 3。
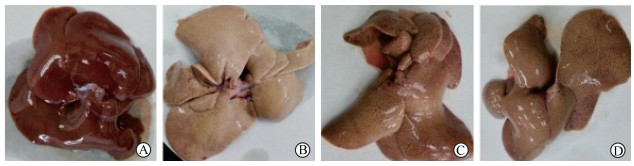
|
图 1 各组大鼠肝脏形态图 A:正常对照组; B: NAFLD模型组; C:辛伐他汀组; D: APS组. NAFLD:非酒精性脂肪肝病; APS:黄芪多糖 |
|
|
表 3 各组大鼠肝脏、脾脏指数和肝组织中TC和TG含量比较 |
与正常对照组相比,NAFLD模型组大鼠肝组织中TC和TG含量均升高,且差异均有统计学意义(t=6.027、7.164,P均<0.05);与NAFLD模型组比,辛伐他汀组和APS组大鼠肝组织中TC和TG含量均下降,且差异均有统计学意义(t辛伐他汀组=4.801、3.769,tAPS组=4.326、4.021;P均<0.05),但辛伐他汀组和APS组比较差异均无统计学意义(P均>0.05)。见表 3。
2.4 APS对NAFLD大鼠肝细胞中脂滴数目和脂滴面积的影响正常对照组大鼠肝小叶结构清晰完整,肝细胞呈放射性索状,无空泡化;NAFLD模型组大鼠肝脏组织呈现明显的病理性形态学,肝小叶轮廓不清,细胞内空泡化严重,细胞核固缩,呈炎性侵染;辛伐他汀组和APS组大鼠肝脏组织的病理性形态学相比NAFLD模型组有不同程度改善,细胞内空泡化明显改善(图 2)。与正常对照组相比,NAFLD模型组大鼠肝细胞内脂滴数目和脂滴面积均增加(t=13.822、15.372,P均<0.05);与NAFLD模型组比较,辛伐他汀组和APS组大鼠肝细胞内脂滴数目和脂滴面积均减少(t辛伐他汀组=6.882、5.470,tAPS组=7.360、7.177;P均<0.05),且APS组比辛伐他丁组降低程度大,但两组间差异无统计学意义(P>0.05)。见图 3。
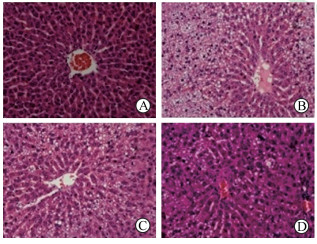
|
图 2 各组大鼠肝组织细胞形态学变化 A:正常对照组; B: NAFLD模型组; C:辛伐他汀组; D: APS组. NAFLD:非酒精性脂肪肝病; APS:黄芪多糖. H-E染色. Original magnification: ×200 |
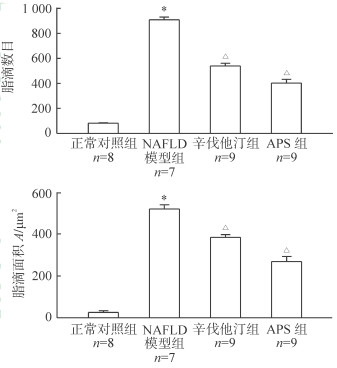
|
图 3 各组大鼠单位视野肝细胞内脂滴数目和脂滴面积的比较 NAFLD:非酒精性脂肪肝病; APS:黄芪多糖. *P<0.05与正常对照组比较; △P<0.05与NAFLD模型组比较. x±s |
2.5 APS对NAFLD大鼠肝细胞脂肪变性程度的影响
各组大鼠肝细胞脂肪变性程度见表 4。NAFLD模型组大鼠肝细胞病变程度评分高于正常对照组,差异有统计学意义(Z=21.376,P<0.05);与NAFLD模型组比,辛伐他汀组和APS组肝细胞脂肪变性程度评分均降低,且差异均有统计学意义(Z=8.947、9.701;P均<0.05),但辛伐他汀组与APS组比较差异无统计学意义(P>0.05)。
|
|
表 4 各组大鼠肝细胞脂肪变性程度比较 |
3 讨论
NAFLD的致病因素复杂,高脂血症是主要病因之一,其发病机制可能是由于血TC、TG等含量上升诱发高脂血症,增加肝细胞线粒体β氧化,产生大量活性氧触发链式过氧化反应,形成过氧化脂,导致中性粒细胞炎性浸润、蛋白酶分泌增加,最终导致NAFLD发生[11]。可见,氧化损伤是引起NAFLD的首要原因。MDA是脂质过氧化反应的最终产物,过多的MDA会降低体内超氧化物歧化酶(superoxide dismutase,SOD)的活性,导致机体清除氧自由基的能力下降,加重机体组织、细胞损伤[11]。因此,测定MDA含量和SOD活性常可反映机体内脂质过氧化程度,间接反映肝细胞受损程度。黄芪是常见的益气中药,具有抗氧化作用,APS是从黄芪中提取的主要有效成分,能清除活性自由基、提高SOD的活性、有效抗脂质过氧化[12]。本研究结果显示,APS不仅能降低NAFLD模型组大鼠血脂和MDA含量、提高T-SOD活性,还能降低NAFLD模型组大鼠血清中葡萄糖和肝组织中TC和TG含量,改善肝组织形态,减少肝细胞内的脂滴数目和脂滴面积,改善肝组织脂肪变性程度。上述结果提示APS可通过提高NAFLD大鼠的抗氧化能力改善大鼠糖脂代谢水平,从而治疗NAFLD。
长期严重的NAFLD会损伤肝脏,诱发肝纤维化及肝硬化[13]。因此,预防和治疗NAFLD尤为重要。他汀类药物是一种常用的降脂药物,虽然其降血脂疗效确切,但长期服用对肝脏存在一定的不良反应[2]。本实验选用辛伐他汀作为阳性对照药物,结果显示辛伐他汀虽然能降低大鼠血脂水平,但其对NAFLD大鼠血清中AST和ALT活性无明显改善效果(P>0.05);而APS不仅可改善NAFLD大鼠血脂水平,也能降低血清中AST和ALT活性。该结果表明APS在改善NAFLD的同时对肝组织有一定的保护作用。
综上所述,APS通过提高大鼠的总抗氧化能力调节NAFLD大鼠的糖脂水平、降低血清AST和ALT含量,改善肝脏脂肪变性,对NAFLD大鼠具有治疗作用。APS治疗NAFLD时不仅具有与辛伐他汀相当的降血脂作用,而且其护肝作用更优。
| [1] | 韩雪, 张凤霞. 非酒精性脂肪肝病的中西医研究进展[J]. 云南中医中药杂志, 2016, 37: 72–74. DOI: 10.3969/j.issn.1007-2349.2016.12.037 |
| [2] | 范鸿儒, 杨之娴, 王雨晴, 刘珍清. 三草水煎剂对非酒精性脂肪肝大鼠治疗作用实验研究[J]. 中华中医药学刊, 2015, 33: 865–868. |
| [3] | 童红莉, 田亚平, 汪德清, 邓心新, 董振南. 黄芪多糖对高脂血症大鼠血脂的调节[J]. 中国临床康复, 2006, 10: 68–70. |
| [4] | 唐姣玉, 刘兆辉, 杨海, 周东升. 黄芪多糖对非酒精性脂肪肝大鼠血脂的影响[J]. 黑龙江畜牧兽医, 2016, 18: 171–172. |
| [5] | 梁栋, 梁钢, 刘云峰, 杨静. 黄芪注射液对糖尿病非酒精性脂肪肝模型大鼠血糖、血脂及肝脏脂肪分化相关蛋白表达水平的影响[J]. 中西医结合心脑血管病杂志, 2014, 12: 464–465. DOI: 10.3969/j.issn.16721349.2014.04.042 |
| [6] | CHEN Z W, CHEN L Y, DAI H L, CHEN J H, FANG L Z. Relationship between alanine aminotransferase levels and metabolic syndrome in nonalcoholic fatty liver disease[J]. J Zhejiang Univ-Sci B (Biomedicine & Biotechnology), 2008, 9: 616–622. |
| [7] | 魏来, 赵春景. 番茄红素对大鼠非酒精性脂肪肝的作用研究[J]. 中国药业, 2010, 19: 3–5. |
| [8] | FAN Y, LI J, YIN Q, ZHANG Y, XU H, ZHOU C, et al. Effect of extractions from Ephedra sinica Stapf on hyperlipidemia in mice[J]. Exp Ther Med, 2015, 9: 619–625. DOI: 10.3892/etm.2014.2117 |
| [9] | CHEN W, XIA Y P, CHEN W J, YU M H, LI Y M, YE H Y. Improvement of myocardial glycolipid metabolic disorder in diabetic hamster with Astragalus polysaccharides treatment[J]. Mol Biol Rep, 2012, 39: 7609–7615. DOI: 10.1007/s11033-012-1595-y |
| [10] | 王晓旭. 防治SD大鼠非酒精性脂肪肝中药研究[D]. 大庆: 黑龙江八一农垦大学, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10223-2009223161.htm |
| [11] | 江娜, 张金华, 王湘宁, 刘志平, 徐莹. 胆宁片对高脂饮食诱导的非酒精性脂肪肝大鼠SOD、MDA的影响[J]. 中国社区医师, 2017, 33: 5–9. |
| [12] | 李孟伟, 陈清华. 自由基对动物体氧化损伤及黄芪多糖抗氧化作用的研究[J]. 饲料研究, 2014, 21: 15–17. |
| [13] | 吴小兰, 刘先洲. 脂肪肝与谷丙转氨酶、血糖及血脂的相关性分析[J]. 公共卫生与预防医学, 2007, 18: 10–12. |
 2018, Vol. 39
2018, Vol. 39


