早期自然流产是妊娠常见不良结局之一,在临床确诊的妊娠中自然流产的发生率约为15%;造成自然流产的病因有很多,包括胚胎染色异常、感染、免疫缺陷等,而其中仍有50%以上是原因不明的自然流产[1-2]。因此,阐明造成不明原因流产的因素以及不明原因流产的发生机制十分必要。
妊娠受一系列精密复杂的因素调控,其中胎盘作为一个暂时性存在的胚外器官是连接母体和胎儿的桥梁,胎盘的正常发育是胚胎存活和胎儿生长的保障[3]。滋养层细胞作为胎盘的主要组成,在胎盘发育过程中扮演着重要角色,其参与了胚胎着床、启动胎盘形成,以及调控血管分化、内分泌和免疫保护等过程。若滋养层细胞发育或功能异常,则会导致早期妊娠失败或妊娠相关疾病发生[4-5]。因此深入了解调控滋养层细胞分化和功能的相关调节机制将为解释妊娠相关疾病的发生提供重要理论支持。
Ras相关C3肉毒杆菌毒素底物3(ras-related C3 botulinum toxin substrate 3,RAC3)基因位于17号染色体,是Rho-GTPase超家族成员之一,该家族成员参与调控细胞生长、细胞骨架重组和蛋白激酶激活等多个细胞事件,有关Rho-GTPase家族与肿瘤发生和肿瘤细胞增殖、迁移及侵袭关系的研究被广泛报道[6]。目前研究发现RAC3在多种组织中高表达[7],尤其是在肿瘤组织中,其参与调控肺癌、乳腺癌、前列腺癌及卵巢癌等的发生、发展,调控肿瘤细胞的增殖、凋亡和迁移、侵袭等[8-9]。滋养层细胞的生物学特性与肿瘤细胞之间存在相似性,具有高度的增殖、侵袭及迁移能力[10],这些功能的正常行使为胎盘形成和维持胎儿发育生长所必需,因此本研究旨在明确RAC3在早期胎盘发育中是否也起着重要的调控作用。本研究通过观察RAC3在早期流产人绒毛组织中的表达及其对滋养层细胞增殖、迁移及侵袭的作用,探讨RAC3对早期胎盘发育中滋养层细胞功能的影响。
1 材料和方法 1.1 人绒毛组织样本采集与处理自然流产组:2015年5月至2016年5月在海军军医大学(第二军医大学)长征医院门诊或住院流产的患者20例,妊娠6~12周,经B超检查确诊为胚胎宫内死亡尚未自然排出且病因不明。人工流产组:同期在医院门诊自愿要求行人工流产终止妊娠的健康妇女20名,均无死胎、死产、自然流产史,本次妊娠期间无先兆流产症状和体征,B超检查显示胚胎发育正常,无用药、感染以及放射线接触史。两组年龄差异无统计学意义[(29.1±1.37)岁vs(32.2±1.13)岁,P>0.05]。采集两组的绒毛组织,经生理盐水漂洗后,装入液氮罐保存。
1.2 小鼠胎盘组织芯片检测实验动物选择C57/B6小鼠,选取经阴道分泌物检测证实处于发情期的雌性小鼠以3:1(雌:雄)比例合笼,第2天早晨检查小鼠阴道精栓,阴栓阳性的单独饲养,标记为孕0.5 d(E0.5 d)。于孕6.5、14.5和19.5 d获取小鼠胎盘组织用于mRNA芯片检测,mRNA芯片检测委托上海康成生物工程有限公司完成,每个时间点重复检测3只小鼠,取平均值。
1.3 细胞培养与转染选用人早期绒毛外滋养层细胞(extravillous trophoblast,EVT)HTR-8/SVneo(复旦大学附属妇产科医院李大金教授惠赠),培养体系为含10%胎牛血清(美国Gibco公司)和1‰青-链霉素(美国Hyclone公司)的DMEM/F-12培养液(美国Hyclone公司),置于37 ℃、5% CO2的恒温箱中培养。转染RAC3小干扰RNA(small interfering RNA,siRNA)和过表达质粒前将细胞接种于6孔板培养备用,待细胞贴壁生长至70%~80%融合后,按照转染试剂说明书进行转染,用Lipofectamine 3000(美国Invitrogen公司)分别转染siRNA和过表达质粒进入HTR-8/SVneo细胞,并设置对照组,培养48 h后收取细胞,应用qPCR法检测干扰和过表达效率。siRNA及过表达质粒购于广州复能基因有限公司,其中siRNA-1序列为5′-AGA CUC CUU AGG ACC GCU UdTdT-3′,siRNA-2序列为5′-CUG ACG UCU UUC UGA UCU GdTdT-3′。
1.4 RNA提取和qPCR应用TRIzol试剂盒(美国Invitrogen公司)提取人绒毛组织中以及细胞中的总RNA,测定RNA浓度后用反转录试剂盒(日本TaKaRa公司)将RNA反转录成cDNA。选用SYBR Green PCR试剂盒(日本TaKaRa公司)进行qPCR。引物序列如下:RAC3上游5′-CTC CAA AGT CAT CGT CCG GTT-3′,下游5′-TGA GTT GCA CGT CAA ATC TGG-3′;内参基因β-actin上游5′-CAT CCG TAA AGA CCT CTA TGC CAA C-3′,下游5′-ATG GAG CCA CCG ATC CAC A-3′。PCR反应条件:95 ℃预变性3 min;95 ℃变性15 s、60 ℃退火15 s、72 ℃延伸20 s,共40个循环。反应结束后进行熔解曲线和扩增曲线分析。分析样本的ΔΔCt值及RQ值,根据RQ值计算RAC3的表达量。为减少实验中加样误差,实验中设置3个复孔,计算时取其平均值。
1.5 细胞增殖能力检测应用CCK-8试剂(日本同仁公司)检测HTR-8/SVneo细胞的增殖能力。将转染siRNA或过表达质粒后的HTR-8/SVneo细胞用胰酶消化并重悬,调整细胞密度为5 000/mL后接种于96孔板,每孔加入细胞悬液100 μL。每组设5个复孔,分别于12、24、36、48和72 h时检测细胞生长情况,检测前每孔加入10 μL CCK-8试剂,孵箱中孵育2 h后用酶标仪检测450 nm波长处的光密度(D)值。每组实验重复3次。
1.6 细胞迁移、侵袭能力检测细胞迁移实验:转染siRNA或过表达质粒后的HTR-8/SVneo细胞培养48 h,胰酶消化,用无血清培养液重悬,调整细胞密度为5×105/mL,于Transwell小室上层(8 µm,美国Corning公司)加入25 μL细胞悬液,将小室置于24孔板中,小室外加入800 μL含10%胎牛血清的培养液,置于孵箱中培养24 h后,用棉签擦去小室上层细胞,然后将小室放入0.1%多聚甲醛溶液中固定,固定后用结晶紫染液染色。于光学显微镜下观察迁移细胞个数,每组随机选取5个视野,计算迁移细胞平均个数。细胞侵袭实验:选取带基质胶的小室(8 µm,美国Corning公司),实验方法同细胞迁移实验。每组实验重复3次。
1.7 统计学处理应用GraphPad Prism 5.0软件进行数据分析并制图,呈正态分布的计量资料以x±s表示,两组间比较采用Student’s t检验。检验水准(α)为0.05。
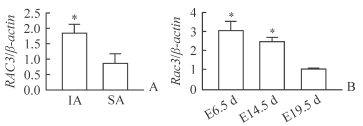
2 结果 2.1 自然流产、人工流产人绒毛组织中RAC3 mRNA和小鼠胎盘组织中Rac3 mRNA的表达mRNA芯片分析结果显示,与人正常妊娠早期人工流产绒毛组织相比,人妊娠早期不明原因自然流产绒毛组织中RAC3 mRNA的表达下调(P<0.05,图 1A);小鼠胎盘组织中Rac3 mRNA在胎盘发育孕6.5、14.5 d的表达高于孕19.5 d(P均<0.05,图 1B)。
|
图 1 自然流产、人工流产人绒毛组织中RAC3 mRNA和小鼠胎盘组织中Rac3 mRNA的表达 Fig 1 mRNA expressions of RAC3 in human villus tissues of SA and IA and Rac3 in mouse placental tissues A: Expression of RAC3 mRNA in human villus tissues of SA and IA by qPCR (*P < 0.05 vs SA. n=20, x±s); B: Expression of Rac3 mRNA in mouse placental tissues by qPCR (*P < 0.05 vs E19.5 d. n=3, x±s). SA: Spontaneous abortion; IA: Induced abortion; E6.5 d: Embryonic day 6.5; E14.5 d: Embryonic day 14.5; E19.5 d: Embryonic day 19.5 |
2.2 下调RAC3表达抑制HTR-8/SVneo细胞的增殖能力
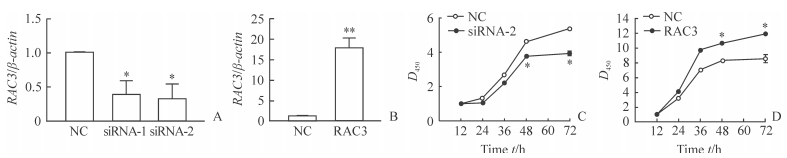
经siRNA-1和siRNA-2干扰后HTR-8/SVneo细胞中RAC3 mRNA表达减弱,与对照组相比下降超过50%(P<0.05,图 2A);转染过表达RAC3质粒的细胞中RAC3 mRNA表达升高,超过对照组约15倍(P<0.01,图 2B)。CCK-8法检测结果显示,干扰RAC3(siRNA-2)表达48 h和72 h后HTR-8/SVneo细胞的增殖能力较同时间点对照组降低(P<0.05,图 2C),而过表达RAC3后HTR-8/SVneo细胞的增殖能力增加(P<0.05,图 2D)。结果表明RAC3与滋养层细胞HTR-8/SVneo的增殖能力有关,下调其表达会减弱HTR-8/SVneo细胞的增殖能力。
|
图 2 HTR-8/SVneo细胞中RAC3干扰效率和过表达结果及RAC3对HTR-8/SVneo细胞增殖能力的影响 Fig 2 Interference efficiency and overexpression of RAC3 in HTR-8/SVneo cells and effects of RAC3 on proliferation of HTR-8/SVneo cells A, B: Expression of RAC3 mRNA in the HTR-8/SVneo cells transfected with siRNA (A) or overexpressed plasmid (B) by qPCR; C, D: Effects of down-regulated (C) and up-regulated (D) expressions of RAC3 on proliferation of HTR-8/SVneo cells by CCK-8 assay. NC: Normal control; siRNA: Small interfering RNA. *P < 0.05, **P < 0.01 vs NC group. n=3, x±s |
2.3 下调RAC3表达抑制HTR-8/SVneo细胞的迁移和侵袭能力
与对照组相比,干扰RAC3表达后HTR-8/SVneo细胞的迁移和侵袭能力均减弱(P<0.05,图 3A),过表达RAC3后HTR-8/SVneo细胞的迁移和侵袭能力增强(P<0.05,图 3B)。结果表明,RAC3可能影响滋养层细胞HTR-8/SVneo的迁移和侵袭能力,从而影响滋养层细胞及胎盘的正常生长发育和功能。

|
图 3 下调(A)或过表达(B) RAC3对HTR8-/SVneo细胞迁移和侵袭能力的影响 Fig 3 Effects of down-regulation (A) or up-regulation (B) of RAC3 on migration and invasion of HTR8-/SVneo cells NC: Normal control; siRNA: Small interfering RNA. Original magnification: ×100. *P < 0.05 vs NC group. n=3, x±s |
3 讨论
滋养层细胞是决定胎盘和胎儿正常生长发育的关键因素,参与连接胚胎和母体之间的物质交换以及胚胎着床和胎盘发育[11],滋养层细胞的高度增殖性和侵袭性是胚胎植入的关键,当滋养层细胞出现增殖和侵袭功能缺陷时会影响胚胎着床,引起妊娠相关疾病的发生,如胎儿宫内生长受限、子痫和流产等[12-13]。近年来有关滋养层细胞在妊娠过程中的重要作用受到关注。滋养层细胞的增殖和侵袭能力是保证胎盘正常生长发育的重要因素[14]。当滋养层细胞的增殖与凋亡之间的平衡失调时,会造成滋养层细胞功能异常,而滋养层细胞侵袭或迁移能力异常也会造成滋养层功能的缺陷,从而引起妊娠相关疾病的发生。
RAC3作为一种致癌基因,首次报道于乳腺癌中且呈高表达[15],后续相关研究证实其在许多恶性肿瘤中高度表达,调控细胞周期进展和细胞增殖、侵袭、迁移等相关基因的表达,抑制细胞凋亡、自噬和衰老,参与肿瘤的发生、发展[16-18]。而在正常组织中RAC3的表达和相关功能少有报道,有研究称RAC3能够参与保持干细胞的多能性和自我更新[19]。在正常组织或器官中,RAC3的表达在成熟或分化细胞以及衰老组织中下调[20],这些结果表明其表达水平的变化可能在发育中起关键作用。结合本研究小鼠胎盘组织mRNA芯片结果显示的Rac3在小鼠胎盘发育过程中的动态表达,推测其在胎盘发育或早期滋养层细胞中可能具有重要作用。
为了探讨RAC3在调控滋养层细胞功能中的作用,本研究选用早期EVT来源的HTR-8/SVneo细胞进行研究,通过干扰和过表达RAC3表达,探讨滋养层细胞的增殖、迁移和侵袭能力的改变。结果发现RAC3在早期不明原因自然流产人绒毛组织中表达下调,在滋养层细胞HTR-8/SVneo中干扰RAC3表达后细胞增殖能力下降,侵袭和迁移能力减弱;而在滋养层细胞中过表达RAC3后观察到相反结果。这些结果提示RAC3参与调控滋养层细胞的增殖和侵袭,表明滋养层细胞中RAC3表达下调可能会造成滋养层细胞功能缺陷,参与早期不明原因自然流产的发生。
总之,本研究发现RAC3在不明原因自然流产人绒毛组织中表达下调,RAC3表达下调后滋养层细胞的增殖、侵袭和迁移能力减弱,而上调其表达则相反。这些结果均提示RAC3在滋养层细胞的生长发育和功能行使过程中发挥重要调控作用,而RAC3表达下调可能导致滋养层细胞功能异常,这可能是发生不明原因流产的原因之一。然而RAC3参与调控滋养层细胞功能的具体机制仍需进一步探索。
| [1] | ALLISON J L, SCHUST D J. Recurrent first trimester pregnancy loss:revised definitions and novel causes[J]. Curr Opin Endocrinol Diabetes Obes, 2009, 16: 446–450. DOI: 10.1097/MED.0b013e3283327fc5 |
| [2] | LATHI R B, GRAY HAZARD F K, HEEREMA-McKENNEY A, TAYLOR J, CHUEH J T. First trimester miscarriage evaluation[J]. Semin Reprod Med, 2011, 29: 463–469. DOI: 10.1055/s-0031-1293200 |
| [3] | BAINES K J, RENAUD S J. Transcription factors that regulate trophoblast development and function[J]. Prog Mol Biol Transl Sci, 2017, 145: 39–88. DOI: 10.1016/bs.pmbts.2016.12.003 |
| [4] | PFEFFER P L, PEARTON D J. Trophoblast development[J]. Reproduction, 2012, 143: 231–246. DOI: 10.1530/REP-11-0374 |
| [5] | KNOTT J G, PAUL S. Transcriptional regulators of the trophoblast lineage in mammals with hemochorial placentation[J]. Reproduction, 2014, 148: R121–R136. DOI: 10.1530/REP-14-0072 |
| [6] | LI H, PEYROLLIER K, KILIC G, BRAKEBUSCH C. Rho GTPases and cancer[J]. Biofactors, 2014, 40: 226–235. DOI: 10.1002/biof.1155 |
| [7] | HAATAJA L, GROFFEN J, HEISTERKAMP N. Characterization of RAC3, a novel member of the Rho family[J]. J Biol Chem, 1997, 272: 20384–20388. DOI: 10.1074/jbc.272.33.20384 |
| [8] | LIU T Q, WANG G B, LI Z J, TONG X D, LIU H X. Silencing of Rac3 inhibits proliferation and induces apoptosis of human lung cancer cells[J]. Asian Pac J Cancer Prev, 2015, 16: 3061–3065. DOI: 10.7314/APJCP.2015.16.7.3061 |
| [9] | MORRIS C M, HAATAJA L, McDONALD M, GOUGH S, MARKIE D, GROFFEN J, et al. The small GTPase RAC3 gene is located within chromosome band 17q25.3 outside and telomeric of a region commonly deleted in breast and ovarian tumours[J]. Cytogenet Cell Genet, 2000, 89(18): 23. |
| [10] | MURRAY M J, LESSEY B A. Embryo implantation and tumor metastasis:common pathways of invasion and angiogenesis[J]. Semin Reprod Endocrinol, 1999, 17: 275–290. DOI: 10.1055/s-2007-1016235 |
| [11] | GUZELOGLU-KAYISLI O, BASAR M, ARICI A. Basic aspects of implantation[J]. Reprod Biomed Online, 2007, 15: 728–739. DOI: 10.1016/S1472-6483(10)60541-X |
| [12] | CASTELLUCCI M, KOSANKE G, VERDENELLI F, HUPPERTZ B, KAUFMANN P. Villous sprouting:fundamental mechanisms of human placental development[J]. Hum Reprod Update, 2000, 6: 485–494. DOI: 10.1093/humupd/6.5.485 |
| [13] | LOREGGER T, POLLHEIMER J, KNÖFLER M. Regulatory transcription factors controlling function and differentiation of human trophoblast-a review[J]. Placenta, 2003, 24(Suppl A): S104–S110. |
| [14] | UNDERHILL L A, ROBINS J C. Trophoblast development in the murine preimplantation embryo[J]. Semin Reprod Med, 2016, 34: 57–62. DOI: 10.1055/s-00000072 |
| [15] | LI H, GOMES P J, CHEN J D. RAC3, a steroid/nuclear receptor-associated coactivator that is related to SRC-1 and TIF2[J]. Proc Natl Acad Sci USA, 1997, 94: 8479–8484. DOI: 10.1073/pnas.94.16.8479 |
| [16] | ZHANG C, LIU T, WANG G, WANG H, CHE X, GAO X, et al. Rac3 regulates cell invasion, migration and EMT in lung adenocarcinoma through p38 MAPK pathway[J]. J Cancer, 2017, 8: 2511–2522. DOI: 10.7150/jca.18161 |
| [17] | COLO G P, ROSATO R R, GRANT S, COSTAS M A. RAC3 down-regulation sensitizes human chronic myeloid leukemia cells to TRAIL-induced apoptosis[J]. FEBS Lett, 2007, 581: 5075–5081. DOI: 10.1016/j.febslet.2007.09.052 |
| [18] | FERNANDEZ LARROSA P N, ALVARADO C V, RUBIO M F, RUIZ GRECCO M, MICENMACHER S, MARTINEZ-NOEL G A, et al. Nuclear receptor coactivator RAC3 inhibits autophagy[J]. Cancer Sci, 2012, 103: 2064–2071. DOI: 10.1111/cas.2012.103.issue-12 |
| [19] | CHITILIAN J M, THILLAINADESAN G, MANIAS J L, CHANG W Y, WALKER E, ISOVIC M, et al. Critical components of the pluripotency network are targets for the p300/CBP interacting protein (p/CIP) in embryonic stem cells[J]. Stem Cells, 2014, 32: 204–215. DOI: 10.1002/stem.v32.1 |
| [20] | FERNÁNDEZ LARROSA P N, RUÍZ GRECCO M, MENGUAL GÓMEZ D, ALVARADO C V, PANELO L C, RUBIO M F, et al. RAC3 more than a nuclear receptor coactivator: a key inhibitor of senescence that is downregulated in aging[J/OL]. Cell Death Dis, 2015, 6: e1902. doi: 10.1038/cddis.2015.218. |
 2018, Vol. 39
2018, Vol. 39


