在全球范围内,胃癌致死率位居所有恶性肿瘤第2位[1];在我国,胃癌发病率位居恶性肿瘤首位,且首次检出即发生淋巴结转移的比例高达50%~75%,而胃癌转移是导致胃癌患者预后不良或死亡的主要原因[2]。近年来,各种新的疗法被用于临床治疗胃癌,但是由于胃癌患者绝对数量的增加,胃癌导致的病死率依然没有得到明显控制。胃癌临床治疗以手术切除为主,术前、术后化疗为辅,但术后仍然具有较高的复发率和转移率,晚期胃癌患者5年生存率小于30%[3]。因此,研究配合手术使用的新高效化疗药物是降低胃癌术后复发的有效手段。
知母皂苷B-Ⅱ(timosaponin B-Ⅱ)为知母总皂苷的主要化学成分和活性物质,研究表明其具有抗炎[4-6]、抗抑郁[7]等作用,对于其抗肿瘤活性研究较少。我们发现知母皂苷B-Ⅱ对于胃癌细胞的增殖和迁移具有良好的抑制效果,本研究通过利用知母皂苷B-Ⅱ干预人胃癌细胞,以期初步阐明知母皂苷B-Ⅱ抑制胃癌细胞增殖和迁移的作用机制。
1 材料和方法 1.1 实验材料人胃癌细胞BGC-823、MGC-803和293工具细胞株均购于中国科学院典型培养物保藏委员会细胞库;DMEM高糖培养液、0.25%胰蛋白酶、胎牛血清(fetal bovine serum,FBS)、转染试剂Lipofectamine 3000、TRIzol试剂、反转录试剂盒(M-MLV)和qPCR检测试剂盒均购于美国Invitrogen公司;荧光素酶报告基因表达载体和荧光素酶检测试剂盒均购于美国Promega公司;清道夫受体A5 (scavenger receptor A5,SCARA5)蛋白一抗及二抗均购于英国Abcam公司;细胞总蛋白提取定量试剂盒、化学发光试剂盒均为美国Thermo公司产品;RNA和DNA合成由生工生物工程(上海)股份有限公司完成;四甲基偶氮唑盐[3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide,MTT]和二甲基亚砜(dimethyl sulphoxide,DMSO)均购于美国Sigma公司。AB0311型细胞培养箱、Multiskan MK3型酶标仪和NanoDrop 2000型紫外分光光度检测仪均为美国Thermo公司产品;电泳仪、垂直电泳槽及转膜仪购于北京六一生物科技有限公司;7500型PCR仪为美国ABI公司产品。
1.2 细胞培养BGC-823和MGC-803细胞均为贴壁生长,在含10% FBS的DMEM培养液中,37 ℃、5% CO2条件下培养至细胞贴壁密度达70%,用0.25%胰蛋白酶消化,传代培养。以DMSO为溶媒,将知母皂苷B-Ⅱ配制成50 μg/mL的母液,使用时培养液中的终浓度为50 ng/mL。
1.3 知母皂苷B-Ⅱ对BGC-823和MGC-803细胞内SCARA5基因转录及蛋白表达的影响接种对数生长期的BGC-823和MGC-803细胞至6孔培养板,每孔接种2×105个细胞,正常条件下过夜培养。使用2 mL含10% FBS的DMEM培养液对细胞全量换液,将细胞分为3组:细胞对照组、溶媒对照组和皂苷处理组。其中,皂苷处理组加入终浓度为50 ng/mL的知母皂苷B-Ⅱ [半数抑制浓度(IC50)=50 ng/mL],溶媒对照组加入1 μL的DMSO,细胞对照组不做任何处理。加药后细胞在正常条件下继续培养48 h,收集细胞,分别提取细胞总RNA和细胞总蛋白,qPCR和蛋白质印迹法分别检测各组细胞内SCARA5的mRNA和蛋白表达。
1.4 荧光素酶报告基因表达载体构建根据hsa-miRNA-766-3p与SCARA5基因3′UTR区的结合位点预测结果,设计包含结合位点且与SCARA5 3′UTR区完全同源的长链DNA,上游序列5′-CTA GAG GTT CAG AGG CTG GAG CGG TTC AGA GGC TGG AGC GGT TCA GAG GCT GGA GC-3′,下游序列5′-AGA TCG CTC CAG CCT CTG AAC CGC TCC AGC CTC TGA ACC GCT CCA GCC TCT GAA CC-3′。长链DNA经退火形成双链后克隆至荧光素酶报告基因表达载体pGL3-promoter,构建荧光素酶报告基因表达载体pGL3-WT-SCARA5(含有野生型hsa-miRNA-766-3p结合位点)。同时,将预测结合位点进行错义突变,即由5′-GCU GGA G-3′突变为5′-AGG CUG G-3′,用相同方法构建突变型荧光素酶报告基因表达载体pGL3-MT-SCARA5(hsa-miRNA-766-3p结合位点突变型)。重组载体经序列分析无误后,扩增转化菌株,进行无内毒素质粒DNA提取,提取过程严格按照试剂盒说明书进行。提取完成后用紫外分光光度法测定质粒DNA浓度,并使用无菌水将质粒DNA终浓度调整至500 ng/μL,于-20 ℃保存。
1.5 RNA合成从NCBI数据库中查找SCARA5(NM_173833.5)基因信息,根据SCARA5基因编码区信息,使用在线设计软件设计针对其编码区的siRNA序列5′-GGU GCA GGA CGC GCU GCA Gtt-3′及错义(NC)序列5′-CUC GAG GCG UGC AAG CGG Gtt-3′,然后合成互补的siRNA序列。同时化学合成hsa-miRNA-766-3p mimic(5′-CGA CUC CGA CAC CCC GAC CUC Att-3′)、hsa-miRNA-766-3p inhibitor(5′-TGA GGU CGG GGU GUC GGA GUC Gtt-3′),转染实验前均先退火形成双链。
1.6 Hsa-miRNA-766-3p与SCARA5靶位关系验证选取对数生长期的BGC-823细胞,用0.25%胰蛋白酶消化,制备细胞悬液,锥虫蓝染色并进行活细胞计数,使用DMEM+10% FBS完全培养液重悬细胞并调整细胞密度为1×105/mL,接种细胞至24孔板,每孔加0.5 mL细胞悬液,正常条件下培养24 h,进行质粒DNA与RNA共转染实验。转染分为9组:293细胞对照组、pGL3-WT-SCARA5转染组、pGL3-MT-SCARA5转染组、hsa-miRNA-766-3p mimic+pGL3-WT-SCARA5转染组、hsa-miRNA-766-3p mimic+pGL3-MT-SCARA5转染组、hsa-miRNA-766-3p NC+pGL3-WT-SCARA5转染组、hsa-miRNA-766-3p NC+pGL3-MT-SCARA5转染组、hsa-miRNA-766-3p inhibitor+pGL3-WT-SCARA5转染组、hsa-miRNA-766-3p inhibitor+pGL3-MT-SCARA5转染组。转染试剂及DNA、RNA用量严格参照Lipofectamine 3000转染试剂说明书的要求,同时,每组细胞转染40 ng海肾荧光素酶表达质粒(pGL3-TK)作为荧光素酶活性的参照。细胞转染24 h后,使用完全培养液全量换液后在正常条件下继续培养48 h,使用双荧光素酶检测系统检测各组细胞荧光素酶活性。
1.7 BGC-823和MGC-803细胞共转染实验实验分为5组:细胞对照组(不做处理)、溶媒对照组(DMSO)、皂苷处理组(50 ng/mL知母皂苷B-Ⅱ)、hsa-miRNA-766-3p mimic转染+皂苷处理组(hsa-miRNA-766-3p mimic转染后24 h以50 ng/mL知母皂苷B-Ⅱ处理)和siRNA-SCARA5转染+皂苷处理组(siRNA-SCARA5转染24 h后以50 ng/mL知母皂苷B-Ⅱ处理)。取对数生长期的BGC-823和MGC-803细胞,用0.25%胰酶消化后收集细胞,1 000×g离心2 min,收集细胞,使用含10% FBS的DMEM培养液重悬细胞,并调整细胞密度至1×105/mL,接种细胞至6孔培养板,每孔添加2 mL细胞悬液,37 ℃、5% CO2条件下培养24 h,然后进行转染实验,转染过程及RNA用量完全参照Lipofectamine 3000转染试剂说明书的要求。转染24 h后,使用含10% FBS的DMEM培养液对细胞进行全量换液,正常条件下继续培养48 h。收集细胞,提取细胞总RNA,用qPCR法检测hsa-miRNA-766-3p含量;提取细胞总蛋白,用蛋白质印迹法检测细胞内SCARA5蛋白表达量。
1.8 细胞增殖活性检测实验分为4组:细胞对照组、溶媒对照组、皂苷处理组、siRNA-SCARA5转染+皂苷处理组,处理方式与1.7项相同。细胞接种于96孔培养板,每孔1×105个细胞。活性检测前每孔加入10 μL质量浓度为5 mg/mL的MTT溶液,轻晃使其分布均匀,正常条件下继续培养4 h,去上清,每孔加入100 μL DMSO溶液,37 ℃孵育15 min,酶标仪检测读取各孔在490 nm波长处的光密度(D)值,然后根据D值绘制细胞增殖生长曲线。
1.9 细胞迁移能力检测实验分组和处理方式与1.8项相同,细胞接种于6孔培养板,每孔2×105个细胞,细胞转染且经皂苷处理48 h后,用胰酶消化细胞,重新接种至6孔培养板,过夜培养后全量换液,使用无菌200 μL枪头划痕,显微镜记录划痕,再使用无血清培养液冲洗2次,加入含10% FBS的DMEM培养液2 mL,正常条件下培养48 h后用显微镜拍同一划痕位置。
1.10 qPCR检测细胞经离心收集后,加入1 mL经4 ℃预冷的TRIzol试剂,使用1 mL移液器反复吹打至细胞充分裂解,裂解液于4 ℃下12 000×g离心2 min,收集上清,酚氯仿法提取细胞总RNA。提取完成后行琼脂糖凝胶电泳检测RNA条带完整性,紫外分光光度法测定RNA浓度。每组样本取2 μg总RNA,反转录制备cDNA,反转录过程使用特异反转录引物hsa-snRNA U6(5′-TAC CTT GCG AAG TGC TTA AAC-3′)和hsa-miRNA-766-3p(5′-GTC GTA TCC AGT GCG TGT CGT GGA GTC GGC AAT TGC ACT GGA TAC GAT GAG G-3′),SCARA5反转录使用Oligo dT18引物,反转录体系及实验条件严格按照M-MLV试剂盒说明书进行。取2 μL反转录产物作为PCR反应模板,qPCR检测hsa-miRNA-766-3p和SCARA5 mRNA相对含量。PCR特异引物序列:U6上游引物5′-GTG CTC GCT TCG GCA GCA CAT-3′,下游引物5′-TAC CTT GCG AAG TGC TTA AAC-3′;hsa-miRNA-766-3p上游引物5′-GCC GGC GCC CGA GCT CTG GCT C-3′,下游引物5′-CGA CTC CGA CAC CCC GAC CTC A-3′;SCARA5上游引物5′-GGC CCT GAC TCG CAA TGT G-3′,下游引物5′-AAC GAG TCT GAC TGG TTC TGC-3′;β-actin(NM_001101.3)上游引物5′-CCC AAG GCC AAC CGC GAG AAG ATG-3′,下游引物5′-GTC CCG GCC AGC CAG GTC CAG A-3′。PCR反应体系:SYBR Premix Ex Taq 10 μL,上、下游引物(20 μmol/L)各取0.2 μL,模板使用量为2 μL,反应体系用dH2O补足至20 μL。PCR反应条件:95 ℃变性10 s;58 ℃退火10 s;72 ℃延伸10 s,共42个循环。数据分析使用2-ΔΔCt法,目的基因相对于内参基因的表达量为2ΔCt=2Ctm-Ctn(m为目的基因;n为内标基因)。
1.11 蛋白质印迹检测细胞经离心收集后,每样本加入1 mL细胞裂解液M-PER,充分裂解后用BCA法进行蛋白定量。蛋白提取及定量过程严格按照试剂盒说明书进行。每样本取10 μg总蛋白进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳,对凝胶进行丽春红染色观察蛋白条带是否完整,转膜;5%脱脂牛奶封闭2 h,TBST洗膜3遍,4 ℃一抗过夜孵育;SCARA5和β-actin一抗稀释(TBST稀释)比分别为1︰300和1︰1 000,TBST洗膜3次,二抗孵育2 h,兔抗鼠二抗稀释比为1︰3 500;TBST洗膜3次,添加化学发光液反应底物,暗室曝光,扫描曝光底片,目的蛋白与内参蛋白条带D值的比值即为SCARA5蛋白的相对表达量。
1.12 统计学处理应用SPSS 13.0软件进行统计学分析,实验所得数据均以x±s表示,组间比较采用单因素方差分析,其中多组资料两两比较采用LSD多重检验。检验水准(α)为0.05。
2 结果 2.1 知母皂苷B-Ⅱ对BGC-823和MGC-803细胞内SCARA5基因转录及蛋白表达的影响qPCR检测结果(图 1A、1C)显示,与细胞对照组或溶媒对照组比较,50 ng/mL知母皂苷B-Ⅱ处理细胞48 h,BGC-823和MGC-803细胞内SCARA5 mRNA含量无明显变化(P>0.05),而细胞内SCARA5蛋白表达增强,皂苷处理组的SCARA5蛋白表达与细胞对照组或溶媒对照组比较差异有统计学意义(P<0.01,图 1B、1D)。
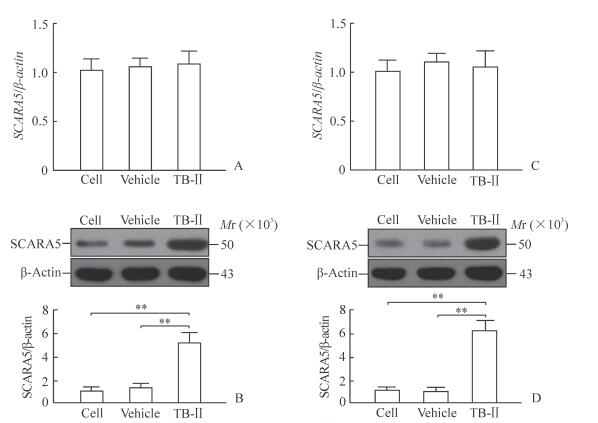
|
图 1 知母皂苷B-Ⅱ处理后BGC-823 (A, B)和MGC-803细胞(C, D)内SCARA5的mRNA (A, C)和蛋白(B, D)表达结果 Fig 1 Expressions of SCARA5 mRNA (A, C) and protein (B, D) in BGC-823 (A, B) and MGC-803 cells (C, D) treated with TB-Ⅱ SCARA5: Scavenger receptor A5; TB-Ⅱ: Timosaponin B-Ⅱ. **P < 0.01. n=3, x±s |
2.2 知母皂苷B-Ⅱ处理及SCARA5沉默对细胞增殖和迁移的影响
细胞增殖活性检测结果(图 2A、2C)显示,50 ng/mL知母皂苷B-Ⅱ处理BGC-823和MGC-803细胞48 h后,细胞增殖活性低于细胞对照组或溶媒对照组,差异有统计学意义(P<0.01);siRNA-SCARA5转染+皂苷处理组与皂苷处理组比较细胞增殖活性增强,差异有统计学意义(P<0.01);溶媒对照组与细胞对照组比较,细胞增殖活性差异无统计学意义(P>0.05)。
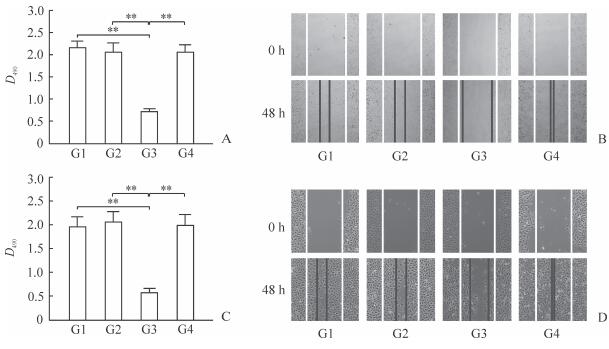
|
图 2 BGC-823 (A, B)、MGC-803细胞(C, D)增殖活性(A, C)和迁移能力(B, D)检测结果 Fig 2 Proliferation activity (A, C) and migration ability (B, D) of BGC-823 (A, B) and MGC-803 cells (C, D) G1: Cell control group; G2: Vehicle control group; G3: 50 ng/mL Timosaponin B-Ⅱtreatment group; G4: 50 ng/mL Timosaponin B-Ⅱ treatment plus siRNA-SCARA5 transfection group. SCARA5: Scavenger receptor A5.**P < 0.01. n=3, x±s. Original magnification: ×160 (B, D) |
细胞迁移能力检测结果(图 2B、2D)显示,50 ng/mL知母皂苷B-Ⅱ处理BGC-823和MGC-803细胞48 h时,两组细胞划痕宽度均大于细胞对照组和溶媒对照组,提示知母皂苷B-Ⅱ可有效抑制细胞迁移;48 h时siRNA-SCARA5转染+皂苷处理组与皂苷处理组比较,细胞划痕宽度明显变窄,表明经siRNA-SCARA5转染后,细胞迁移能力增强;溶媒对照组与细胞对照组比较,细胞迁移能力无差异。
2.3 荧光素酶验证hsa-miRNA-766-3p与SCARA5基因结合位点生物信息学预测结果显示,hsa-miRNA-766-3p在SCARA5基因3′UTR区有7个碱基的结合位点,即种子区(图 3A)。分别将hsa-miRNA-766-3p mimic、hsa-miRNA-766-3p inhibitor、hsa-miRNA-766-3p NC与两组荧光素酶报告基因表达载体pGL3-WT-SCARA5和pGL3-MT-SCARA5进行共转染,转染48 h后收集细胞进行荧光素酶活性检测,检测结果(图 3B)显示,hsa-miRNA-766-3p mimic能抑制野生型荧光素酶报告基因表达载体的荧光素酶活性,从8.12±1.12降至2.28±0.32,差异有统计学意义(P<0.01),而hsa-miRNA-766-3p inhibitor能增强野生型荧光素酶报告基因表达载体的荧光素酶活性,从8.12±1.12上升至11.56±0.89,差异有统计学意义(P<0.05);对于突变型荧光素酶报告基因表达载体,hsa-miRNA-766-3p mimic和hsa-miRNA-766-3p inhibitor对其均无明显影响。
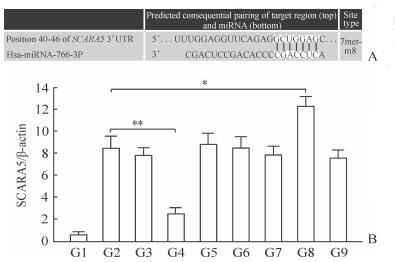
|
图 3 荧光素酶活性检测结果 Fig 3 Luciferase activity test results A: Bioinformatics analysis of hsa-miRNA-766-3p and SCARA5 gene 3′ UTR binding site; B: Luciferase activity test results of BGC-823 cells after 48 h of transfection. G1: BGC-823 control group; G2: pGL3-WT-SCARA5 transfection group; G3: pGL3-MT-SCARA5 transfection group; G4: Hsa-miRNA- 766-3p mimic+pGL3-WT-SCARA5 transfection group; G5: Hsa-miRNA-766-3p mimic+pGL3-MT-SCARA5 transfection group; G6: NC+pGL3-WT-SCARA5 transfection group; G7: NC+pGL3-MT-SCARA5 transfection group; G8: HsamiRNA-766-3p inhibitor+pGL3-WT-SCARA5 transfection group; G9: Hsa-miRNA-766-3p inhibitor+pGL3-MT-SCARA5 transfection group. SCARA5: Scavenger receptor A5; UTR: Untranslated region. NC: Non-specific control; WT: Wild-type; MT: Mutant-type. *P < 0.05, **P < 0.01. n=3, x±s |
2.4 Hsa-miRNA-766-3p过表达及SCARA5沉默对知母皂苷B-Ⅱ处理后两组胃癌细胞中hsa-miRNA-766-3p含量和SCARA5蛋白表达的影响
50 ng/mL知母皂苷B-Ⅱ处理BGC-823和MGC-803细胞48 h后,与细胞对照组和溶媒对照组比较,细胞内hsa-miRNA-766-3p含量均降低(P<0.01)、SCARA5蛋白表达升高(P<0.01);hsa-miRNA-766-3p mimic转染+皂苷处理组与皂苷处理组比较,细胞内hsa-miRNA-766-3p含量上升(P<0.01)、SCARA5蛋白表达降低(P<0.01);siRNA- SCARA5转染+皂苷处理组与皂苷处理组比较,细胞内hsa-miRNA-766-3p含量无明显变化(P>0.05),但SCARA5蛋白表达降低(P<0.01)。见图 4。
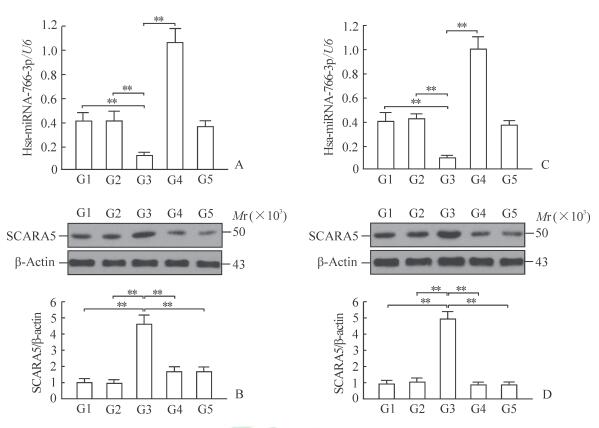
|
图 4 Hsa-miRNA-766-3p含量(A, C)和SCARA5蛋白(B, D)表达检测结果 Fig 4 Detection results of hsa-miRNA-766-3p content (A, C) and SCARA5 protein (B, D) expression A, B: BGC-823 cell; C, D: MGC-803 cell. G1: Cell control group; G2: Vehicle control group; G3: 50 ng/mL Timosaponin B-Ⅱ treatment group; G4: 50 ng/mL Timosaponin B-Ⅱtreatment plus hsa-miRNA-766-3p mimic transfection group; G5: 50 ng/mL Timosaponin B-Ⅱtreatment plus siRNA-SCARA5 transfection group. SCARA5: Scavenger receptor A5. **P < 0.01. n=3, x±s |
3 讨论
SCARA5基因位于人第8号染色体,在原发性肝癌[8-9]、骨肉瘤[10]、乳腺癌[11]和非小细胞肺癌[12]的进展中具有重要作用,SCARA5的缺失或者低表达会导致肿瘤细胞增殖、侵袭和迁移能力的增强[13]。目前,SCARA5基因与胃癌关系的研究较少。
MiRNA与肿瘤关系密切,其通过调节肿瘤细胞的凋亡、周期、增殖和迁移对肿瘤进程产生多样化影响[14-15]。MiRNA与胃癌关系的研究较多,Zhang等[16]研究表明,上调miRNA-802可以通过抑制癌基因RAB23的表达,抑制胃癌细胞的肿瘤活性。转移是胃癌高病死率和低预后的主要原因,有研究者指出,miRNA-143和miRNA-145通过共同的目标基因MYO6调节胃癌的上皮间质转化和抑制转移[17]。Eun等[18]发现,miRNA与转录组调控网络间可以进行复杂的相互作用,并且同时针对多个基因;miRNA-495-3p作为一种有效的肿瘤抑制基因调控胃癌细胞的表观遗传修饰,进而促进胃上皮细胞的增殖和恶性转化。上述研究表明,miRNAs是多种肿瘤发病机制的内在原因,其与胃癌的关系是复杂而全面的,因而其也可以成为胃癌肿瘤基因治疗的切入点。
本研究首先使用知母皂苷B-Ⅱ处理2种胃癌细胞株,并对细胞内SCARA5的转录水平即蛋白表达进行了比对分析,结果显示,在2种胃癌细胞中50 ng/mL知母皂苷B-Ⅱ均能上调SCARA5的表达,而对SCARA5 mRNA含量无明显影响,这表明知母皂苷B-Ⅱ对SCARA5的表达促进属于转录后调控机制。作为经典的转录后调控途径之一,我们首先想到在知母皂苷B-Ⅱ和SCARA5蛋白调控之间是否存在一组关键的miRNA。生物信息学预测hsa-miRNA-766-3p可能靶向调控SCARA5,我们通过荧光素酶报告基因实验证实了这个理论结合位点真实存在。为了证实知母皂苷B-Ⅱ抑制胃癌细胞株增殖及迁移是通过hsa-miRNA-766-3p及其靶基因SCARA5实现的,我们在给予2种胃癌细胞株知母皂苷B-Ⅱ处理前先沉默SCARA5基因,结果显示SCARA5基因沉默可以逆转知母皂苷B-Ⅱ抑制2种胃癌细胞株增殖及迁移的作用和趋势,由于siRNA-SCARA5转染导致的SCARA5基因沉默亦不受制于hsa-miRNA-766-3p含量降低的负向调控,因此本研究结果揭示了2个重要的事实:(1)知母皂苷B-Ⅱ处理能够上调胃癌细胞内SCARA5蛋白表达,这种调控作用可通过抑制hsa-miRNA-766-3p来完成;(2)知母皂苷B-Ⅱ抑制胃癌细胞的增殖和迁移,主要是通过抑制肿瘤细胞内hsa-miRNA-766-3p含量来上调抑癌基因SCARA5表达完成。
本研究首次证实了知母皂苷B-Ⅱ可以抑制人胃癌细胞株BGC-823和MGC-803的增殖与迁移能力,首次解释了知母皂苷B-Ⅱ抑制胃癌的作用途径为hsa-miRNA-766-3p表达抑制和其靶蛋白SCARA5的表达上调。知母皂苷B-Ⅱ如何抑制肿瘤细胞内hsa-miRNA-766-3p表达将是未来研究工作的重点,根据现有数据,知母皂苷B-Ⅱ很可能通过与某个可调控hsa-miRNA-766-3p转录的转录因子结合,抑制转录因子活性。
| [1] | SMYTH E C, CUNNINGHAM D. Gastric cancer in 2012:defining treatment standards and novel insights into disease biology[J]. Nat Clin Oncol, 2013, 10: 73–74. DOI: 10.1038/nrclinonc.2012.228 |
| [2] | VILLANUEVA M T. Combination therapy:update on gastric cancer in East Asia[J]. Nat Rev Clin Oncol, 2011, 8: 690. |
| [3] | LEUNG W K, WU M S, KAKUGAWA Y, KIM J J, YEOH K G, GOH K L, et al. Screening for gastric cancer in Asia:current evidence and practice[J]. Lancet Oncol, 2008, 9: 279–287. DOI: 10.1016/S1470-2045(08)70072-X |
| [4] | YUAN Y L, LIN B Q, ZHANG C F, CUI L L, RUAN S X, YANG Z L, et al. Timosaponin B-Ⅱ ameliorates palmitate-induced insulin resistance and inflammation via IRS-1/PI3K/Akt and IKK/NF-κB pathways[J]. Am J Chin Med, 2016, 44: 755–769. DOI: 10.1142/S0192415X16500415 |
| [5] | ZHANG T, WANG J, WANG S, MA C. Timosaponin B-Ⅱ inhibits lipopolysaccharide-induced acute lung toxicity via TLR/NF-κB pathway[J]. Toxicol Mech Methods, 2015, 25: 665–671. DOI: 10.3109/15376516.2015.1045652 |
| [6] | LU W Q, QIU Y, LI T J, TAO X, SUN L N, CHEN W S. Timosaponin B-Ⅱ inhibits proinflammatory cytokine induction by lipopolysaccharide in BV2 cells[J]. Arch Pharm Res, 2009, 32: 1301–1308. DOI: 10.1007/s12272-009-1916-4 |
| [7] | ZHAO X, LIU C, QI Y, FANG L, LUO J, BI K, et al. Timosaponin B-Ⅱ ameliorates scopolamine-induced cognition deficits by attenuating acetylcholinesterase activity and brain oxidative damage in mice[J]. Metab Brain Dis, 2016, 31: 1455–1461. DOI: 10.1007/s11011-016-9877-z |
| [8] | SUN G, ZHANG C, FENG M, LIU W, XIE H, QIN Q, et al. Methylation analysis of p16, SLIT2, SCARA5, and Runx3 genes in hepatocellular carcinoma[J/OL]. Medicine (Baltimore), 2017, 96: e8279. doi: 10.1097/MD.0000000000008279. |
| [9] | HUANG J, ZHENG D L, QIN F S, CHENG N, CHEN H, WAN B B, et al. Genetic and epigenetic silencing of SCARA5 may contribute to human hepatocellular carcinoma by activating FAK signaling[J]. J Clin Invest, 2010, 120: 223–241. DOI: 10.1172/JCI38012 |
| [10] | WEN X, WANG N, ZHANG F, DONG C. Overexpression of SCARA5 inhibits tumor proliferation and invasion in osteosarcoma via suppression of the FAK signaling pathway[J]. Mol Med Rep, 2016, 13: 2885–2891. DOI: 10.3892/mmr.2016.4857 |
| [11] | YOU K, SU F, LIU L, LÜ X, ZHANG J, ZHANG Y, et al. SCARA5 plays a critical role in the progression and metastasis of breast cancer by inactivating the ERK1/2, STAT3, and AKT signaling pathways[J]. Mol Cell Biochem, 2017, 435: 47–58. DOI: 10.1007/s11010-017-3055-4 |
| [12] | LIU J, HU G, CHEN D, GONG A Y, SOORI G S, DOBLEMAN T J, et al. Suppression of SCARA5 by Snail1 is essential for EMT-associated cell migration of A549 cells[J/OL]. Oncogenesis, 2013, 2: e73. doi: 10.1038/oncsis.2013.37. |
| [13] | 洪正东. Rock2通过β-catenin/TCF4信号通路调控SCARA5表达影响肾癌细胞增殖的研究[D]. 南昌: 南昌大学, 2016. |
| [14] | MISHRA S, YADAV T, RANI V. Exploring miRNA based approaches in cancer diagnostics and therapeutics[J]. Crit Rev Oncol Hematol, 2016, 98: 12–23. DOI: 10.1016/j.critrevonc.2015.10.003 |
| [15] | MOTTI M L, D'ANGELO S, MECCARIELLO R. MicroRNA, cancer and diet: facts and new exciting perspectives[J/OL]. Curr Mol Pharmacol, 2017 Oct 13. doi: 10.2174/1874467210666171013123733. |
| [16] | ZHANG X Y, MU J H, LIU L Y, ZHANG H Z. Upregulation of miR-802 suppresses gastric cancer oncogenicity via targeting RAB23 expression[J]. Eur Rev Med Pharmacol Sci, 2017, 21: 4071–4078. |
| [17] | LEI C, DU F, SUN L, LI T, LI T, MIN Y, et al. miR-143 and miR-145 inhibit gastric cancer cell migration and metastasis by suppressing MYO6[J/OL]. Cell Death Dis, 2017, 8: e3101. doi: 10.1038/cddis.2017.493. |
| [18] | EUN J W, KIM H S, SHEN Q, YANG H D, KIM S Y, YOON J H, et al. MicroRNA-495-3p functions as a tumour suppressor by regulating multiple epigenetic modifiers in gastric carcinogenesis[J]. J Pathol, 2018, 244: 107–119. DOI: 10.1002/path.4994 |
 2018, Vol. 39
2018, Vol. 39


