2. 嘉兴市妇幼保健院药剂科, 嘉兴 314000
2. Department of Pharmacy, Jiaxing Maternity and Child Health Care Hospital, Jiaxing 314000, Zhejiang, China
胶质瘤是原发性颅内肿瘤中最常见的类型,约占所有恶性脑肿瘤的80%[1]。胶质瘤多呈浸润生长,与正常脑组织边界模糊,手术难以将肿瘤组织完全切除。血脑屏障(blood-brain barrier,BBB)和血脑肿瘤屏障存在于早期或胶质瘤的边缘,限制了约98%的小分子药物和几乎所有大分子药物的脑内转运及渗透[2]。目前,手术切除和替莫唑胺辅助化疗联合放疗是治疗脑胶质瘤的标准方案,但胶质瘤对放疗不敏感,BBB的存在又导致颅内抗肿瘤药物浓度较低,并且胶质瘤侵袭性生长的特性导致术后易复发,治疗效果不佳。
近年来,纳米递药系统得到广泛研究和应用,它可以桥连化疗药物和各种靶向配体,有效促进药物跨越BBB转运到脑内[3]。靶向纳米递药系统可使药物浓集于肿瘤组织,降低正常组织内的药物浓度,增效减毒[4-5]。本实验室前期制备了还原性硫辛酸(lipoic acid,LA)修饰的交联聚精氨酸组氨酸(disulfide cross-linked LA modified polyarginine polypeptide and histidine,LHRss)多肽胶束,是一种生物相容性好、毒性低的纳米载体,共载化疗药物多柔比星(doxorubicin,DOX)和基因药物pTRAIL,显著促进了耐药乳腺癌细胞内药物的聚集及体外耐药乳腺癌细胞的抗增殖作用,体内肿瘤抑制率可达94.0%[6]。
本研究采用该新型纳米载体包载DOX用于脑胶质瘤的治疗,并采用特异性靶头修饰提高透过BBB的效率及对脑胶质瘤的靶向性。Angiopep-2是Kunitz型抑酶肽的一种,由19个氨基酸组成,对低密度脂蛋白受体相关蛋白1(low-density lipoprotein receptor-related protein 1,LRP1)具有高亲和力[7]。LRP1是一种多功能受体,在脑毛细血管内皮细胞(brain capillary endothelium cell,BCEC)和胶质瘤细胞上均有过表达[8-9]。与常用的受体介导脑靶向配体转铁蛋白、乳铁蛋白和亲和素相比,angiopep-2跨越牛BCEC的能力更强[10]。另外,基质金属蛋白酶(matrix metalloproteinase,MMP)与肿瘤的生长密切相关,可以降解细胞外基质,在肿瘤组织中高表达[11]。MMP-2是MMP家族的重要一员,MMP-2的底物肽Gly-Pro-Leu-Gly-Arg-Gly-Lys(GPLGVRGK)可作为裂解肽底物,插入到智能、靶向给药系统的共聚物中[12]。本研究采用MMP-2底物肽为桥接,将angiopep-2修饰于LHRss表面,制备angiopep-2修饰的LHRss多肽胶束用于靶向治疗脑胶质瘤。本研究用固相合成法将angiopep-2短肽连接到LA修饰的聚精氨酸组氨酸(LHR)多肽的末端,通过超声乳化法包载化疗药物DOX,同时考察DOX在各介质中的释放特性及载药胶束的脑靶向特性。
1 材料和方法 1.1 主要仪器、试剂与细胞株Zeta size ZS90型粒度测定仪(英国Malvern公司);JEM-2010型透射电镜(日本JEOL公司);FACSCalibur流式细胞仪(美国BD公司);GloMax20/20型化学发光检测仪(美国Promega公司);激光共聚焦显微镜(日本Olympus公司);angiopep-2(TFFYGGSRGGKRNNFKTEEYC)、MMP-2的底物肽GPLGVRGK(浙江鸿拓生物技术股份有限公司);L-组氨酸盐酸盐、L-精氨酸、LA、三乙胺[生工生物工程(上海)股份有限公司];盐酸DOX(浙江海正药业股份有限公司);DMEM培养液、胎牛血清(美国Gibco公司);其他试剂均为分析纯。BCEC和胶质瘤细胞U251购自中国科学院上海细胞库。
1.2 细胞培养BCEC和U251细胞常规培养于含10%胎牛血清、青霉素100 U/mL及链霉素100 μg/mL的DMEM培养液中,在37 ℃、5% CO2孵箱中培养,48 h后更换培养液,显微镜下观察细胞生长情况,待细胞生长至80%融合时用于实验。
1.3 Angiopep-2修饰的载DOX多肽胶束(LHRss-An/DOX)的制备L-R6(LA-RRRRRR)、H3(HHH)、MMP-2底物肽、angiopep-2肽、LA在芴甲氧羰基保护下用固相合成法合成LHR和LHR-An聚合物多肽,并通过反相高效液相色谱进行纯化。称取1 mg盐酸DOX,加入1 mL二氯甲烷,加入3倍摩尔量的三乙胺,室温避光,过夜脱盐。按摩尔比1︰1称取上述LHR和LHR-An聚合物多肽溶于甲醇,加入10 mg/mL的半胱氨酸盐酸盐,在室温下反应12 h,氮气吹干甲醇;产物由去离子水经透析膜(截留相对分子质量为3 500)透析纯化12 h、冻干,获得二硫键交联的LHRss-An。将LHRss-An溶于双蒸水中,然后将脱盐后的DOX溶液逐滴加入至LHRss-An溶液中,冰浴条件下200 W超声30 s。将乳化完全的多肽和DOX的混合溶液迅速转移至磁力搅拌器上快速搅拌5 h,除去溶液中的二氯甲烷。使用孔径为0.45 μm的微孔滤膜过滤溶液,除去未包封的DOX颗粒,制成载药胶束LHRss-An/DOX。
1.4 LHRss-An/DOX载药量和包封率检测DOX的标准曲线:称取0.001 g的DOX,加入1 mL二甲亚砜(DMSO)溶解得1 000 μg/mL的DOX溶液(母液)。配制浓度分别为0.5、1、2、4、6、8 μg/mL的DOX-DMSO溶液,用化学发光检测仪测定荧光强度,绘制标准曲线。
改变药物与多肽载体的质量比分别为10%、20%、30%、40%、50%,按1.3项下方法制备载药胶束LHRss-An/DOX。通过荧光分光光度法测定并计算LHRss-An/DOX的载药量和包封率。取制备好的LHRss-An/DOX胶束溶液100 μL,加入DMSO 900 μL,超声20 min,破坏胶束结构游离出DOX。然后上机检测。分别计算载药量和包封率,载药量(%)=W1/W2×100%,包封率(%)=W1/W3×100%;式中W1表示包封于胶束内的药物质量,W2表示载药胶束的总质量,W3表示体系中药物的总质量。
1.5 LHRss-An/DOX的表征取适量制备的载药胶束LHRss-An/DOX,用磷酸盐缓冲液(PBS)稀释制成1 mg/mL溶液,检测LHRss-An/DOX的粒径及zeta电位。透射电镜下观察胶束形态,取1滴样品滴至铜网上,用滤纸吸干,白炽灯下烘烤铜网至完全干燥,上机检测,设加速电压为75 kV,观察并拍照。
1.6 LHRss-An/DOX的体外释放特性采用透析法研究LHRss-An/DOX载药胶束中DOX的释放行为。取2 mL载药胶束装入截留相对分子质量为3 500的透析袋中,分别将透析袋放入盛有40 mL pH 7.4、pH 5.5和pH 5.5+10 mmol/L DL-二硫苏糖醇(DTT)PBS的烧杯中,37 ℃搅拌(100次/min),分别在0.5、1、2、4、8、12、24、36、48、60、72 h取出200 μL样品待测,同时补充200 μL新鲜的释放介质。用化学发光检测仪测定DOX的荧光强度,计算DOX的累积释放率。
1.7 载药胶束的跨膜转运实验将BCEC(5×105 /孔)接种于24孔Transwell板的上室中,每孔500 μL,下室加入1 mL无血清培养液。每天测定细胞电阻待其稳定后,BCEC构建形成BBB。取对数生长期的U251细胞,消化成单细胞悬液,吸弃下室的培养液,将U251细胞按2×105/孔加到Transwell板的下室中,在孵箱中继续孵育24 h。然后在上室中分别加入游离DOX、LHRss/DOX或LHRss-An/DOX(DOX终浓度为1 μg/mL)。给药12 h后,吸弃下室培养液,用PBS洗3次,胰酶消化,离心后PBS重悬,以空白细胞作阴性对照,利用流式细胞仪检测U251细胞对DOX的摄取情况和细胞的平均荧光强度。
1.8 药物的细胞内分布取对数生长期的U251细胞以每孔1 mL(每孔5×104个细胞)接种于24孔板(预先在孔底部铺上灭菌的盖玻片),在37 ℃、5% CO2的孵箱中培养24 h,弃去培养液,PBS洗2次,分别加入含游离DOX、LHRss/DOX、LHRss-An/DOX或经MMP-2预处理的LHRss-An/DOX(LHRss-An/DOX+MMP-2)的无血清培养液,DOX终浓度为1 μg/mL,在37 ℃、5% CO2的孵箱中培养4 h。吸去培养液,PBS洗1次,用预冷的4%多聚甲醛溶液固定30 min,PBS洗3次。吸取8 μL含有DAPI的封片液滴于载玻片上,将圆形盖玻片取出,使含有细胞的一面贴于含有封片液的载玻片上。利用激光扫描共聚焦显微镜观察多肽胶束在U251细胞内的分布情况,并拍照记录。
1.9 统计学处理应用SPSS 18.0软件进行统计学分析,实验数据以x±s表示,组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 LHRss-An/DOX的载药量和包封率DOX的回归方程为F=17 486C+3 087.2(R2=0.999 4,n=6),线性范围为0.5~8 μg/mL。载药胶束的处方优化实验结果如图 1所示,随着投药量增加载药量逐渐升高,包封率逐渐减小;药载比为40%和50%的处方载药量较高,两组间载药量差异无统计学意义(P>0.05),因此最佳药载比为40%,载药量为15.8%,包封率为55.3%。
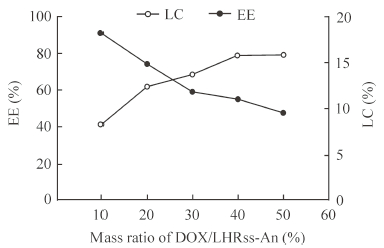
|
图 1 LHRss-An/DOX的载药量和包封率检测结果 Fig 1 Loading content (LC) and entrapment efficiency (EE) of LHRss-An/DOX DOX: Doxorubicin; LHRss-An: Angiopep-2 modified disulfide cross-linked lipoic acid-polyarginine polypeptide and histidine |
2.2 LHRss-An/DOX的表征
新鲜制备载药胶束LHRss-An/DOX的光散射粒径和zeta电位如图 2所示,平均粒径为(100.9±8.7)nm,聚合物分散度指数(polymer dispersity index,PDI)为0.232(小于0.3),说明载药胶束粒径分布较窄;zeta电位为(28.8±3.3)mV,说明粒子呈正电性且稳定存在。由透射电镜图(图 3)可知,胶束LHRss-An/DOX呈球形。
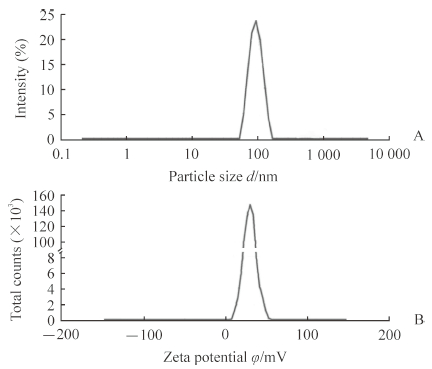
|
图 2 LHRss-An/DOX的粒径(A)和zeta电位(B)分布图 Fig 2 Particle size (A) and zeta potential (B) of LHRss-An/DOX LHRss-An: Angiopep-2 modified disulfide cross-linked lipoic acid-polyarginine polypeptide and histidine; DOX: Doxorubicin |

|
图 3 LHRss-An/DOX的透射电镜图 Fig 3 Transmission electron microscopy image of LHRss-An/DOX LHRss-An: Angiopep-2 modified disulfide cross-linked lipoic acid-polyarginine polypeptide and histidine; DOX: Doxorubicin. Scale bar=200 nm |
2.3 LHRss-An/DOX的体外释放特性
在pH 7.4、pH 5.5和pH 5.5+10 mmol/L DTT分别模拟的细胞外正常环境、内涵体环境和肿瘤细胞内环境下,LHRss-An/DOX的体外释放特性如图 4所示,LHRss-An/DOX的释放随着释放介质的变化而变化。在pH 5.5+10 mmol/L DTT环境下,LHRss-An/DOX 72 h内的累积释放率高达(96.6±2.7)%;pH 5.5环境下,72 h内的累积释放率为(84.1±3.9)%;pH 7.4环境下,72 h内的累积释放率为(60.3±2.6)%,说明载药胶束LHRss-An/DOX在肿瘤细胞内可以快速、有效地释放DOX,而在正常体液环境中保持相对稳定。
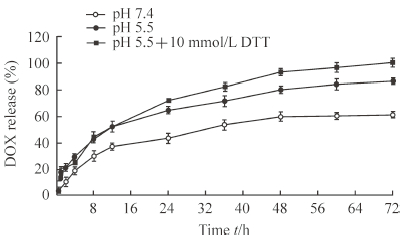
|
图 4 LHRss-An/DOX的体外释放特性曲线 Fig 4 In vitro release profiles of LHRss-An/DO DTT: DL-dithiothreitol; LHRss-An: Angiopep-2 modified disulfide cross-linked lipoic acid-polyarginine polypeptide and histidine; DOX: Doxorubicin. n=3, x±s |
2.4 载药胶束的跨膜转运实验
通过流式细胞术观察游离DOX、LHRss/DOX、LHRss-An/DOX的跨膜转运效率,结果(图 5)显示,LHRss-An/DOX的跨膜转运效率最高,LHRss/DOX次之,两者的平均荧光强度值分别是DOX的4.27倍和2.09倍,差异有统计学意义(P<0.05),说明载药胶束可以提高DOX的跨膜转运效率。LHRss-An/DOX的平均荧光强度值是LHRss/DOX的2.04倍,差异有统计学意义(P<0.05),说明angiopep-2修饰可以有效提高载药胶束的跨膜转运效率。
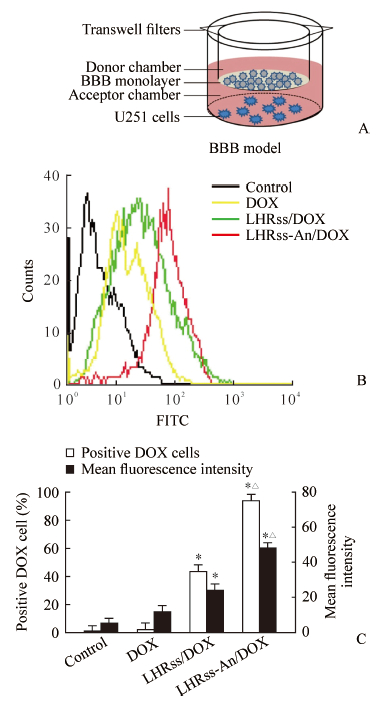
|
图 5 体外BBB模型(A)和胶质瘤细胞对游离DOX及载药胶束的摄取(B, C) Fig 5 In vitro BBB model (A) and cell uptake of free DOX and drug-loading micelles by glioma cells (B, C) BBB: Blood-brain barrier; DOX: Doxorubicin; LHRss-An: Angiopep-2 modified disulfide cross-linked lipoic acid-polyarginine polypeptide and histidine. *P < 0.05 vs control group or DOX group; △P < 0.05 vs LHRss/DOX group. n=3, x±s |
2.5 药物的细胞内分布
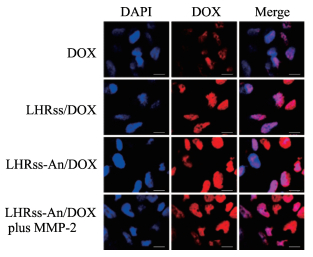
胶质瘤细胞U251分别与游离DOX、LHRss/DOX、LHRss-An/DOX和LHRss-An/DOX+MMP-2孵育4 h后,通过激光扫描共聚焦显微镜观察,结果如图 6所示。DOX分布于细胞质和细胞核内,呈弥漫性分布,各组的荧光强度大小为:经MMP-2预处理的LHRss-An/DOX组>LHRss-An/DOX组>LHRss/DOX组>DOX组,说明angiopep-2修饰的纳米胶束可有效提高脑胶质瘤的靶向性,且MMP-2预处理LHRss-An/DOX后部分angiopep-2从胶束表面脱落,使载药胶束粒径减小,进一步提高了入胞效率。
|
图 6 激光扫描共聚焦显微镜观察胶质瘤细胞内游离DOX和载药胶束的分布 Fig 6 Distribution of free DOX and drug-loading micelles in glioma cells by LSCM DOX: Doxorubicin; LHRss-An: Angiopep-2 modified disulfide cross-linked lipoic acid-polyarginine polypeptide and histidine; MMP-2: Matrix metalloproteinase 2; LSCM: Laser scanning confocal microscopy. Scale bar=10 μm |
3 讨论
本研究采用angiopep-2修饰LA-聚精氨酸组氨酸多肽纳米胶束LHRss包载DOX,构建了体外跨BBB及脑胶质瘤的靶向性增强的LHRss-An/DOX。LA具有分子内五元环二硫键结构和两亲性的末端羧基,在半胱氨酸条件下分子内二硫键可聚合形成内部空腔结构,有效增加对脂溶性药物的包载能力。本研究通过调整药载比优化处方,当药载比≥40%时,随着投药量增加载药量基本不变、包封率下降,可能是由于DOX在胶束的疏水性内核中达到饱和、多余的DOX析出所致。药载比为40%的载药胶束LHRss-An/DOX的粒径为(100.9±8.7)nm,粒径分布均匀。胶束中的组氨酸在pH为5左右的环境中可以发生质子化[13],有利于在内涵体(pH 5.5)和肿瘤细胞内(pH 5.5+10 mmol/L DTT)环境中释放药物。胶束中的二硫键可以在还原性条件下裂解,促进DOX更快释放[14]。体外释放实验结果表明,LHRss-An/DOX可以快速响应肿瘤细胞内环境模拟条件,在pH 5.5和富含还原性物质DTT条件下DOX的累积释放率迅速上升。在跨膜转运方面,angiopep-2修饰后的载药胶束较未经靶向修饰的体外跨BBB效率提高。在肿瘤靶向方面,angiopep-2修饰进一步帮助纳米胶束有效靶向到脑胶质瘤组织,肿瘤组织内高浓度的MMP-2条件进一步促使桥接angiopep-2的MMP-2底物肽逐渐断裂,靶头脱落,使载药胶束粒径减小,进一步促进其快速入胞。激光扫描共聚焦显微镜下观察到LHRss/DOX和LHRss-An/DOX在细胞质和细胞核中均有分布,说明载药胶束可从内涵体中逃逸出来并在细胞质内降解释放DOX,然后进一步扩散到细胞核内发挥疗效。
综上所述,angiopep-2修饰的LHRss-An/DOX对于提高跨BBB效率及胶质瘤的靶向能力具有一定的意义。LHRss-An/DOX胶束具有较高的载药量及良好的体外释放特性,在体外BBB模型实验中表现出较高的跨膜效率,且被胶质瘤细胞U251靶向摄取后可从内涵体中逃逸,在细胞质中降解扩散进入细胞核内发挥药效。LHRss-An有望作为一种良好载药、有效跨BBB及肿瘤靶向的纳米载体应用于脑胶质瘤的治疗,后续实验将进一步探究其体内外抗胶质瘤活性及机制。
| [1] | BYEON H J, THAO LE Q, LEE S, MIN S Y, LEE E S, SHIN B S, et al. Doxorubicin-loaded nanoparticles consisted of cationic-and mannose-modified-albumins for dual-targeting in brain tumors[J]. J Control Release, 2016, 225: 301–313. DOI: 10.1016/j.jconrel.2016.01.046 |
| [2] | XU Y Y, GAO P, SUN Y, DUAN Y R. Development of targeted therapies in treatment of glioblastoma[J]. Cancer Biol Med, 2015, 12: 223–237. |
| [3] | WOHLFART S, GELPERINA S, KREUTER J. Transport of drugs across the blood-brain barrier by nanoparticles[J]. J Control Release, 2012, 161: 264–273. DOI: 10.1016/j.jconrel.2011.08.017 |
| [4] | LU Q, LI L M, HAN M, TANG X J, YAO J N, YING X Y, et al. Characteristics of sequential targeting of brain glioma for transferrin-modified cisplatin liposome[J]. Int J Pharm, 2013, 444(1/2): 1–9. |
| [5] | ZHU Y, ZHANG J, MENG F, DENG C, CHENG R, FEIJEN J, et al. cRGD-functionalized reduction-sensitive shell-sheddable biodegradable micelles mediate enhanced doxorubicin delivery to human glioma xenografts in vivo[J]. J Control Release, 2016, 233: 29–38. DOI: 10.1016/j.jconrel.2016.05.014 |
| [6] | HU C, GU F, TAI Z, YAO C, GONG C, XIA Q, et al. Synergistic effect of reduced polypeptide micelle for co-delivery of doxorubicin and TRAIL against drug-resistance in breast cancer[J]. Oncotarget, 2016, 7: 61832–61844. |
| [7] | BERTRAND Y, CURRIE J C, POIRIER J, DEMEULE M, ABULROB A, FATEHI D, et al. Influence of glioma tumour microenvironment on the transport of ANG1005 via low-density lipoprotein receptor-related protein 1[J]. Br J Cancer, 2011, 105: 1697–1707. DOI: 10.1038/bjc.2011.427 |
| [8] | KAFA H, WANG J T, RUBIO N, KLIPPSTEIN R, COSTA P M, HASSAN H A, et al. Translocation of LRP1 targeted carbon nanotubes of different diameters across the blood-brain barrier in vitro and in vivo[J]. J Control Release, 2016, 225: 217–229. DOI: 10.1016/j.jconrel.2016.01.031 |
| [9] | LIU C, LIU X N, WANG G L, HEI Y, MENG S, YANG L F, et al. A dual-mediated liposomal drug delivery system targeting the brain:rational construction, integrity evaluation across the blood-brain barrier, and the transporting mechanism to glioma cells[J]. Int J Nanomedicine, 2017, 12: 2407–2425. DOI: 10.2147/IJN |
| [10] | DEMEULE M, CURRIE J C, BERTRAND Y, CHÉ C, NGUYEN T, RÉGINA A, et al. Involvement of the low-density lipoprotein receptor-related protein in the transcytosis of the brain delivery vector angiopep-2[J]. J Neurochem, 2008, 106: 1534–1544. DOI: 10.1111/jnc.2008.106.issue-4 |
| [11] | MATSUMURA S, AOKI I, SAGA T, SHIBA K. A tumor-environment-responsive nanocarrier that evolves its surface properties upon sensing matrix metalloproteinase-2 and initiates agglomeration to enhance T2 relaxivity for magnetic resonance imaging[J]. Mol Pharm, 2011, 8: 1970–1974. DOI: 10.1021/mp2001999 |
| [12] | LIU Y, ZHANG D, QIAO Z Y, QI G B, LIANG X J, CHEN X G, et al. A peptide-network weaved nanoplatform with tumor microenvironment responsiveness and deep tissue penetration capability for cancer therapy[J]. Adv Mater, 2015, 27: 5034–5042. DOI: 10.1002/adma.201501502 |
| [13] | ZHAO B X, ZHAO Y, HUANG Y, LUO L M, SONG P, WANG X, et al. The efficiency of tumor-specific pH-responsive peptide-modified polymeric micelles containing paclitaxel[J]. Biomaterials, 2012, 33: 2508–2520. DOI: 10.1016/j.biomaterials.2011.11.078 |
| [14] | HUANG K, SHI B, XU W, DING J, YANG Y, LIU H, et al. Reduction-responsive polypeptide nanogel delivers antitumor drug for improved efficacy and safety[J]. Acta Biomater, 2015, 27: 179–193. DOI: 10.1016/j.actbio.2015.08.049 |
 2018, Vol. 39
2018, Vol. 39


