2. 海军军医大学(第二军医大学)长海医院神经外科, 上海 200433
2. Department of Neurosurgery, Changhai Hospital, Navy Medical University(Second Military Medical University), Shanghai 200433, China
鞍旁脑膜瘤是指肿瘤基底位于鞍旁的脑膜瘤,此类肿瘤约占颅内脑膜瘤的5%~10%;一般来说,鞍旁脑膜瘤发病率较低,常见的有鞍结节、海绵窦、前床突、蝶骨嵴内1/3等部位的脑膜瘤[1]。由于鞍旁区域解剖结构复杂且重要,瘤体常与颈内动脉、视神经和海绵窦等相邻,有时会紧密粘连,使其手术难度、复杂程度加大,对患者可能造成的创伤也较显著[2-3]。Romani等[4]将最大直径≥4 cm的鞍结节脑膜瘤称为巨大型鞍结节脑膜瘤,据此本研究对2006年7月至2016年8月间上海中医药大学附属第七人民医院收治的34例肿瘤最大直径≥3.3 cm的大型鞍旁脑膜瘤患者采用翼点或扩大翼点入路行显微外科手术治疗,治疗效果满意,现报告如下。
1 资料和方法 1.1 一般资料纳入2006年7月至2016年8月间上海中医药大学附属第七人民医院收治的影像学检查确诊的肿瘤最大直径≥3.3 cm的大型鞍旁脑膜瘤患者,排除影像学检查示鞍旁占位为巨大血管性或炎性病变的患者。共纳入患者34例,男性13例、女性21例;年龄21~72岁,平均(49±13)岁;病程1~55个月,平均(13±10)个月;瘤体最大直径为3.3~5.2 cm,平均(4.3±0.6)cm。所有患者均签署书面知情同意书,本研究通过上海中医药大学附属第七人民医院伦理委员会审批。
1.2 临床表现以视力障碍为临床表现者14例,其中单侧视力障碍10例、双侧视力障碍4例,伴有视野缺损者7例;以头痛为临床表现者11例;以癫发作为临床表现者4例,其中大发作3例、小发作1例;肢体活动障碍者3例;嗅觉减退者1例;嗅觉丧失者1例。
1.3 影像学检查所有患者均于术前常规进行头颅电子计算机体层扫描(computerized tomography,CT)平扫、磁共振成像(magnetic resonance imaging,MRI)和MRI增强扫描检查,通过CT血管造影(computed tomography angiography,CTA)或磁共振血管造影(magnetic resonance angiography,MRA)及磁共振静脉造影(magnetic resonance venogram,MRV)检查以明确肿瘤与主要血管的关系。6例患者CTA检查提示肿瘤血供较丰富,行数字减影血管造影(digital subtraction angiography,DSA)检查明确该肿瘤的主要供血动脉。肿瘤实体位于蝶骨嵴内1/3者17例、鞍结节者9例、前床突者5例、海绵窦者3例。瘤体与动眼神经和视神经紧密粘连者8例、与海绵窦关系紧密者6例。典型病例的术前影像学检查结果见图 1。

|
图 1 典型病例的术前影像学检查结果 52岁女性患者. A:术前MRI增强扫描; B:术前CT平扫 |
1.4 手术方法与术后处理
所有病例均采用翼点或扩大翼点入路行显微外科手术。患者取仰卧位头架固定后,向对侧偏10°~20°,并后仰20°~30°,额叶自然下垂,切口采用耳屏前方颧弓上至中线取弧形切口,切口的大小和形状可适当调整。注意分离脂肪垫时要充分保护面神经额支不受损害。用磨钻磨平蝶骨嵴。以蝶骨嵴为中心弧形剪开硬膜并严密悬吊后,显微镜下分离外侧裂,充分释放脑脊液,待颅内压力明显降低后轻柔抬起额颞叶,沿蝶骨嵴方向充分暴露肿瘤区域。对于瘤体较大、无法确定视神经或颈内动脉时,在切除肿瘤的同时处理肿瘤基底,肿瘤血供明显减少后再行瘤内减压。肿瘤切除后,要检查受累硬膜的程度和范围,必要时将其切除,用人工硬脑膜替代,还纳骨瓣,用颅颌面接骨板和接骨螺钉固定颅骨。术后立即进行CT检查,了解患者有无颅内出血及术中脑挫伤,若无上述2种情况发生,将患者送入神经外科重症监护病房(neurosurgery intensive care unit,NICU),给予常规神经外科术后治疗。术后72 h行头颅MRI检查,了解肿瘤切除情况。术后6个月复查头颅MRI增强扫描,了解有无肿瘤复发。本组病例中,3例患者手术区水肿较重,给予加强脱水治疗后好转。
1.5 术后随访术后采用门诊随访,随访时间24~48个月,平均(36±13)个月。
2 结果本组无手术死亡病例。术后常规送检的肿瘤标本进行病理学和免疫组织化学检查,结果示血管型者7例(20.6%)、脑膜瘤内皮型者19例(55.9%)、成纤维型者5例(14.7%)、砂粒型者3例(8.8%)。术后头颅影像学检查示肿瘤全切者24例(70.6%,Simpson Ⅰ级、Ⅱ级;图 2),肿瘤次全切者5例(14.7%,Simpson Ⅳ级),肿瘤部分切除者5例(14.7%)。对次全切的5例患者行伽玛刀放射治疗,每例患者平均治疗2次,严密随访3年肿瘤无明显复发。
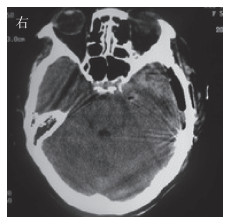
|
图 2 典型病例的术后影像学检查结果 与图 1为同一患者.术后CT平扫示肿瘤全切 |
预后优良者28例[Karnofsky(KPS)评分为80~100分],预后一般者6例(KPS评分为60~79分)。3例癫发作患者术后癫发作消失;1例患者术后遗留有癫发作,给予抗癫治疗后好转,发作频率明显降低。2例患者的肢体运动功能较术前明显改善,肌力较术前提高1级以上。术后视力改善者9例(其中5例术后平均视力较术前提高0.2以上)、视力恶化者2例,3例患者术后视力变化不明显。5例患者术后发生动眼神经麻痹,给予营养神经处理后症状好转。其余患者术后恢复良好,未发生明显的肢体活动障碍和内分泌紊乱等并发症。
3 讨论 3.1 鞍旁脑膜瘤影像学特点CT扫描检查时,鞍旁脑膜瘤一般表现为鞍旁圆形或卵圆形实性肿块,肿瘤实体常与正常脑组织有明显界限;CT增强扫描可见瘤体一般强化明显,部分瘤体会侵及相邻的骨质,骨质呈溶骨样变化。但CT扫描多为轴位图像,鞍区的骨质容易造成伪影,对于肿瘤的定性价值有限。在MRI图像上,鞍旁脑膜瘤的T1加权像呈低信号或等信号,T2加权像呈稍低、等信号或高信号。MRI增强扫描大部分呈均匀强化,这可能与脑膜瘤血供丰富、囊变坏死较少有关。近年国内外研究结果提示,上述现象很可能与患者脑膜瘤瘤体的血供、质地、病理分型等密切相关[5-7]。脑膜瘤增强扫描的“彗星尾”样表现可能与脑膜反应性增生、肿瘤浸润和血管增生后充血扩张有关[8]。MRV检查可提示主要回流静脉的情况,为术中保护侧裂区的静脉丛提供良好的影像学支持。对于瘤体较硬的实体肿瘤,其纤维成分含量较高,血供及含水量较少,因此手术切除相对容易[9];若MRI检查时T2加权像呈高信号,MRI增强扫描时强化明显,说明此类患者的瘤体血供较为丰富。在术中我们发现,此类患者的瘤体实质较软,病理结果显示以上皮型脑膜瘤为主。本组术中所见的肿瘤血供情况和瘤体的质地,以及静脉回流等与CT、MRI、MRV等影像学检查表现基本相符,可认为充分有效的影像学检查是必需的。近年来,随着CTA技术的发展,可在术前常规行CTA检查用以排除鞍旁巨大血管性疾病;并且CTA检查还可以提示颈内动脉、大脑中动脉与肿瘤的关系,为术者提供明确的解剖学信息。本组病例均在术前常规进行CTA或MRA检查,以排除鞍旁巨大血管性疾病;对提示肿瘤与颈内动脉、大脑中动脉关系密切的6例患者行DSA检查,其主要供血动脉予以Onyx胶栓塞,为避免术中大出血、安全切除肿瘤提供了保障。这与许多学者在切除肿瘤前行DSA检查,将主要供血动脉予以Onyx胶栓塞,手术切除肿瘤时取得较好临床效果的措施一致[5, 10]。
3.2 鞍旁脑膜瘤显微切除的操作体会手术入路的选择不仅要充分暴露瘤体及其周围神经血管等重要结构,还要最大程度地减少手术操作带来的损伤。翼点入路近年来已经被广泛应用于鞍旁脑膜瘤的手术中,研究表明相对于其他入路,对于肿瘤偏向一侧的鞍旁脑膜瘤,翼点入路优势明显[9, 11-13]。例如:额部骨窗边缘一般距离额窦较远,术后脑脊液漏鼻漏的发生率很低,本组无术后脑脊液漏发生;并且翼点入路对于肿瘤的显露效果一般来说很充分,基本可以不用过度牵拉额颞叶脑组织,减少了额颞叶脑挫伤的发生率;此外,操作时不用切断嗅束,因手术操作直接损伤嗅神经的可能性也很低,本组无嗅神经损伤发生。但该入路的不足之处是手术术野较小,对于瘤体位于视神经内侧和视交叉下方的肿瘤暴露不充分,很大程度上限制了该术式的应用[13]。我们的体会是与双侧额下入路相比,双侧额下入路可能对于术野暴露更加有利,但此入路手术创伤较大、出血较多、手术时间较长,且需要双侧额部开颅,均是其相对不足之处。当翼点入路难以完全显露双侧视神经及颈内动脉时,在手术操作中往往需根据肿瘤实体向前方及中颅窝延伸的程度而选择扩大翼点入路,必要时可以离断颧弓以增加显露。文献报道,双侧额下入路的肿瘤全切率高于翼点入路,但2种入路的视力改善情况及并发症发生率的差异无统计学意义[14]。
我们通过本组34例病例的实践体会到,术者在手术显微操作切除肿瘤时,其主要操作空间在视神经―颈内动脉间隙和颈内动脉―动眼神经间隙内进行,有时显微操作空间需要扩展到视交叉后间隙[8]。本组病例的肿瘤最大直径均≥3.3 cm,平均为(4.3±0.6)cm,最大瘤体最大直径为5.2 cm,肿瘤实体相对较大,因此直接处理肿瘤基底部的难度也较大。为此,我们采取的方法和切除步骤是:先对肿瘤进行瘤体内部分减压性切除,随着瘤体逐渐缩小,术野逐步扩大,最后再分块切除肿瘤,取得了较好的手术切除效果。在进行显微手术时,首要的关键步骤是确定和区分瘤体与周围组织的界面,沿着分界面逐步游离至肿瘤的边界,最后分块切除肿瘤,争取达到Ⅰ级切除[8]。电凝和显微切除掉肿瘤基底部后,我们通常一并将增生的脑膜切除,用人工硬脑膜严密修补,文献报道,这种处理方法可以明显降低脑膜瘤的复发率[9]。在术中显微操作时,由于瘤体实体包绕及侵及颈内动脉、视神经、大脑中动脉等重要解剖结构,在显微切除肿瘤时务必要仔细分离并严格保护上述重要结构。对于与神经和血管粘连紧密的肿瘤,不可强行剥离,以免发生灾难性的后果。对于术中发生血管痉挛,一般采用浸有罂粟碱的棉片覆盖在血管表面,并用罂粟碱生理盐水冲洗,这样的操作往往可以减轻血管的痉挛。
对于老年患者,长时间手术操作刺激常导致血管痉挛,甚至可引起大脑中动脉及颈内动脉梗死。本组有3例患者发生术后肢体活动受损,可能与豆纹动脉痉挛有关。当肿瘤侵及垂体柄,显微镜下锐性分离垂体柄与肿瘤粘连时,切记不可暴力撕裂或牵拉,以免术后产生严重的尿崩。本组病例中,无一例患者发生永久性尿崩。在本组病例中,9例患者为鞍结节脑膜瘤,其中有3例患者的肿瘤已经侵及骨质,部分瘤体已长入蝶窦。治疗这3例患者时,我们先磨开鞍结节,显微切除长入蝶窦内的瘤体后,使用肌块脑胶严密封闭蝶窦,然后再取相应大小的颅骨内板嵌入,最后用肌膜脑胶粘合行颅底重建[8]。术后随访(36±13)个月,无一例发生脑脊液漏,此方法的长期密封效果良好。对于肿瘤的全切率问题,我们认为术者必须以患者安全和减少神经功能损害为第一要务。在进行显微手术时,宁可残留少许与重要结构粘连紧密的无法切除的瘤体,也不要造成不可逆的神经功能的缺失,甚至损害患者的生命安全[13]。术后对残存瘤体是否进行放射治疗目前学术界尚有争议,但大多数学者认为应积极进行术后放射治疗,这样不但可以缩小瘤体,减少占位效应,并且能延缓残存肿瘤的复发和生长[8-11]。在本组诊治的34例病例中,5例患者为次全切除,且均采用伽玛刀放射治疗,随访3年未见肿瘤复发,表明放射治疗有效、安全,是显微手术十分有益的补充治疗。在关颅还骨瓣时,我们认为使用颅颌面接骨板加螺钉固定较好,因为颅骨锁固定骨瓣有可能引起硬膜外血肿。
2.3 巨大鞍结节脑膜瘤手术的视力保护问题鞍结节脑膜瘤患者多以不同程度视觉功能障碍就诊,因此手术治疗的一个重要目的是改善患者视觉功能。视神经长期受肿瘤压迫,可引起视神经相关微血管损伤以及脱髓鞘病变,造成不可逆损伤,即使手术切除肿瘤,患者视力恢复的可能性也较小[15]。国外学者指出,部分鞍结节脑膜瘤患者全切除后视力改善不理想,这是因为术后视力恢复与患者年龄、肿瘤大小、术前视力受累程度、病程长短等有关,手术的损伤往往是影响术后视力改善的关键因素之一[11]。术前视力低于0.02的患者视力往往难以恢复,鞍结节脑膜瘤术后视力改善率为25%~80%[12]。在本组病例中,9例患者的鞍结节脑膜瘤的最大直径为4.0~4.5 cm,术中发现因瘤体长期压迫视神经和动眼神经,视神经和动眼神经外形变薄、变细,显微镜下可见它们常常贴敷在瘤体表面,色灰白,很难与肿瘤包膜区分,因此在显微手术时应仔细分辨,以免损害视神经和动眼神经,造成严重的并发症。本组病例中,9例鞍结节脑膜瘤患者的瘤体巨大,常规术前行DSA检查发现此组患者的眼动脉、大脑前动脉等常增粗变形,可能与此血管参与肿瘤血供增加有关。上述血管走行因肿瘤推挤作用发生解剖学移位,血管走行更加迂曲,甚至出现血管走行改向,术中显微分离肿瘤时应仔细辨别,切不可损伤这2条重要的血管。对于视路上的渗血,用湿水的小块明胶海绵或棉片轻压止血,即可取得良好的效果,切不可用电凝止血。当视神经与肿瘤粘连紧密或被肿瘤包绕时,不强求全切肿瘤,因为保留重要的神经功能是神经外科医师必须遵守的第一要务[10]。9例鞍结节脑膜瘤患者术前均有不同程度视力障碍,术后视力较术前好转5例、无明显变化3例、恶化1例,视力改善率为55.6%。
总之,随着显微神经外科技术的发展,大型鞍旁脑膜瘤的显微手术全切率不断提高,本组的全切率为70.6%(24/34),手术并发症相对较少,术后大部分患者预后优良。通过本组病例的手术实践,我们认为对大型鞍旁脑膜瘤(最大直径≥3.3 cm)应采用显微手术切除,术前必要且充分的影像学诊断和信息提供、术中精细且轻柔的显微操作、术后对残余瘤体的必要放射治疗常有助于获得满意的手术效果。
| [1] | 袁盾, 刘定阳, 袁贤瑞, 姜维喜, 罗端午, 刘庆, 等. 鞍旁脑膜瘤显微手术疗效及远期复发分析[J]. 中南大学学报(医学版), 2013, 38: 699–703. |
| [2] | 刘定阳, 袁贤瑞, 刘庆, 杨治权, 彭泽峰, 姜维喜, 等. 蝶骨嵴内侧脑膜瘤显微手术治疗及切除程度影响因素分析[J]. 中国耳鼻咽喉颅底外科杂志, 2016, 22: 288–292. |
| [3] | NAKAGAWA A, OGAWA Y, AMANO K, ISHⅡ Y, TAHARA S, HORIGUCHI K, et al. Pulsed laser-induced liquid jet system for treatment of sellar and parasellar tumors:safety evaluation[J]. J Neurol Surg A Cent Eur Neurosurg, 2015, 76: 473–482. DOI: 10.1055/s-00000180 |
| [4] | ROMANI R, LAAKSO A, KANGASNIEMI M, NIEMELÄ M, HERNESNIEMI J. Lateral supraorbital approach applied to tuberculum sellae meningiomas:experience with 52 consecutive patients[J]. Neurosurgery, 2012, 70: 1504–1519. DOI: 10.1227/NEU.0b013e31824a36e8 |
| [5] | LIU D Y, YUAN X R, LIU Q, JIANG X J, PENG Z F, DING X P, et al. Large medial sphenoid wing mengingiomas:long-term outcome and correlation with tumor size after microsurgical treatment in 127 consecutive cases[J]. Turk Neurosurg, 2012, 22: 547–557. |
| [6] | 张敬泉, 李劲松, 陈坚. 鞍旁脑膜瘤的显微外科治疗[J]. 新医学, 2011, 42: 298–301. |
| [7] | 伍敏, 霍钢, 杨刚, 郑履平, 崔敏, 祝瑞, 等. 鞍区脑膜瘤的临床特征及手术治疗策略[J]. 重庆医科大学学报, 2015, 40: 88–91. |
| [8] | 秦汉, 龚杰, 张戈, 姚国杰, 黄成, 甘志强, 等. 鞍结节脑膜瘤的影像学特征及翼点锁孔手术治疗[J]. 中国临床神经外科杂志, 2014, 19: 641–644. |
| [9] | BITTER A D, STAVRINOU L C, NTOULIAS G, PETRIDIS A K, DUKAGJIN M, SCHOLZ M, et al. The role of the pterional approach in the surgical treatment of olfactory groove meningiomas:a 20-year experience[J]. J Neurol Surg B Skull Base, 2013, 74: 97–102. DOI: 10.1055/s-00000181 |
| [10] | KHAN O H, KRISCHEK B, HOLLIMAN D, KLIRONOMOS G, KUCHARCZYK W, VESCAN A, et al. Pure endoscopic expanded endonasal approach for olfactory groove and tuberculum sellae meningiomas[J]. J Clin Neurosci, 2014, 21: 927–933. DOI: 10.1016/j.jocn.2013.10.015 |
| [11] | ARIFIN M Z, MARDJONO I, SIDABUTAR R, WIRJOMARTANI B A, FARIED A. Pterional approach versus unilateral frontal approach on tuberculum sellae meningioma:single centre experience[J]. Asian J Neurosurg, 2012, 7: 21–24. DOI: 10.4103/1793-5482.95691 |
| [12] | 王强. 显微外科手术不同入路治疗颅脑鞍区肿瘤的预后探究[J]. 中外医疗, 2016, 8: 43–45. |
| [13] | 危晴天, 王煜. 45例鞍结节脑膜瘤显微手术治疗体会[J]. 湖北科技学院学报(医学版), 2016, 30: 322–324. |
| [14] | 雷鸣, 黄书岚. 鞍结节脑膜瘤的显微手术治疗[J]. 中国临床神经外科杂志, 2015, 20: 201–204. |
| [15] | 黄文彪, 潘亚文. 鞍结节脑膜瘤的手术策略及治疗进展[J]. 现代医药卫生, 2013, 29: 1665–1667. DOI: 10.3969/j.issn.1009-5519.2013.11.033 |
 2018, Vol. 39
2018, Vol. 39


