患儿,男,34个月,因“发现面色苍黄2个多月,咳嗽4 d”于2015年10月30日入院。患儿出生后9个月时因“狭颅症、脑积水”于外院行颅骨缝再造和颅骨整形术,术前体格检查发现双眼失明,术中查血红蛋白(Hb)为91 g/L;无面色苍黄,无气促,无口周青紫,无呕吐、腹胀,无茶色尿,无黑便,后未定期复查血常规。2015年9月19日因“长期便秘、面色苍黄2个月”至当地医院查血常规:Hb为51 g/L,未予特殊处理;2015年10月21日因“颅缝早闭术后”于当时接受手术治疗的医院复诊,查Hb为46 g/L,头颅CT扫描提示颅骨骨皮质增厚;上腹部CT(平扫+增强)扫描提示脾脏明显增大,所见肋骨、胸腰椎、骶髂骨等皮质增厚。未予特殊处理。2015年10月28日至我院查血常规:Hb为52 g/L。为进一步明确病因收治入院。
入院前视觉诱发电位检查结果显示左眼Pα波峰延迟,振幅下降大于50%,右眼波形低平,振幅下降约60%。遗传代谢病氨基酸和酰基肉碱谱分析未见明显异常。尿气相色谱-质谱有机酸检测未见明显异常。查血常规示:白细胞(WBC)计数为7.5×109/L、中性粒细胞比例为0.601、淋巴细胞比例为0.321、红细胞(RBC)计数为1.77×1012/L、Hb为46 g/L、血小板(PLT)计数为85×109/L、网织红细胞(ReT)比例为0.082 4。
入院体格检查:体温38.6 ℃,心率120/min,呼吸24/min,血氧饱和度98%,血压90/55 mmHg(1 mmHg=0.133 kPa)。神志清楚,精神可。头颅呈鞍状。面色苍黄,睑结膜、口唇、甲床苍白,巩膜无黄染。双侧眼球略突出,眼球活动存在,双眼无光感,瞳孔等圆(直径5 mm),直接和间接对光反射消失。心肺检查无明显异常。腹部膨隆,无压痛,全腹未触及包块,肝脏肋下2 cm,脾脏肋下6 cm,质韧、边界清,无触痛及压痛。四肢肌张力正常。神经系统检查未见明显异常。
入院后于2015年10月31日查血常规示:WBC计数为5.14×109/L、中性粒细胞比例为0.552、淋巴细胞比例为0.381,RBC计数为2.01×1012/L,Hb为53 g/L,PLT计数为82×109/L;血钙2.21(正常值2.15~2.62)mmol/L,磷1.22(正常值0.82~1.62)mmol/L,肌酸肌酶同工酶48(正常值0~25)U/L;肝肾功能未见明显异常;甲状旁腺激素(PTH) 94.03(正常值15~65)pg/mL;Torch病原体[弓形虫(TOX)、风疹病毒(RV)、巨细胞病毒(CMV)、单纯疱疹病毒(HSV)]检查均阴性;Coomb’s试验直接法和间接法均阴性。2015年11月4日)胸部正位X线片检查示:骨质密度普遍增高(图 1A),考虑石骨症可能,代谢性疾病或氟中毒待排。2015年11月5日左手尺桡骨正侧位X线片检查示骨密度不均匀增高(图 1B);血红蛋白病系统分析结果示:红细胞形态异常,体积偏小,大小不一,易见椭圆形、棒状、泪滴形红细胞,少量长棘突、球形红细胞,偶见蘑菇型红细胞;红细胞膜病诊断试验结果显示部分指标阳性,酸化甘油溶血试验90 s (正常值>290 s),细胞形态异常。
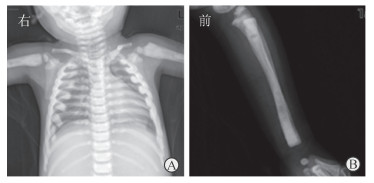
|
图 1 患儿胸部正位和左手尺桡骨正位X线片 A:患儿胸部正位X线片示肋骨及各椎骨密度明显增高; B:患儿左侧尺桡骨正位X线片示尺桡骨密度明显增加且部分髓腔骨化 |
入院后眼科会诊:双眼无光感,瞳孔等圆(直径5 mm),对光反射消失;眼底视盘苍白,视网膜平。诊断为双眼视神经萎缩。综合临床表现及相关检查临床诊断为:贫血(重度),石骨症,上呼吸道感染,PLT减少症,心肌损害,双侧视神经萎缩。入院后给予输血2次(100 mL和180 mL),Hb升至正常后于2015年11月10日出院。出院后多次于当地医院查血常规示Hb降低,予输血维持治疗。
2 讨论石骨症又称大理石骨病、原发性脆性骨硬化病,是由于破骨细胞分化异常致破骨细胞功能障碍而出现的一种髓腔骨化性疾病,属于少见病,发病率约1/25万[1],在我国其发病率尚缺乏确切的统计。石骨症是一种遗传性骨发育障碍性疾病,其遗传方式有3种:常染色体显性、常染色体隐性及X连锁[1]。常染色体隐性遗传的石骨症多自婴儿出生后数月发病,是一种威胁生命的石骨症基因表型,故又称婴儿恶性石骨症(infantile malignant osteopetrosis,IMO)。IMO分为富破骨细胞型及贫破骨细胞型2种病理类型。目前研究已证实至少有10余种基因与石骨症相关,其中T淋巴细胞免疫调节因子1(TCIRG1)、氯离子通道蛋白7(CLCN7)、骨硬化症相关跨膜蛋白1(OSTM1),分拣连接蛋白10(SNX10)及血小板白细胞C激酶底物同源结构域M1(PLEKHM1)主要与富破骨细胞型IMO有关,肿瘤坏死因子配体超家族成员11(TNFSF11)及肿瘤坏死因子受体超家族成员11(TNFRSF11)被证实与贫破骨细胞型IMO关联更大[2]。在临床表现方面,IMO多表现为不同程度的体型矮小、巨头畸形、脑积水、听觉和视觉减退或丧失、严重龋齿、肝脾大等,巨头畸形和额部突起多在出生后1年内出现,表现为特征性面容;同时,颅骨的改变可导致后鼻孔狭窄和脑积水[3]。严重者常因髓腔骨化导致造血功能减退或丧失,出现致死性贫血。反复感染也是IMO的重要死因。本例患儿具有多个IMO临床特征,如颅骨畸形、脑积水、失明、肝脾大、重度贫血、PLT计数减少,较以往报道病例的临床表现更具典型性及特征性。
目前,石骨症的诊断主要依靠影像学检查明确。石骨症的X线检查表现特点如下[1]:(1)弥漫性硬化,多累及颅骨、脊柱骨盆及四肢;(2)长骨干骺端立体感缺如,呈漏斗状外观或者透明环;(3)“骨中骨”貌,在椎骨和指(跖)骨尤为明显;(4)颅底、骨盆及椎骨多发性硬化,如“三明治”椎骨。石骨症的基因检测费用高昂,加之目前较多临床医师对其了解不足而使其应用受到限制。同时,骨组织切片病理活组织检查对区分常染色体隐性遗传型IMO为贫破骨细胞型还是富破骨细胞型具有重要意义,但操作有创,因而也很少在临床中应用。
在石骨症的治疗方面,目前并无特异且有效的药物,对于早期发现和确诊的石骨症患儿主要以多学科联合治疗及针对并发症的治疗为主,如积极预防骨折的发生、输血治疗纠正贫血、防治感染等。定期的眼科随访检查如视觉诱发电位监测视神经萎缩对失明的防治有重要意义[4]。常染色体隐性遗传IMO致死率高,造血干细胞移植成为其有效且重要的治疗手段,一项相关的调查研究显示,人类白细胞抗原(HLA)配型完全相合的受助者5年内无病生存率约为88%,而HLA匹配的无关受助者及HLA不完全匹配的受助者5年无病生存率分别是80%和66%[5],但也存在着移植排斥、延迟造血、静脉闭塞征、肺动脉高压及高钙血症等移植并发症[6],这些并发症也是干细胞移植后常见的死因。在造血干细胞移植后的视力恢复方面,一项国外回顾性研究显示,只有7%(3/42)的IMO移植者有远期视力的提高或者一定程度的恢复,69%(29/42)的移植者视力无远期退化,但24%(10/42)的移植者存在远期视力退化[7]。对于存在神经退行性病变的患者,造血干细胞移植对神经的恢复无实质性意义[8]。在移植时间方面,一项早期国外研究显示,越早的造血干细胞移植对预后越好,尤其在出生后3个月内移植对先天性IMO的治疗有至关重要的意义[9]。对于脐带血细胞移植治疗石骨症,由于目前人们对脐带血留取尚无全民意识,因此国内外对此法治疗石骨症的确切疗效尚无相关报道。
对没有合适HLA配型但要求有效治疗的患者,在基因治疗的基础上,造血干细胞基因修饰不失为一项有效的治疗选择。研究显示,在石骨症患者外周血中,因其增生的髓外造血致该病的外周血CD34+细胞数量较正常人明显升高[10],同时,增生的髓外造血使这些前体细胞的基因修饰工程相对简单,也使髓腔严重缩减患者的骨髓穿刺术更易操作。目前该技术的可行性仅在小鼠得以证实,其可通过特定基因载体的表达提高小鼠的骨再生[11],但这种载体的不良反应——致瘤源性在一项临床试验[12]中被证实。
本例患儿在出生后相继出现失明、脑积水、颅骨畸形、贫血、肝脾肿大表现,结合外院及本院的影像学及其他相关检查,IMO诊断依据充足,必要时还应完善该患儿及其相关家族基因检测以进一步明确基因分型。
随着医疗技术及临床诊断水平的提高,石骨症诊断已非难事。但该病的少发性及临床医师对该病的认识不足导致许多IMO患儿不能早期诊断,从而延误最佳治疗时机。因此,临床应增加对IMO的认识以早期诊断、早期救治。
| [1] | STARK Z, SAVARIRAYAN R. Osteopetrosis[J/OL]. Orphanet J Rare Dis, 2009, 4:5. doi:10.1186/1750-1172-4-5. |
| [2] | SOBACCHI C, SCHULZ A, COXON F P, VILLA A, HELFRICH M H. Osteopetrosis:genetics, treatment and new insights into osteoclast function[J]. Nat Rev Endocrinol, 2013, 9: 522–536. DOI: 10.1038/nrendo.2013.137 |
| [3] | AL-TAMIMI Y Z, TYAGI A K, CHUMAS P D, CRIMMINS D W. Patients with autosomal-recessive osteopetrosis presenting with hydrocephalus and hindbrain posterior fossa crowding[J]. J Neuros Pediatr, 2008, 1: 103–106. DOI: 10.3171/PED-08/01/103 |
| [4] | HWANG J M, KIM I O, WANG K C. Complete visual recovery in osteopetrosis by early optic nerve decompression[J]. Pediatr Neurosurg, 2000, 33: 328–332. DOI: 10.1159/000055980 |
| [5] | SCHULZA S, MOSHOUS D, STEWARD C, HOENIG M, SCHUETZ C, SOBACCHI C, et al. Osteopetrosis:a heterogeneous group of diseases requiring individualized therapeutic strategies-results of the osteopetrosis registry on behalf of ESID and EBMT[J]. Bone Manow Transpl, 2013: S22–S23. |
| [6] | STEWARD C G, PELLIER I, MAHAJAN A, ASHWORTH M T, STUART A G, FASTH A, et al. Severe pulmonary hypertension:a frequent complication of stem cell transplantation for malignant infantile osteopetrosis[J]. Br J Haematol, 2004, 124: 63–71. DOI: 10.1046/j.1365-2141.2003.04739.x |
| [7] | DRIESSEN G J, GERRITSEN E J, FISCHER A, FASTH A, HOP W C, VEYS P, et al. Long-term outcome of haematopoietic stem cell transplantation in autosomal recessive osteopetrosis:an EBMT report[J]. Bone Marrow Transpl, 2003, 32: 657–663. DOI: 10.1038/sj.bmt.1704194 |
| [8] | STEWARD C G. Neurological aspects of osteopetrosis[J]. Neuropathol Appl Neurobiol, 2003, 29: 87–97. DOI: 10.1046/j.1365-2990.2003.00474.x |
| [9] | FRATTINI A, BLAIR H C, SACCO M G, CERISOLI F, FAGGIOLI F, CATÒ E M, et al. Rescue of ATPa3-deficient murine malignant osteopetrosis by hematopoietic stem cell transplantation in utero[J]. Proc Natl Acad Sci USA, 2005, 102: 14629–14634. DOI: 10.1073/pnas.0507637102 |
| [10] | STEWARD C G, BLAIR A, MOPPETT J, CLARKE E, VIRGO P, LANKESTER A, et al. High peripheral blood progenitor cell counts enable autologous backup before stem cell transplantation for malignant infantile osteopetrosis[J]. Biol Blood Marrow Transplant, 2005, 11: 115–121. DOI: 10.1016/j.bbmt.2004.11.001 |
| [11] | JOHANSSON M K, DE VRIES T J, SCHOENMAKER T, EHINGER M, BRUN A C, FASTH A, et al. Hematopoietic stem cell-targeted neonatal gene therapy reverses lethally progressive osteopetrosis in oc/oc mice[J]. Blood, 2007, 109: 5178–5185. DOI: 10.1182/blood-2006-12-061382 |
| [12] | NALDINI L. Ex vivo gene transfer and correction for cell-based therapies[J]. Nat Rev Genet, 2011, 12: 301–315. DOI: 10.1038/nrg2985 |
 2018, Vol. 39
2018, Vol. 39


