2. 安徽医科大学研究生院, 合肥 230032;
3. 陆军军医大学(第三军医大学)大坪医院野战外科研究所第四研究室, 创伤烧伤与复合伤国家重点实验室, 重庆 400042;
4. 海军总医院海战伤救治研究中心, 北京 100048
2. Graduate School, Anhui Medical University, Hefei 230032, Anhui, China;
3. The Fourth Research Room of Field Surgery Institute, State Key Laboratory of Trauma, Burns and Combined Injury, Daping Hospital, Army Medical University(Third Military Medical University), Chongqing 400042, China;
4. Navy War Treatment Research Center, Navy General Hospital, Beijing 100048, China
体温过低症是野外医学救援面临的重要疾病,欧洲和北美洲国家每年因体温过低症死亡的人数约3 000人[1-2]。海难时海水浸泡导致的体温过低症的发生率很高[3]。普通搜救船只通常无腹腔灌洗、体外膜肺氧合等先进主动体内复温设备,更无专业医务人员,此种情况下对海水浸泡致伤的重度低温伤员是否采用简单的热水浴复温方法尚存争议[4]。为防止体温后降效应,通常不建议对重度低温伤员进行体表复温[5-6],但偶有热水浴复温成功的报道[7-8],因而热水浴并不是重度低温伤员海上紧急复温的禁忌,我们应该对热水浴复温的适用范围和最佳参数进行深入研究。本研究通过建立大鼠不同时长低温海水浸泡体温过低症模型,观察了不同热水浴复温方法的复温效果和复温曲线特征,并检测了血清学相关指标,以期为热水浴复温在海水浸泡重度体温过低症救治中的可行性及其注意事项提供依据。
1 材料和方法 1.1 实验动物雄性SD大鼠由陆军军医大学(第三军医大学)大坪医院野战外科研究所动物实验中心提供,实验动物生产许可证号:SCXK(渝)2012-0005,使用许可证号:SYXK(渝)2012-0010。动物饲养期间通风状况良好,温度控制在(23±2)℃,相对湿度控制在(60±10)%,照明时间为12 h/d(8:00至20:00)。实验方案经海军总医院动物实验伦理委员会批准。
1.2 实验前准备采用iButton® DS1922L型温度记录器(美国Dallas公司),设置温度记录的启动时间为预期低温浸泡实验前8 h,温度记录频次1次/min;置入80 ℃融化石蜡中浸泡3 s,取出冷却,再于75%乙醇中浸泡消毒30 min供手术用。实验前15 d麻醉大鼠,备皮消毒后在右上腹开2 cm长切口,将预处理后的温度记录器置入腹腔,缝合切口并涂抹红霉素软膏。大鼠苏醒后单笼饲养,每天给予青霉素钠20万单位腹腔注射,连续3 d。术后第15天,选取手术切口愈合良好、体质量稳定增长、活动自如、饮食排便良好的大鼠作为实验动物。实验前12 h禁食,自由饮水。
1.3 降温与复温方法将大鼠放入自制圆柱形竖立固定鼠笼内,鼠笼横切面周长与大鼠腹围相近,以防止大鼠头部自行向下淹溺,或在大鼠意识丧失后仍有较好的固定效果防止淹溺;且鼠笼底座带分叶,防止长时间浸泡过程中鼠笼侧倒而发生大鼠淹溺。然后将鼠笼置入(15.0±0.2)℃人工海水(低温海水;海盐购自广州益尔生物工程有限公司,按比例配制成盐度为3%)中浸泡,浸泡深度为锁骨水平。被动复温:低温海水浸泡结束后将大鼠取出固定鼠笼,用干毛巾简单擦去身上水分,然后放置在铺有垫料的鼠笼内,室温保持在20 ℃,使其自主恢复体温,且在此过程中给予充足水和饲料。主动复温(热水浴复温):低温海水浸泡结束后将大鼠连同其固定鼠笼一起移至37 ℃或者42 ℃恒温水浴箱内,浸泡深度为锁骨水平,达到预定时间后将其从固定鼠笼取出,用干毛巾简单擦去身上水分,然后放入鼠笼内,室温保持在20 ℃,期间给予充足水及饲料。
1.4 实验流程及统计指标取490只雄性SD大鼠,体质量(294.9±14.5)g,随机分为浸泡组(450只)和对照组(40只)。浸泡组根据低温海水浸泡时长再分为2 h组(100只)、5 h组(150只)、10 h组(200只),将大鼠置入自制固定鼠笼中,同时在低温海水中分别浸泡相应时长,记录大鼠低温海水浸泡期间的存活率。各组存活大鼠再随机均分为5个亚组:被动复温组、37 ℃主动复温0.5 h组、37 ℃主动复温1 h组、42 ℃主动复温0.5 h组、42 ℃主动复温1 h组,并给予相应的方法复温,观察大鼠死亡情况,在大鼠复温20 h后仍存活且活动良好者视为复温成功。对照组不进行海水浸泡,随机均分为4个亚组,分别给予上述4种热水浴复温方法。
计算各组的复温成功率,实验过程中如大鼠死亡则立即解剖取出温度记录器。实验结束后用1.5%戊巴比妥钠腹腔注射麻醉存活大鼠,剪开腹腔,腹主动脉抽血,1 006.08×g离心,取上清液送陆军军医大学(第三军医大学)大坪医院检验科检测肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)、丙氨酸转氨酶(alanine aminotransferase,ALT)、乳酸脱氢酶(lactate dehydrogenase,LDH)水平;取出温度记录器,读取动态腹腔温度数据,计算被动复温速度、热水浴复温迟发后降效应等。被动复温速度=[37 ℃(正常大鼠)或复温曲线拐点温度(死亡大鼠)-初始复温温度]/复温至37 ℃或复温曲线拐点温度所需时间。热水浴复温迟发后降效应幅度=37 ℃-后降最低点温度;迟发后降效应时长=热水浴复温结束后体温开始下降至最后再恢复至37 ℃所需时间;迟发后降总效应=迟发后降效应幅度×迟发后降效应时长。
1.5 统计学处理应用SPSS 17.0软件进行数据分析。计量资料用x±s表示,多组间比较采用单因素方差分析(ANOVA),两两比较采用Student-Newman-Keuls(SNK)检验;两组间比较采用独立样本t检验。存活率及复温成功率比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 低温海水浸泡大鼠存活率大鼠经低温海水浸泡后腹腔温度快速下降,1.5 h左右腹腔温度接近17 ℃时大鼠开始出现意识模糊、肌颤消失等症状。2 h时大鼠腹腔温度接近16 ℃,随着浸泡时间的延长,大鼠腹腔温度维持在此水平。低温浸泡期间的大鼠存活率随浸泡时间的延长而逐渐下降,浸泡5 h组和浸泡10 h组的存活率与浸泡2 h组比较差异均有统计学意义(P均<0.05,表 1)。
|
|
表 1 各组大鼠的存活率和复温成功率比较 |
2.2 大鼠被动复温及主动复温成功率
随浸泡时间延长,大鼠被动复温成功率逐渐下降,浸泡5 h组和浸泡10 h组的复温成功率与浸泡2 h组比较差异均有统计学意义(P均<0.05)。采用相同热水浴复温方法,随浸泡时间延长,大鼠复温成功率也逐渐下降,在浸泡5 h和10 h时,37 ℃主动复温0.5 h组和42 ℃主动复温1 h组的复温成功率与浸泡2 h时比较差异均有统计学意义(P均<0.05);当大鼠浸泡时长相同时,37 ℃主动复温1 h组的复温成功率最高,在浸泡5 h和10 h时其复温成功率高于42 ℃主动复温1 h组(P均<0.05),也高于被动复温组(P<0.05)。结果表明37 ℃热水浴主动复温1 h的复温效果最好。对照组按相同热水浴条件主动复温均存活,与浸泡组相比,低温海水浸泡时间越长,复温成功率差异越明显,在浸泡10 h时37 ℃主动复温0.5 h组和42 ℃主动复温1 h组的复温成功率、在浸泡5 h时42 ℃主动复温1 h组的复温成功率与对照组比较差异均有统计学意义(P均<0.05)。见表 1。
2.3 不同方式复温20 h后存活大鼠血清酶学改变随着浸泡时间的延长,被动复温存活大鼠血清酶学指标CK-MB、ALT和LDH水平逐渐升高,浸泡5 h组和浸泡10 h组这3个指标的水平与浸泡2 h组比较差异均有统计学意义(P均<0.05)。采用相同热水浴复温方法,随着浸泡时间延长,存活大鼠血清CK-MB、ALT和LDH水平逐渐升高,在浸泡2 h、5 h和10 h时所有主动复温组这3个指标的水平与对照组比较差异均有统计学意义(P均<0.05)。当大鼠浸泡时长相同时,37 ℃主动复温1 h组存活大鼠血清CK-MB、ALT和LDH水平低于其他主动复温组,大部分差异有统计学意义(P均<0.05);37 ℃主动复温1 h组这3个指标的水平低于被动复温组,部分结果差异有统计学意义(P<0.05)。见表 2。
|
|
表 2 不同方式复温20 h后存活大鼠血清酶学指标变化 |
2.4 大鼠被动复温速度
如表 3所示,随着浸泡时间的延长,大鼠被动复温速度逐渐下降,浸泡5 h和浸泡10 h组的复温速度与浸泡2 h组比较差异均有统计学意义(P均<0.05);在相同的浸泡时长,存活大鼠的复温速度较死亡大鼠快,差异有统计学意义(P<0.05)。典型被动复温大鼠腹腔温度曲线见图 1。
|
图 1 低温海水浸泡大鼠被动复温典型腹腔温度曲线 |
|
|
表 3 低温海水浸泡不同时长大鼠被动复温速度 |
2.5 大鼠主动复温迟发后降效应
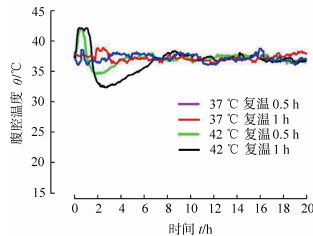
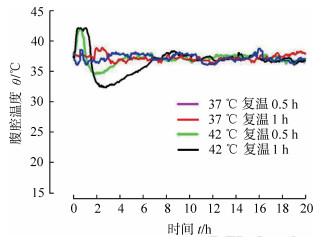
浸泡组热水浴主动复温结束后大鼠腹腔温度均出现迟发后降效应,结果见表 4。随浸泡时间延长,总后降效应增大,且37 ℃主动复温1 h组小于主动复温其他3组(P均<0.05),42 ℃主动复温0.5 h组小于42 ℃主动复温1 h组(P<0.05)。迟发后降效应越大,死亡率越高。对照组37 ℃热水浴迟发后降效应不明显,42 ℃热水浴较明显,且42 ℃主动复温0.5 h组总后降效应小于42 ℃主动复温1 h组(P<0.05)。浸泡组和对照组典型主动复温腹腔温度曲线见图 2、图 3。

|
图 2 低温海水浸泡大鼠37 ℃(A)和42 ℃ (B)热水浴复温典型腹腔温度曲线 a:迟发后降效应幅度; b:迟发后降效应时长 |
|
图 3 对照组大鼠热水浴典型腹腔温度曲线 |
|
|
表 4 低温海水浸泡大鼠主动复温迟发后降效应(总后降效应) |
3 讨论
麻醉与否是区别意外性体温过低症和治疗性低温的一个重要特征,通常麻醉状态下程序化的低温处理对于人体的损伤明显小于野外环境中低温对人的直接损伤[9-10],且意识是判断复温效果的重要指标,应用未经麻醉大鼠建立模型更能反映真实海水浸泡体温过低症病理生理改变并有助于观察复温效果。未麻醉大鼠实验前期活动频繁,不适宜采用传统的测温方式来监测大鼠的核心温度,本研究采用腹腔提前放置温度记录器的方法获取未麻醉大鼠的连续腹腔温度变化曲线,避免了频繁测温对低温海水浸泡实验的影响[11-12]。人核心体温(通常指肛温)在28 ℃以下即为重度低体温,大鼠通常比人更能耐受低温,当大鼠的核心温度达到28 ℃时生存几乎不受影响,因而科学家们习惯将肛温下降至15 ℃左右作为大鼠重度体温过低症的标准[13-14],本研究中未麻醉大鼠模型腹腔温度最终均稳定在15~16 ℃,且出现意识模糊、肌颤消失等症状,属重度海水浸泡性体温过低症。
海难中海水浸泡体温过低症发生时,附近搜救的商船大多数并没有高级复温设备和专业的医疗人员,而现场的急救与复温对于伤员的救治成功至关重要[15-16]。我们在实验中发现采取最优热水复温方法即37 ℃热水浴复温1 h,大鼠的救治成功率明显高于被动复温组,因此在紧急情况下可以采用热水浴复温作为重度低温伤员的复温措施,降低低温伤员的死亡率。在体表复温早期,机体核心体温常常会先出现暂时性下降然后再恢复的过程,称之为后降效应,后降效应可引起低温伤员病情的恶化甚至死亡。大多数人认为,早期发生的后降效应是因为当复温开始后外周血管开放增多,冷血内流导致了机体核心体温的短暂下降,而本实验中大鼠并没有出现明显的复温早期的后降效应,因此该理论是否成立尚值得商榷,但也有可能本研究的阴性结果与大鼠体壁薄、热传导快有关,或者与测温方法单一、没有反映机体温度的梯次变化有关,需要在大动物中并采用多点测温的方法进行验证。
海水浸泡体温过低症首先要对伤员的伤情进行准确评估,然后根据伤情分级选择不同的复温措施。体温过低症的分级主要依据核心体温的高低[17-18],有研究者对该分级方法提出了不同意见,Deslarzes等[19]认为核心体温的高低并不能完全反映低温损伤的程度,轻度低温伤员采用体表复温有可能出现死亡,重度伤员采用体表复温反而仍有可能成功。本实验中随着大鼠浸泡时间的延长,低温浸泡存活率、被动复温及主动复温成功率均降低,存活大鼠的反映机体损伤的重要血清学指标也异常升高,可见低温对机体损伤严重程度与低温持续时间密切相关,具有时间累积效应;因此,将低温持续时间纳入伤情判断标准势在必行。被动复温速度可反映机体自主体温恢复能力,15 ℃海水浸泡2 h大鼠核心体温刚好到达目标低温,其被动复温速度明显高于浸泡5 h、10 h组;另外,浸泡5 h和10 h存活大鼠被动复温速度大于死亡大鼠,说明被动复温速度可以反映机体能量代谢功能并可以作为临床伤情评价依据。重度低温症伤员可先给予肛温等核心温度的监测,在避免热量继续丢失的情况下观察其自主复温速度,如果自主复温在1 h内稳定上升说明患者自我恢复能力较强,不需要给予额外大幅度的体温复苏方式,如果短时间内核心温度升高不大,说明其自我恢复体温的能力丢失严重,需要辅助给予体表复温或者主动体内复温;在短时间内低温伤员体温有一定恢复且无其他不良反应时,可继续给予被动复温或者较温和的主动复温,以尽量减少激进复温措施可能带来的各种并发症[20]。
虽然本实验中大鼠并没有出现早期的后降效应,然而当大鼠复温结束移至鼠笼后却出现了体温下降然后再恢复的过程,我们称之为迟发性后降效应,并且我们发现这种迟发后降效应与大鼠的死亡率密切相关,迟发效应幅度越大、持续时长越长,其死亡率越高,复温成功率越低。对照组37 ℃热水浴并没有发现明显的迟发后降效应,低温浸泡组即使复温成功率最高的37 ℃主动复温1 h组也会出现一定程度的迟发后降效应,且低温海水浸泡时间越长,迟发后降效应与浸泡时长密切相关,也是对机体低温损伤的反映。对照组42 ℃热水浴发现有明显的迟发后降效应,说明迟发后降效应与核心温度的异常升高也有明显关系,且42 ℃热水浴时间越长迟发后降效应越大,故迟发后降效应还反映不当复温对机体带来的额外损伤。42 ℃主动复温0.5 h后核心温度接近37 ℃,而37 ℃主动复温0.5 h核心温度尚未达到37 ℃,前者迟发后降效应较后者小,说明复温时目标温度太低也会引起迟发后降效应的增大。以上提示我们,在体温过低症伤员的热水浴复温过程中,水浴温度和时长异常重要,在使用37 ℃复温时可以适当延长水浴时间,在采用较高的水温进行水浴复温时,应根据核心温度的变化来调节复温时间,当核心温度达到37 ℃时应停止水浴或者降低水浴温度,避免核心温度继续升高带来的不良后果。
总之,热水浴作为一种重要的复温方法可以在海水浸泡性体温过低症的紧急救治中加以使用,但需严格控制复温水温和时长。然而,体温恢复正常后仍会发生大量的并发症,并伴随较高死亡率[21],与组织代谢密切相关的微环境温度的改变及血容量极速变化带来的缺血缺氧再灌注损伤可能导致低温再复温损伤,其机制尚需进一步研究。
| [1] | BROWN D J, BRUGGER H, BOYD J, PAAL P. Accidental hypothermia[J]. N Engl J Med, 2012, 367: 1930–1938. DOI: 10.1056/NEJMra1114208 |
| [2] | KOSIŃSKI S, DAROCHA T, GAŁĄZKOWSKI R, DRWIŁA R. Accidental hypothermia in Poland-estimation of prevalence, diagnostic methods and treatment[J]. Scand J Trauma Resusc Emerg Med, 2015, 23: 13. DOI: 10.1186/s13049-014-0086-7 |
| [3] | LI S, QIU C, SHI W, HUANG Y, GUI L. A survey of accidental hypothermia knowledge among navy members in china and the implications for training[J]. Int J Environ Res Public Health, 2016, 13(pii): E315. DOI: 10.3390/ijerph13030315 |
| [4] | SINGH T, HALLOWS K R. Hemodialysis for the treatment of severe accidental hypothermia[J]. Semin Dial, 2014, 27: 295–297. DOI: 10.1111/sdi.2014.27.issue-3 |
| [5] | RAHMAN S, RUBINSTEIN S, SINGH J, SAMIH M, BALSAM L. Early use of hemodialysis for active rewarming in severe hypothermia:a case report and review of literature[J]. Ren Fail, 2012, 34: 784–788. DOI: 10.3109/0886022X.2012.673466 |
| [6] | DOBSON J A, BURGESS J J. Resuscitation of severe hypothermia by extracorporeal rewarming in a child[J]. J Trauma, 1996, 40: 483–485. DOI: 10.1097/00005373-199603000-00032 |
| [7] | PETRONE P, ASENSIO J A, MARINI C P. Management of accidental hypothermia and cold injury[J]. Curr Probl Surg, 2014, 51: 417–431. DOI: 10.1067/j.cpsurg.2014.07.004 |
| [8] | DEBATY G, MOUSTAPHA I, BOUZAT P, MAIGNAN M, BLANCHER M, RALLO A, et al. Outcome after severe accidental hypothermia in the French Alps:a 10-year review[J]. Resuscitation, 2015, 93: 118–123. DOI: 10.1016/j.resuscitation.2015.06.013 |
| [9] | CONNOLLY E, WORTHLEY L I. Induced and accidental hypothermia[J]. Crit Care Resusc, 2000, 2: 22–29. |
| [10] | DELHAYE C, MAHMOUDI M, WAKSMAN R. Hypothermia therapy:neurological and cardiac benefits[J]. J Am Coll Cardiol, 2012, 59: 197–210. DOI: 10.1016/j.jacc.2011.06.077 |
| [11] | 杜庆东, 衣文秀, 杨明. 连续记录动物冬眠体温数据分析系统的研究[J]. 沈阳师范大学学报(自然科学版), 2014, 32: 88–91. DOI: 10.3969/j.issn.1673-5862.2014.01.019 |
| [12] | 杨明, 邢昕, 管淑君, 赵岩, 王子英, 王德华. 达乌尔黄鼠冬眠期间体温的变化和冬眠模式[J]. 兽类学报, 2011, 31: 387–395. |
| [13] | DIETRICHS E S, SCHANCHE T, KONDRATIEV T, GAUSTAD S E, SAGER G, TVEITA T. Negative inotropic effects of epinephrine in the presence of increased β-adrenoceptor sensitivity during hypothermia in a rat model[J]. Cryobiology, 2015, 70: 9–16. DOI: 10.1016/j.cryobiol.2014.10.012 |
| [14] | DIETRICHS E S, HÅHEIM B, KONDRATIEV T, SIECK G C, TVEITA T. Cardiovascular effects of levosimendan during rewarming from hypothermia in rat[J]. Cryobiology, 2014, 69: 402–410. DOI: 10.1016/j.cryobiol.2014.09.007 |
| [15] | ZAFREN K. Out-of-hospital evaluation and treatment of accidental hypothermia[J]. Emerg Med Clin North Am, 2017, 35: 261–279. DOI: 10.1016/j.emc.2017.01.003 |
| [16] | KOSIŃSKI S, DAROCHA T, JAROSZ A, ZELIAŚ A, ZIĘTKIEWICZ M, PODSIADŁO P, et al. Clinical course and prognostic factors of patients in severe accidental hypothermia with circulatory instability rewarmed with veno-arterial ECMO-an observational case series study[J]. Scand J Trauma Resusc Emerg Med, 2017, 25: 46. DOI: 10.1186/s13049-017-0388-7 |
| [17] | 陈丽娜, 奂剑波, 史成和, 韩志海. 海水浸泡性体温过低症的病理生理学研究进展[J]. 转化医学杂志, 2016, 5: 381–384. DOI: 10.3969/j.issn.2095-3097.2016.06.016 |
| [18] | PAAL P, GORDON L, STRAPAZZON G, BRODMANN MAEDER M, PUTZER G, WALPOTH B, et al. Accidental hypothermia-an update:the content of this review is endorsed by the International Commission for Mountain Emergency Medicine (ICAR MEDCOM)[J]. Scand J Trauma Resusc Emerg Med, 2016, 24: 111. DOI: 10.1186/s13049-016-0303-7 |
| [19] | DESLARZES T, ROUSSON V, YERSIN B, DURRER B, PASQUIER M. An evaluation of the Swiss staging model for hypothermia using case reports from the literature[J]. Scand J Trauma Resusc Emerg Med, 2016, 24: 16. DOI: 10.1186/s13049-016-0210-y |
| [20] | 张建, 陈伯华, 丁江舟. 体温过低的复温技术与装备[J]. 中华航海医学与高气压医学杂志, 2009, 16: 192–193. DOI: 10.3760/cma.j.issn.1009-6906.2009.03.025 |
| [21] | VAN DER PLOEG G J, GOSLINGS J C, WALPOTH B H, BIERENS J J. Accidental hypothermia:rewarming treatments, complications and outcomes from one university medical centre[J]. Resuscitation, 2010, 81: 1550–1555. DOI: 10.1016/j.resuscitation.2010.05.023 |
 2018, Vol. 39
2018, Vol. 39


