2. 海军军医大学(第二军医大学)东方肝胆外科医院泌尿外科, 上海 200438
2. Department of Urology, Eastern Hepatobiliary Surgery Hospital, Navy Medical University(Second Military Medical University), Shanghai 200438, China
不宁腿综合征(restless leg syndrome,RLS)是一种以受累的患肢深部酸、麻、痛、灼热感、虫爬样、瘙痒样等多种痛苦感觉为主要表现的发作性疾病[1]。慢性肾功能衰竭患者RLS的发病率为31.70%[2],高于普通人群的发病率(1.90%~4.60%)[3]。虽然该病诊断方法简单、诊断成本低,但由于缺乏对该病的认识,临床医师往往忽视RLS,患者不得不长时间承受病痛折磨,导致夜间血压升高、心血管事件增多、死亡率增加[3-5]。本研究旨在对维持性血液透析患者合并RLS的危险因素进行分析,现报告如下。
1 资料和方法 1.1 研究对象纳入2016年7月至2017年9月于海军军医大学(第二军医大学)东方肝胆外科医院血液净化中心行维持性血液透析的74例患者。纳入标准:(1)年龄≥18周岁;(2)意识清楚,智力正常,能配合完成问卷的填写;(3)患者自愿,依从性好,能积极配合。排除标准:(1)有严重的听力、言语功能障碍,不能配合完成调查者;(2)严重贫血、感染、心力衰竭及帕金森病患者。RLS诊断按照国际不宁腿综合征委员会(International Restless Legs Syndrome Study Group,IRLSSG)的诊断标准[6],其主要症状如下:(1)患者常有撕裂感、蚁走感、蠕动感、刺痛、烧灼感、疼痛、瘙痒感、腿发麻等腿部的不适感,有一种急迫的强烈要运动的感觉,并导致过度活动,活动后可缓解,多发生于下肢、大腿,上肢偶尔也可以出现,但小腿症状比较明显,通常为对称性;(2)在安静时发作,夜晚或休息一段时间后症状更为严重;(3)持续活动可缓解不适感;(4)症状在夜间加重,深夜达到高峰。本研究通过海军军医大学(第二军医大学)东方肝胆外科医院医学伦理委员会审批。
1.2 研究指标 1.2.1 一般资料收集患者的性别、年龄、是否合并糖尿病等基本资料及应用促红细胞生成素剂量、超滤量、干体质量等透析相关参数。
1.2.2 实验室指标应用日本Sysmex XN系列全自动五分类血细胞分析仪通过流式细胞术和电阻抗法测定血红蛋白;应用瑞士罗氏P800全自动生化分析仪通过溴甲酚绿法测定白蛋白,脲酶-紫外速率法测定血尿素氮,酶法测定血肌酐,胆固醇氧化酶法测定总胆固醇,选择性抑制法测定低密度脂蛋白胆固醇,离子选择电极法测定钾离子、钠离子、氯离子,比色法测定血清总钙、血清铁、不饱和铁结合力,磷钼酸紫外法测定无机磷,磷酸丙酮酸羟化酶法测定二氧化碳结合力,荧光免疫分析法测定脑钠肽;应用美国雅培i4000全自动化学发光免疫分析仪通过电化学发光法测定甲状旁腺激素(parathyroid hormone,PTH)、叶酸、维生素B12、铁蛋白水平。根据透析前后血尿素氮、肌酐等指标计算尿素清除指数(urea clearance index,Kt/V)和尿素下降率(urea reduction ratio,URR);Kt/V=透析器的清除率×透析时间/尿素分布容积,URR(%)=(透析前血尿素氮-透析后血尿素氮)/透析前血尿素氮×100%。根据血清铁、不饱和铁结合力计算铁饱和度,铁饱和度(%)=血清铁/(血清铁+不饱和铁结合力)×100%。
1.2.3 RLS评分依据2003 IRLSSG评分标准[6]。(1)您如何评价RLS给您带来的不适:十分严重?严重?中等?轻度?无?(2)您如何评价RLS给您带来的被动活动:十分严重(每周6~7d)?严重(每周4~5 d)?中等(每周2~3 d)?轻微(每周1 d或更少)?(3)活动后您腿或臀部的不适能缓解吗:十分严重(无缓解)?严重(轻微缓解)?中等(基本缓解)?轻微(完全缓解)?(4)因RLS导致的睡眠问题严重吗:十分严重(无法入睡)?严重(睡眠时间1~2 h)?中等(睡眠时间3~4 h)?轻微(睡眠时间5~6 h)?(5)由RLS导致的日间困倦、疲乏程度严重吗:十分严重(四肢发硬,双腿沉重,双手易发抖)?严重(有心慌、心悸、恶心、呕吐等生理反应)?中等(须较长时间休息才能恢复)?轻微(短时休息即可恢复)?(6)总体来看,您的RLS严重吗:十分严重?严重?中等?轻度?无?(7)您的RLS发作频率:十分严重(每周6~7 d)?严重(每周4~5 d)?中等(每周2~3 d)?轻微(每周1 d或更少)?无发作?(8)RLS发作时严重程度:十分严重(≥8 h发作/24 h)?严重(3~8 h发作/24 h)?中度(1~3 h发作/24 h)?轻微(<1 h发作/24 h)?无发作?(9)总体来看,RLS对您家庭、社交、工作的影响:十分严重(影响家庭生活)?严重(只在家庭中,无法进行社交和工作)?中等(社会活动明显减少,影响工作)?轻微(偶有影响)?(10)您是否因该病感到愤怒、抑郁、悲伤、易激惹,此情绪困扰对您的影响程度:十分严重(无法控制)?严重(少部分时间能控制)?中等(大部分时间能控制)?轻微(可以控制)?各项评分方法:十分严重为4分,严重为3分,中等为2分,轻度为1分,无为0分;总评分:十分严重为31~40分,严重为21~30分,中等为11~20分,轻微为1~10分,无症状为0分。
1.3 统计学处理采用SPSS 24.0软件进行数据分析。计量资料以x±s表示,计数资料以例数和百分比表示。对合并RLS和未合并RLS 2组间呈正态分布的计量资料的比较采用t检验,不服从正态分布计量资料的比较采用秩和检验;计数资料的比较采用χ2检验。对未合并RLS与合并RLS症状轻微、中等、严重、十分严重患者5组计量资料的两两比较采用配对t检验。以性别、年龄、糖尿病史及各项生化指标为协变量,以是否合并RLS为因变量行单因素logistic回归分析,将差异有统计学意义的变量纳入模型行多因素logistic回归分析,用后退法筛出主要相关因素。对主要相关因素绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积,找出最佳临界值对应的灵敏度和特异度。检验水准(α)为0.05。
2 结果 2.1 合并与未合并RLS维持性血液透析患者的临床特点分析共纳入维持性血液透析患者74例,其中男46例,女28例;年龄为21~87岁,平均(56.70±14.52)岁。按照IRLSSG的诊断标准,19例(25.68%)患者合并RLS,其中男性患者发病率为19.56%(9/46),女性患者发病率为35.71%(10/28),女性患者发病率高于男性患者,差异有统计学意义(χ2=4.38,P<0.05)。有3例合并RLS的患者行甲状旁腺切除术,术后PTH水平下降,RLS症状减轻。合并RLS与未合并RLS患者的性别、糖尿病比例、URR水平、血钙水平、血PTH>515.39 pg/mL比例差异均有统计学意义(P均<0.05),见表 1。
|
|
表 1 合并与未合并RLS维持性血液透析患者的临床特点 Tab 1 Characteristics of maintenance hemodialysis patients with or without RLS |
2.2 维持性血液透析患者合并RLS的单因素分析
由表 2可见,URR、血钙和血PTH与维持性血液透析患者合并RLS有关(P均<0.05)。
|
|
表 2 维持性血液透析患者合并RLS的单因素logistic回归分析 Tab 2 Univariate logistic regression analysis of RLS in maintenance hemodialysis patients |
2.3 合并RLS维持性血液透析患者各亚组与未合并RLS者血钙、血磷、PTH、URR的比较
合并RLS维持性血液透析患者中6例(8.10%)患者RLS症状轻微、5例(6.76%)症状中等、4例(5.41%)症状严重、4例(5.41%)症状十分严重。RLS症状严重组患者的血PTH水平高于其他各组(P均<0.05),各组间血钙、血磷、URR差异均无统计学意义(P均>0.05)。见表 3。
|
|
表 3 未合并RLS与症状轻微、中等、严重、十分严重RLS患者的血钙、血磷、PTH、URR比较 Tab 3 Comparison of serum calcium, phosphorus, PTH and URR between patients with mild, moderate, severe, very severe RLS and without RLS |
2.4 维持性血液透析患者合并RLS的多因素分析
由表 4可见,PTH>515.39pg/mL是维持性血液透析患者合并RLS的独立危险因素(P=0.03)。
|
|
表 4 维持性血液透析患者合并RLS的多因素logistic回归分析 Tab 4 Multivariate logistic regression analysis of RLS in maintenance hemodialysis patients |
2.5 PTH预测维持性血液透析患者合并RLS的ROC曲线
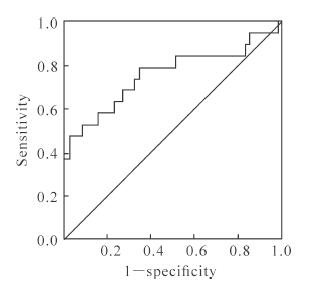
PTH临界值为515.39 pg/mL时,预测维持性血液透析患者是否合并RLS的ROC曲线下面积为0.759,其95% CI为0.610~0.907,灵敏度为0.47,特异度为0.98。见图 1。
|
图 1 PTH预测维持性血液透析患者合并RLS的ROC曲线 Fig 1 ROC curve of PTH for RLS in maintenance hemodialysis patients PTH: Parathyroid hormone; RLS: Restless leg syndrome; ROC: Receiver operating characteristic |
3 讨论
RLS是尿毒症血液透析患者常见的并发症之一,主要表现为腓肠肌深部难以忍受的不适感,静卧时加重,被动运动后缓解,严重者可伴有入睡困难、易醒、记忆力下降、注意力不集中等症状,这些症状反反复复,令患者痛苦不堪,甚至产生抑郁情绪[6-7]。本研究中维持性血液透析患者RLS发病率高达25.68%(19/74),说明RLS是影响尿毒症患者生活质量的重要因素之一。
目前有较多关于维持性血液透析患者合并RLS的危险因素分析的研究,结果差异较大。国外有研究证实,发展至重度RLS的患者中女性是男性的5.23倍[8],本研究结果也显示女性患者RLS的发病率高于男性,但单因素分析未提示性别与合并RLS有关。2000年MEMO研究认为,年龄是原发性RLS发病的危险因素[9]。但在慢性肾功能衰竭继发RLS患者中,年龄与RLS发病无关[10],与本研究结果一致。还有研究认为糖尿病是RLS发病的独立危险因素,合并2型糖尿病的血液透析并发RLS患者是非糖尿病患者的2.25倍[10]。但本研究纳入患者中仅8例合并糖尿病,其中2例发生RLS,单因素分析未提示糖尿病与合并RLS有关。
大多数研究认为贫血、铁缺乏、叶酸缺乏与RLS的发生密切相关[11-12]。具体机制可能是脑脊液中血清铁减少,转铁蛋白增加,脑细胞内转铁蛋白受体数量不能随血清铁的减少而反应性表达增加,且会明显减少[13]。铁相对不足是维持性血液透析患者的一个重要的临床特点,多个指南均推荐充分补充铁剂以辅助纠正肾性贫血。本研究中,合并RLS维持性血液透析患者的血红蛋白、血清铁、铁饱和度均低于未合并RLS者,铁蛋白高于未合并RLS者,但差异均无统计学意义,考虑可能与大部分患者的血红蛋白控制达标、体内铁剂充足、铁利用充分有关,可进一步行自旋回波、梯度回波、磁敏感等头颅磁共振特殊序列检查以评估脑组织内铁含量。本研究结果显示,合并RLS与未合并RLS组患者的叶酸、维生素B12水平均无明显差异,未证实叶酸、维生素B12水平低与RLS发病相关。促红细胞生成素是纠正肾性贫血的重要治疗药物,本研究中合并RLS与未合并RLS患者应用促红细胞生成素的剂量差异无统计意义,因此促红细胞生成素剂量与血液透析患者是否合并RLS无关,这与国外大部分研究结果[14-15]一致。
RLS的发病机制尚不明确,可能是多种因素共同作用的结果。原发性RLS的研究普遍认为患者对刺痛的敏感性增加、感觉阈值测定异常、明确有感觉神经病变,且维持性血液透析患者中周围神经病变也很常见[13]。由于透析不充分,大分子毒素贮积可导致周围神经发生脱髓鞘病变,减慢运动神经传导速度,损伤神经突触生理功能,导致信息加工和处理功能紊乱,引发运动和感觉异常[16]。通过血液透析联合血液灌流,使血清β2-微球蛋白等中、大分子毒素被有效清除,RLS症状缓解,疗效显著[17]。本研究显示合并RLS与未合并RLS患者的Kt/V均大于1.2、URR均大于65%,但合并RLS患者的Kt/V、URR均优于未合并RLS者,支持以往研究提出的小分子毒素可能不是RLS发生的致病因素的观点[17]。此外,本研究结果显示合并RLS患者的钾离子、钠离子、氯离子、二氧化碳结合力均与未合并RLS者无明显差异。
有研究探讨了慢性肾脏病-矿物质及骨代谢异常(chronic kidney disease-mineral and bone disorder,CKD-MBD)与血液透析患者合并RLS的关系,发现合并RLS血液透析患者的CKD-MBD指标明显异常,血磷、血PTH、成纤维细胞生长因子-23水平升高,25-羟维生素D3缺乏[14];矫正血红蛋白、年龄、性别因素后,血磷是RLS发生的独立危险因素[15]。本研究结果显示,合并RLS维持性血液透析患者的血钙高于未合并RLS患者,而2组血磷无明显差异;但随着RLS症状由轻微到十分严重,患者血钙、血磷逐渐升高,RLS十分严重患者的血PTH高于其他各组。多因素logistic回归分析显示,PTH>515.39 pg/mL是维持性血液透析患者合并RLS的独立危险因素,有明确的临床意义。国外已有研究通过行甲状旁腺切除术缓解RLS症状,术后患者血钙、血磷、血PTH均显著下降,25-羟维生素D3升高,RLS症状明显缓解[15]。但与其他国家相比,我国接受甲状旁腺切除手术治疗的比例较低,约为2%[18]。在国内受传统观念的影响,患者容易接受药物治疗,对手术治疗有抵触情绪。本研究中仅3例合并RLS的维持性血液透析患者行甲状旁腺切除术,术前PTH均大于1 000 pg/mL,RLS症状评分为十分严重,药物治疗及血液灌流均效果不佳,术后血PTH下降,RLS症状减轻。
本研究存在以下局限和不足:(1)本研究是单中心、小样本的临床试验;(2)本研究没有分析脑血管疾病对血液透析患者合并RLS的影响;(3)CKD-MBD相关指标还包括25-羟维生素D3、骨源性碱性磷酸酶、成纤维细胞生长因子-23等,尿毒症毒素还包括β2-微球蛋白及硫酸对甲酚、硫酸吲哚酚等蛋白结合毒素,因经费有限未进行检测;(4)因多数患者不同意行神经传导速度、神经电图H反射、神经电图F波、感觉阈值测定检查,本研究未探讨周围神经病变对合并RLS的影响。
综上所述,本研究认为RLS在血液透析患者中十分常见,女性发病率较高,PTH是维持性血液透析患者合并RLS的独立危险因素,PTH>515.39 pg/mL有明确的临床意义。临床中应进行量表评估、早期诊断、早期治疗,提高透析患者的生活质量。
| [1] | 中华医学会神经病学分会帕金森病及运动障碍学组. 不宁腿综合征的诊断标准和治疗指南[J]. 中华神经科杂志, 2009, 42: 709–711. DOI: 10.3760/cma.j.issn.1006-7876.2009.10.016 |
| [2] | CHAVOSHI F, EINOLLAHI B, SADEGHNIAT HAGHIGHI K, SARAEI M, IZADIANMEHR N. Prevalence and sleep related disorders of restless leg syndrome in hemodialysis patients[J/OL]. Nephrourol Mon, 2015, 7: e24611. doi: 10.5812/numonthly.24611. |
| [3] | KUTNER N G, ZHANG R, BLIWISE D L. Restless legs syndrome is underdiagnosed in the US Renal Data System[J]. QJM, 2013, 106: 487. DOI: 10.1093/qjmed/hct014 |
| [4] | SAKKAS G K, GIANNAKI C D, KARATZAFERI C, MARIDAKI M, KOUTEDAKIS Y, HADJIGEORGIOU G M, et al. Current trends in the management of uremic restless legs syndrome:a systematic review on aspects related to quality of life, cardiovascular mortality and survival[J]. Sleep Med Rev, 2015, 21: 39–49. DOI: 10.1016/j.smrv.2014.07.006 |
| [5] | UNRUH M L, LEVEY A S, D'AMBROSIO C, FINK N E, POWE N R, MEYER K B; Choices for Healthy Outcomes in Caring for End-Stage Renal Disease (CHOICE) Study. Restless legs symptoms among incident dialysis patients:association with lower quality of life and shorter survival[J]. Am J Kidney Dis, 2004, 43: 900–909. DOI: 10.1053/j.ajkd.2004.01.013 |
| [6] | ALLEN R P, PICCHIETTI D, HENING W A, TRENKWALDER C, WALTERS A S, MONTPLAISI J; Restless Legs Syndrome Diagnosis and Epidemiology Workshop at the National Institutes of Health; International Restless Legs Syndrome Study Group. Restless legs syndrome:diagnostic criteria, special considerations, and epidemiology[J]. Sleep Med, 2003, 4: 101–119. DOI: 10.1016/S1389-9457(03)00010-8 |
| [7] | TEKDÖŞ DEMIRCIOĞLU D, KAVADAR G, ESEN ÖRE Ö, EMRE T Y, YAKA U. Relationship between restless leg syndrome and quality of life in uremic patients[J]. Agri, 2015, 27: 73–78. |
| [8] | RAFIE S, JAFARI M, AZIZI M, BAHADORAM M, JAFARI S. Restless legs syndrome in hemodialysis patients[J]. Saudi J Kidney Dis Transpl, 2016, 27: 326–330. DOI: 10.4103/1319-2442.178553 |
| [9] | ROTHDACH A J, TRENKWALDER C, HABERSTOCK J, KEIL U, BERGER K. Prevalence and risk factors of RLS in an elderly population:the MEMO study. Memory and morbidity in Augsburg elderly[J]. Neurology, 2000, 54: 1064–1068. DOI: 10.1212/WNL.54.5.1064 |
| [10] | HAIDER I, ANEES M, SHAHID S A. Restless legs syndrome in end stage renal disease patients on haemodialysis[J]. Pak J Med Sci, 2014, 30: 1209–1212. |
| [11] | ZADEH SARAJI N, HAMI M, BOOSTANI R, MOJAHEDI M J. Restless leg syndrome in chronic hemodialysis patients in Mashhad hemodialysis centers[J]. J Renal Inj Prev, 2017, 6: 137–141. |
| [12] | PATRICK L R. Restless legs syndrome:pathophysiology and the role of iron and folate[J]. Altern Med Rev, 2007, 12: 101–112. |
| [13] | KOO B B, BAGAI K, WALTERS A S. Restless legs syndrome: current concepts about disease pathophysiology[J/OL]. Tremor Other Hyperkinet Mov (N Y), 2016, 6: 401. doi: 10.7916/D83J3D2G. |
| [14] | NEVES P D, GRACIOLLI F G, OLIVEIRA I B, BRIDI R A, MOYSÉS R M, ELIAS R M. Effect of mineral and bone metabolism on restless legs syndrome in hemodialysis patients[J]. J Clin Sleep Med, 2017, 13: 89–94. DOI: 10.5664/jcsm.6396 |
| [15] | SANTOS R S, COELHO F M, SILVA B C, GRACIOLLI F G, DOMINGUEZ W V, MENEZES MONTENEGRO F L, et al. Parathyroidectomy improves restless leg syndrome in patients on hemodialysis[J/OL]. PLoS One, 2016, 11: e155835. doi: 10.1371/journal.pone.0155835. |
| [16] | KRISHNAN A V, PHOON R K, PUSSELL B A, CHARLESWORTH J A, BOSTOCK H, KIERNAN M C. Altered motor nerve excitability in end-stage kidney disease[J]. Brain, 2005, 128(Pt 9): 2164–2174. |
| [17] | 史春红, 孙瑶, 李秀娟. 血液灌流联合加巴喷丁治疗维持性血液透析患者不宁腿综合征的临床疗效观察[J]. 中国中西医结合急救杂志, 2016, 23: 655–656. DOI: 10.3969/j.issn.1008-9691.2016.06.027 |
| [18] | 曾红梅, 肖跃飞. 甲状旁腺切除术在继发性甲状旁腺机能亢进症治疗中的临床意义[J]. 国际移植与血液净化杂志, 2016, 14: 8–10. |
 2018, Vol. 39
2018, Vol. 39


