2. 中国科学院上海巴斯德研究所, 上海 200031
2. Institute Pasteur of Shanghai, Chinese Academy of Sciences, Shanghai 200031, China
根据世界卫生组织2017年10月的实况报道,全球约有7 000万人感染丙型肝炎病毒(hepatitis C virus,HCV)[1],HCV感染已经成为一个世界性的公共卫生问题。多数HCV感染患者进展为慢性肝炎,部分患者甚至发展为肝纤维化、肝硬化和肝癌等[2]。HCV属于黄病毒科(Flaviviridae)HCV属(Hepacivirus),是一种具有包膜结构的单股正链RNA病毒[3],其编码区编码一种包含大约3 000个氨基酸的多聚蛋白,经蛋白酶切割后产生结构蛋白core、E1、E2、p7和非结构蛋白NS2、NS3、NS4A、NS4B、NS5A、NS5B[4]。
多配体聚糖结合蛋白1(syntenin-1)是一种包含突触后密度蛋白(postsynaptic density protein,disc large and zonula occludens,PDZ)结构域、可与多种分子相互作用的衔接蛋白[5],其参与了细胞内蛋白转运、细胞黏附、信号转导和肿瘤细胞转移等过程[6]。研究表明,syntenin-1参与调节人乳头瘤病毒和人免疫缺陷病毒的感染过程[7-8]。
Lussignol等[9]从2种不同的亲和纯化方法纯化得到的HCV病毒颗粒中检测到包括syntenin-1在内的46种宿主细胞来源蛋白质,并发现通过RNA干扰(RNA interference,RNAi)技术敲低syntenin-1表达不影响HCV在细胞内的复制以及释放到细胞外的病毒RNA量。因此,syntenin-1在病毒组装中所起的作用仍需要进一步研究。本研究旨在探讨syntenin-1对HCV颗粒组装的影响。
1 材料和方法 1.1 细胞培养与试剂人肝癌细胞系Huh7.5.1由美国斯克利普斯研究所Francis Chisari教授惠赠,人胚肾癌细胞系HEK 293T细胞由中国科学院上海巴斯德研究所钱志康研究员惠赠,人原代肝细胞免疫印迹蛋白样品(煮沸处理过的样品)由吉林大学白求恩第一医院惠赠,pWPI-syntenin-1-BLR、pWPI-GFP-BLR、pFK-Jc1-E2Flag、psPAX2和pMD2.5质粒由德国海德堡大学Ralf Bartenschlager教授惠赠。以上细胞均培养在含有10%胎牛血清、1%青霉素-链霉素、2 mmol/L非必需氨基酸的DMEM培养液中。β-Actin羊多抗(sc-1616)、syntenin-1鼠单抗(sc-100336)均购自美国Santa-Cruz Biotechnology公司。Tubulin鼠单抗(66031-1-lg)、syntenin-1兔多抗(22399-1-AP)和flag鼠单抗(M200081)均购自美国Proteintech公司。NS5A兔多抗、core兔多抗和T7聚合酶由本实验室自制。DMEM培养液购自美国Invitrogen公司,胎牛血清购自美国Gibco公司。蛋白质印迹分析ECL显色底物购自美国Bio-Rad公司。载脂蛋白E(apolipoprotein E,ApoE)ELISA检测试剂盒购自江苏科特生物科技有限公司。
1.2 过表达细胞系的构建将pWPI-syntenin-1-BLR或pWPI-GFP-BLR分别与psPAX2和pMD2.5包装质粒一起转染进HEK 293T细胞中,制备慢病毒并转导进入Huh7.5.1细胞中,加杀稻瘟菌素(blasticidin,BLR)筛选得到syntenin-1过表达细胞或绿色荧光蛋白(GFP)过表达细胞。
1.3 HCV RNA电转染取培养至90%融合度的细胞,胰酶消化后用新鲜DMEM培养液吹打成单细胞悬液并计数。取5×106个细胞,300×g离心5 min后用PBS重悬后再次离心。用cytomix缓冲液(96% cytomix+2% ATP+2%谷胱甘肽)重悬细胞,加入HCV RNA混匀后转移到4 mm电转杯中。在975 μF、270 V条件下进行电脉冲。将电脉冲后的细胞转移到含有10%胎牛血清、1%青霉素-链霉素、2 mmol/L非必需氨基酸的DMEM培养液中并于恒温培养箱中培养,培养72 h后用蛋白质印迹法检测病毒蛋白以确定电转成功并进行后续实验。
1.4 蛋白质印迹法样品用蛋白上样缓冲液裂解,90 ℃恒温金属浴中放置40 min。用12%十二烷(基)硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白样品,之后用半干转法将蛋白转移至聚偏二氟乙烯膜上,用5%脱脂奶粉溶液封闭1.5 h。加入一抗β-actin羊多抗(1:1 000)、syntenin-1鼠单抗(1:1 000)、Tubulin鼠单抗(1:10 000)、syntenin-1兔多抗(1:1 000)、flag鼠单抗(1:1 000)、NS5A兔多抗(1:5000)、core兔多抗(1:5 000),室温孵育1.5 h后用PBST洗膜4次,每次15 min,加入二抗室温孵育1.5 h。用PBST洗膜4次,使用蛋白质印迹分析显色底物显影。用ImageJ 1.41灰度分析软件计算灰度值。
1.5 病毒滴度测定在96孔板中每孔铺1×104个Huh 7.5.1细胞,每孔体积为100 μL,24 h后在96孔板第1行每孔中加入20 μL病毒液,之后每行按1:6的稀释比例依次加入相应病毒稀释液,每个浓度设6个复孔,37 ℃培养72 h。取出96孔板加入50 μL甲醇后-20 ℃放置至少15 min。弃甲醇,加入NS5A鼠单抗(1:2 000)室温孵育1h。用PBS洗3次,加入辣根过氧化物酶标记的山羊抗鼠二抗(1:500)室温孵育1 h。PBS洗3次,加入50 μL显色液,光学显微镜下观察是否有红色圈状的HCV病毒灶。病毒滴度用半数组织培养感染量(50% tissue culture infective dose,TCID50)计量。
1.6 荧光素酶分析JcR2a-ΔE1E2是一种带有Renilla荧光素酶的HCV亚基因组复制子RNA,可以在细胞内复制但不能组装成病毒颗粒,复制产生的RNA都会停留在细胞内。用该RNA电转染进Huh 7.5.1细胞和GFP、syntenin-1 过表达细胞系。将带有荧光素酶基因的JcR2a-ΔE1E2电转染进入靶细胞中,然后将细胞铺入24孔板,置于37 ℃培养箱中。收样品时,用PBS洗细胞1次,然后加入100 μL/孔被动裂解缓冲液(PLB)裂解细胞,放置于水平摇床上摇动15 min。取每孔中的细胞裂解上清液25 μL转移至孔底及侧壁均不透光的96孔板中,转移后每孔立刻加入12.5 μL的荧光素酶试验缓冲液Ⅱ(LARⅡ),混匀,再每孔加入12.5 μL的停止与激发试剂(Stop & Glo Reagent),混匀,测定Renilla荧光素酶的活性。
1.7 密度梯度收集50 mL病毒液,用浓缩管(Centrifugal Filters Ultracel®-100K)4 ℃、1500×g离心30 min,浓缩至约500 μL。用PBS和OptiPrep配制0%、20%、40%、60%和80%组分混合液。取200 μL浓缩病毒液与100% OptiPrep混合加入到超速离心管底部,按照密度从高到低的顺序依次加入不同浓度的密度组分混合液各800 μL。4 ℃ 110 000×g离心16 h。从上往下分出连续密度组分,每个组分300 μL。
1.8 qPCR检测HCV RNA含量利用TRIzol试剂提取各个密度组分的总RNA,使用天根生化科技(北京)有限公司的RNA反转录试剂盒反转录为cDNA,进行qPCR。HCV RNA引物为:正向5′-TCT GCG GAA CCG GTG AGT A-3′,反向5′-TCA GGC AGT ACC ACA AGG C-3′。qPCR反应条件为:95 ℃ 15 s,60 ℃ 60 s,循环40次。将不同浓度的RNA标准品得到的CT值制作成标准曲线计算各个样品的RNA含量。
1.9 ApoE ELISA定量测定往预先包被人ApoE捕获抗体的包被微孔中分别加入不同浓度的标准品和待测样品各50 μL。除空白对照孔外,每孔加入辣根过氧化物酶标记的检测抗体100 μL,用封板膜封住反应孔,37 ℃恒温箱温育60 min。弃上清液,每孔加350 μL洗涤液,静置1 min,弃洗涤液,如此重复洗板5次。每孔加入底物A、B各50 μL,37 ℃恒温箱避光孵育15 min后,加入终止液50 μL,15 min内在450 nm波长处测定各孔光密度(D)值。将不同浓度的标准品得到的D值制作成标准曲线计算各个样品的ApoE含量。
1.10 统计学处理采用GraphPad Prism 7.0或Office 2016 Excel软件行统计学分析和图表绘制。所有实验均重复3次,实验数据表示为x±s,两组间比较采用两样本均数比较的t 检验。检验水准(α)为0.05。
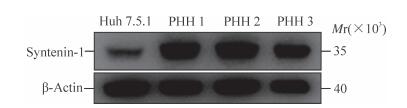
2 结果 2.1 Syntenin-1蛋白在人肝癌细胞系Huh7.5.1和人原代肝细胞中的含量对比由图 1可见,3例不同人原代肝细胞样品中syntenin-1蛋白的表达水平均高于Huh7.5.1细胞,分别是Huh7.5.1细胞的3.00、2.89和1.83倍。
|
图 1 Syntenin-1蛋白在Huh7.5.1细胞和人原代肝细胞中的表达 Fig 1 Expression of syntenin-1 in Huh7.5.1 cell and primary human hepatocyte (PHH) Huh7.5.1: Human hepatoma cell line |
2.2 Syntenin-1过表达细胞系的构建
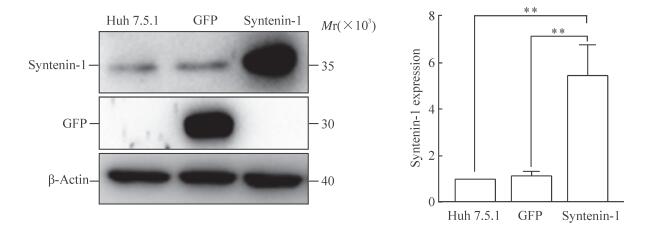
蛋白质印迹结果(图 2)显示,转导syntenin-1的Huh7.5.1细胞中syntenin-1的表达高于亲本Huh7.5.1细胞和转导GFP 的Huh7.5.1细胞(P<0.01),表明syntenin-1 过表达细胞系构建成功。
|
图 2 Syntenin-1过表达细胞系的构建 Fig 2 Establishment of syntenin-1 overexpressed cell line Expressions of syntenin-1 in Huh 7.5.1, syntenin-1 overexpressed and GFP overexpressed cells. Huh7.5.1: Human hepatoma cell line; GFP: Green fluorescent protein. **P < 0.01. n=3, x±s |
2.3 Syntenin-1 过表达、GFP过表达与Huh7.5.1细胞的病毒学比较
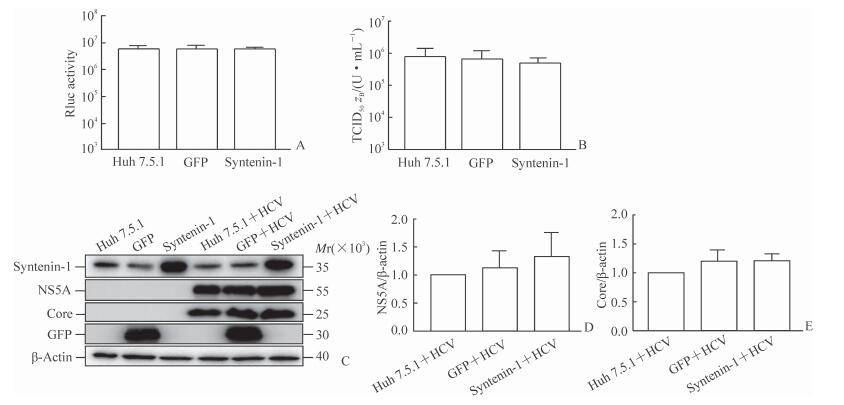
Renilla荧光素酶分析结果(图 3A)表明,HCV RNA在3种细胞内的复制水平差异无统计学意义。将Jc1-E2Flag RNA电转染入这3种细胞72 h后行病毒滴度(图 3B)和蛋白质免疫印迹(图 3C~3E)分析,结果显示,3种细胞产生的HCV的总体感染性和细胞内病毒相关蛋白表达差异无统计学意义。
|
图 3 Huh7.5.1、syntenin-1过表达和GFP过表达细胞中HCV病毒复制、组装和蛋白表达的比较 Fig 3 Comparisons of HCV replication, virus production, and viral protein expression in Huh7.5.1, syntenin-1 overexpressed and GFP overexpressed cells A: Huh7.5.1, GFP overexpressed and syntenin-1 overexpressed cells were electroporated with JcR2a-ΔE1E2 RNA, and luciferase activity was determined at 72 h after electroporation; B: Huh7.5.1, GFP overexpressed and syntenin-1 overexpressed cells were electroporated with Jc1-E2Flag, and the infectivity of HCV was measured by the TCID50 test at different time points after electroporation; C-E: HCV viral protein expressions in Huh7.5.1, GFP overexpressed and syntenin-1 overexpressed cells were detected by Western blotting. Huh7.5.1: Human hepatoma cell line; GFP: Green fluorescent protein; HCV: Hepatitis C virus; TCID50: 50% tissue culture infective dose. n=3, x±s |
2.4 Syntenin-1过表达改变了HCV感染性颗粒的密度组分分布
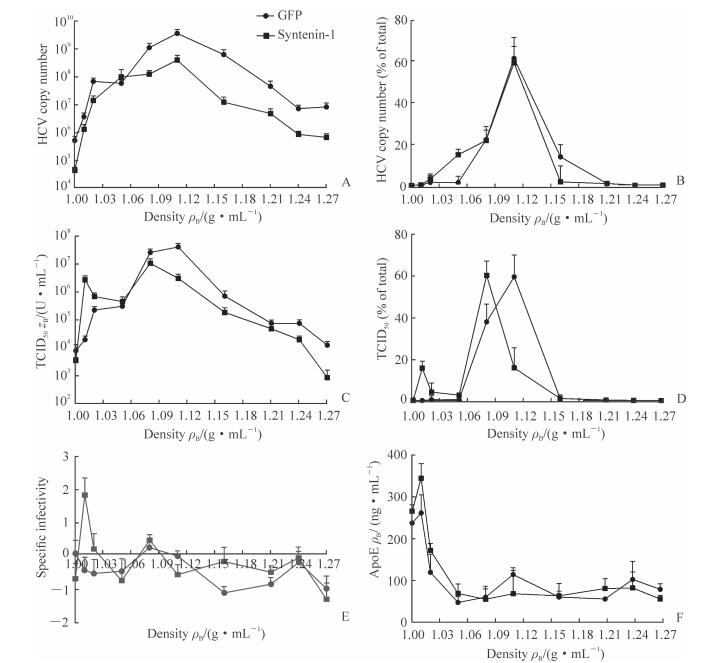
qPCR结果(图 4A、4B)显示,syntenin-1 和GFP过表达细胞产生的病毒颗粒RNA主峰都在1.11 g/mL附近。在病毒感染能力方面,syntenin-1 过表达后HCV感染性颗粒从主要集中在1.08~1.16 g/mL区域逐渐转变为有部分转移到密度为1.01~1.02 g/mL的低密度区域(图 4C);由百分比表示的感染能力比较图(图 4D)可见,syntenin-1 过表达细胞产生的病毒在1.11 g/mL感染能力较GFP 过表达细胞低,其最高峰在1.08 g/mL处。由单位RNA感染能力(specific infectivity)结果(图 4E)可见,syntenin-1过表达细胞产生的病毒在1.01 g/mL处的单位RNA感染能力最高。
|
图 4 Syntenin-1 过表达增加了低密度高感染性病毒颗粒的产生 Fig 4 Syntenin-1 overexpression in Huh7.5.1 cells increases production of HCV particles with high specific infectivity and low density A-D: Culture supernatants were subjected to isopycnic OptiPrep gradient ultracentrifugation, and fractions were probed for viral load (A, B) and viral infectivity (C, D); E, F: Specific infectivity (ratio of infectivity titre to viral load, E) and ApoE (by ELISA, F). GFP: Green fluorescent protein; HCV: Hepatitis C virus; TCID50: 50% tissue culture infective dose; ApoE: Apolipoprotein E. n=3, x±s |
采用ApoE ELISA试剂盒检测各组分的ApoE含量发现,syntenin-1 过表达组中1.01 g/mL这一密度组分ApoE含量约为对照组1.4倍,而在1.11g/mL这一密度层ApoE含量约为对照组的50%。见图 4F。
3 讨论本实验发现人原代肝细胞中syntenin-1的含量高于Huh7.5.1细胞系,在HCV的宿主细胞中过表达syntenin-1 能够改变HCV感染性颗粒的密度组分分布。已有研究表明,HCV感染性病毒颗粒的感染能力与颗粒的浮力密度呈负相关[10]。因此本实验通过密度梯度离心分离实验对syntenin-1和GFP过表达细胞产生的病毒上清进行检测。Syntenin-1 过表达细胞培养上清液中的HCV感染性病毒颗粒从主要集中在1.08~1.16 g/mL区域变为有部分转移到1.01~1.02 g/mL的低密度区域。这些syntenin-1含量较高的细胞生产的低密度感染性病毒颗粒拥有更高的感染能力,并且带有更多的脂类,与人肝癌细胞Huh7.5.1产生的HCV有组成上的差异,这可能会为体外实验探索中和抗体和疫苗的设计等提供参考。
本实验在syntenin-1过表达细胞系中证实了syntenin-1并不影响HCV感染性病毒颗粒在宿主中的复制和释放。与GFP过表达细胞系相比,上清液总体感染能力没有明显差异,但GFP过表达细胞的感染能力呈单峰分布,主要集中在1.08~1.16 g/mL区域,而syntenin-1 过表达细胞则是双峰(1.08~1.16 g/mL和1.01~1.02 g/mL的密度组分各有1个峰)。Sysntenin-1过表达细胞在1.08~1.16 g/mL这部分病毒分布集中的密度组分中HCV RNA含量和感染能力指标TCID50均较GFP过表达细胞减少,并且在1.16~1.27 g/mL密度组分病毒感染能力也下降。这些变化都是syntenin-1 过表达细胞产生了物理化学性质发生改变的低密度的脂病毒颗粒,但2种细胞病毒液的总体感染能力未见明显差异。
极低密度脂蛋白(very low density lipoprotein,VLDL)是病毒脂质颗粒的重要组成部分,覆盖在病毒颗粒以外,与病毒感染密切相关[11]。其中ApoE是VLDL的蛋白成分,同时也是感染性病毒颗粒的重要组成部分[12]。Beilstein等[13]实验表明,Huh7.5.1细胞或人原代肝细胞中胆碱酰基转移酶1下调后产生的HCV病毒颗粒数量增加,在低密度层(约1.03 g/mL)出现高感染能力的病毒颗粒;且他们通过检测ApoE和ApoB的含量发现低密度层VLDL含量增加,表明这种低密度高感染能力的病毒颗粒与脂类代谢和脂滴的重组有关。本实验发现,通过过表达syntenin-1 得到了相似的表型,并且在低密度层里有更多的ApoE出现在syntenin-1 过表达细胞中,但导致低密度高感染能力的病毒颗粒出现的原因是否也与脂类代谢和脂滴的重组相关仍需进一步研究。
| [1] | World Health Organization. Global hepatitis report, 2017[R/OL]. (2017-10)[2017-10-17]. http://www.who.int/mediacentre/factsheets/fs164/zh/. |
| [2] | GOOSSENS N, HOSHIDA Y. Hepatitis C virus-induced hepatocellular carcinoma[J]. Clin Mol Hepatol, 2015, 21: 105–114. DOI: 10.3350/cmh.2015.21.2.105 |
| [3] | WAKITA T, PIETSCHMANN T, KATO T, DATE T, MIYAMOTO M, ZHAO Z, et al. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome[J]. Nat Med, 2005, 11: 791–796. DOI: 10.1038/nm1268 |
| [4] | BARTENSCHLAGER R, PENIN F, LOHMANN V, ANDRÉ P. Assembly of infectious hepatitis C virus particles[J]. Trends Microbiol, 2011, 19: 95–103. DOI: 10.1016/j.tim.2010.11.005 |
| [5] | GROOTJANS J J, ZIMMERMANN P, REEKMANS G, SMETS A, DEGEEST G, DÜRR J, et al. Syntenin, a PDZ protein that binds syndecan cytoplasmic domains[J]. Proc Natl Acad Sci USA, 1997, 94: 13683–13688. DOI: 10.1073/pnas.94.25.13683 |
| [6] | SARKAR D, BOUKERCHE H, SU Z Z, FISHER P B. Mda-9/syntenin: recent insights into a novel cell signaling and metastasis-associated gene[J]. Pharmacol Ther, 2004, 104: 101–115. DOI: 10.1016/j.pharmthera.2004.08.004 |
| [7] | LAZIĆ D, HUFBAUER M, ZIGRINO P, BUCHHOLZ S, KAZEM S, FELTKAMP M C, et al. Human papillomavirus type 8 E6 oncoprotein inhibits transcription of the PDZ protein syntenin-2[J]. J Virol, 2012, 86: 7943–7952. DOI: 10.1128/JVI.00132-12 |
| [8] | GORDÓN-ALONSO M, ROCHA-PERUGINI V, ÁLVAREZ S, MORENO-GONZALO O, URSA A, LÓPEZ-MARTÍN S, et al. The PDZ-adaptor protein syntenin-1 regulates HIV-1 entry[J]. Mol Biol Cell, 2012, 23: 2253–2263. DOI: 10.1091/mbc.E11-12-1003 |
| [9] | LUSSIGNOL M, KOPP M, MOLLOY K, VIZCAY-BARRENA G, FLECK R A, DORNER M, et al. Proteomics of HCV virions reveals an essential role for the nucleoporin Nup98 in virus morphogenesis[J]. Proc Natl Acad Sci USA, 2016, 113: 2484–2489. DOI: 10.1073/pnas.1518934113 |
| [10] | PODEVIN P, CARPENTIER A, PÈNE V, AOUDJEHANE L, CARRIÈRE, M, ZAÏDI S, et al. Production of infectious hepatitis C virus in primary cultures of human adult hepatocytes[J]. Gastroenterology, 2010, 139: 1355–1364. DOI: 10.1053/j.gastro.2010.06.058 |
| [11] | ANDRÉ P, KOMURIAN-PRADEL F, DEFORGES S, PERRET M, BERLAND J L, SODOYER M, et al. Characterization of Low-and very-low-density hepatitis C virus RNA-containing particles[J]. J Virol, 2002, 76: 6919–6928. DOI: 10.1128/JVI.76.14.6919-6928.2002 |
| [12] | CATANESE M T, URYU K, KOPP M, EDWARDS T J, ANDRUS L, RICE W J, et al. Ultrastructural analysis of hepatitis C virus particles[J]. Proc Natl Acad Sci USA, 2013, 110: 9505–9510. DOI: 10.1073/pnas.1307527110 |
| [13] | BEILSTEIN F, LEMASSON M, PÈNE V, RAINTEAU D, DEMIGNOT S, ROSENBERG A R. Lysophosphatidylcholine acyltransferase 1 is downregulated by hepatitis C virus: impact on production of lipo-viro-particles[J]. Gut, 2016, 66: 2160–2169. |
 2018, Vol. 39
2018, Vol. 39


