2. 重庆市中医院重症医学科, 重庆 400011
2. Department of Critical Care Medicine, Chongqing Traditional Chinese Medicine Hospital, Chongqing 400011, China
脓毒症是由于宿主对感染的反应失调而引起的致命性器官功能障碍。国外流行病学调查显示,全球每年约有3 150万例脓毒症患者,其中每年因脓毒症死亡的人数约530万,病死率达25%~30%,预后极差[1]。脓毒症发生时,患者血清中多种细胞因子如白细胞介素(interleukin,IL)-1、IL-6、IL-17、IL-37及肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等水平升高,其中IL-6作为多功能炎性因子,是炎性介质网络的关键分子,具有致炎和抗炎的双重功能[2]。研究发现,体内IL-6水平正常时发挥抗炎效应,产生过多时则引起发热、白细胞增多、急性期反应等一系列炎性损害[3]。还有研究发现,脓毒症患者血清中升高的IL-6可诱发血管内皮细胞活化和功能紊乱,在脓毒症的发生与发展过程中起着重要作用[4];血管内皮细胞作为人体“面积最大的器官”,在发生脓毒症时最易受损或活化而参与炎性反应,导致机体脏器损伤而发生多器官功能衰竭[5]。因此,探索IL-6对内皮细胞的影响及其机制对脓毒症的防治有着重要意义。
脓毒症导致机体脏器损伤从微观角度看是细胞的损伤和死亡,自噬和凋亡是细胞受到刺激后为维持内环境稳态而发生的有序自发性死亡过程,在维持细胞存活、更新、物质再利用中具有重要作用[6-8]。因此,本研究采用IL-6刺激人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),探究IL-6对HUVECs凋亡和自噬的影响,以阐明IL-6在脓毒症发生和器官功能中的作用。
1 材料和方法 1.1 实验材料RPMI 1640培养基、胎牛血清(美国Gibco公司),二甲基亚砜(DMSO)、抗自噬微管相关蛋白1轻链3(LC3)A/B单克隆抗体(美国Abcam公司)、激活型天冬氨酸特异性半胱氨酸蛋白酶(cleaved caspase-3)抗体(美国CST公司),p62单克隆抗体(美国Abcam公司),抗β-actin单克隆抗体(天津三箭生物技术有限公司),西罗莫司(sirolimus,SRL;美国Sigma公司),3-甲基腺嘌呤(3-methyladenine,3-MA;美国Sigma公司),单丹磺酰戊二胺(MDC;美国Sigma公司),CCK-8试剂盒[东仁化学科技(上海)有限公司]。ECL化学发光试剂盒(美国Pierce公司),JEM-1200 EX型透射电镜(日本电子株式会社),DM4000B型高清显微镜(德国Leica公司),Influx流式细胞仪(美国BD公司)。
1.2 HUVECs培养HUVECs购自美国模式菌种收集中心(ATCC)细胞库。用含10%胎牛血清、80 U/mL青霉素和0.08 g/L链霉素的RPMI 1640完全培养液在37 ℃、5% CO2培养箱中传代培养。选择对数生长期细胞给予不同浓度(5、10、20、50 ng/mL)IL-6刺激,另外同时予以自噬诱导剂SRL(100 nmol/L)[9]和自噬抑制剂3-MA(1 mmol/L)[10]处理。
1.3 透射电镜观察细胞超微结构的变化取对数生长期HUVECs,调整细胞数量达到1×106后分别加入20、50 ng/mL IL-6,刺激24 h后收集细胞;另设不加IL-6的空白对照组。取细胞悬液置入2 mL离心管中,240×g离心10 min,弃去上清液,沿管壁缓慢加入戊二醛固定液固定2 h,PBS洗3次,再加入4 ℃预冷的1%锇酸固定1 h;丙酮脱水,树脂包埋,超薄切片(50 nm),醋酸铀-枸橼酸铅双染色后透射电镜下观察细胞超微结构。
1.4 CCK-8法检测细胞的存活率取对数生长期HUVECs,以6×103/孔的密度接种于96孔板中,待细胞贴壁后分别予以不同浓度(5、10、20、50 ng/mL)IL-6干预,同时设不加IL-6为空白对照组。每组设5个复孔,每孔终体积100 μL,37 ℃孵箱中培养24 h后取出;每孔加入10 μL CCK-8试剂,继续孵育1.5 h。用酶标仪测定450 nm波长下各孔光密度(D)值。计算各组细胞存活率:细胞存活率(%)=(D实验组-D空白对照组)/(D对照组-D空白对照组)×100%。实验重复3次。
1.5 流式细胞仪检测细胞凋亡取对数生长期HUVECs,调整细胞数量达到1×106后分别予以不同浓度(0、20、50 ng/mL)IL-6干预,同时另设20 ng/mL IL-6联合3-MA或SRL处理组。刺激24 h后用PBS洗2次,后用胰酶消化细胞,离心后加入400 μL PBS重悬细胞,采用Annexin Ⅴ-FITC/PI双染色法,加入5 μL的Annexin Ⅴ-FITC于离心管中混匀后,室温避光孵育15 min;上机前5 min再加入5 μL PI混匀,流式细胞仪检测细胞凋亡情况。
1.6 MDC荧光染色检测细胞自噬取对数生长期HUVECs,以8×104/孔的密度接种于6孔板中,分别予以不同浓度(0、20、50 ng/mL)IL-6干预,另设20 ng/mL IL-6联合3-MA或SRL处理组。孵育24 h后弃去培养液,加入终浓度为0.05 mmol/L的MDC于37 ℃避光孵育15 min,吸弃染液,多聚甲醛固定15 min,PBS洗3次,荧光显微镜下(×400)观察,各组均随机抽取10个不重复的视野观察并拍照。每组随机选取至少30个细胞,计数每个细胞内自噬泡数目。
1.7 蛋白质印迹法检测凋亡相关蛋白cleaved caspase-3和自噬相关蛋白LC3、p62的表达取对数生长期HUVECs,调整细胞数量达到1×106后分别予以不同浓度(0、5、10、20、50 ng/mL)IL-6干预,同时另设20 ng/mL IL-6联合3-MA或SRL处理组。刺激24 h后提取蛋白,用BCA法测定蛋白浓度后行电泳,转膜1 h,5%脱脂奶粉封闭2 h。分别加入兔抗cleaved caspase-3一抗(1:800)、兔抗LC3一抗(1:1 000)、鼠抗p62一抗(1:1 000)、鼠抗β-actin一抗(1:5 000),4 ℃孵育过夜。TBST洗膜3次,每次10 min,分别加入相应的辣根过氧化物酶标记的二抗室温孵育1 h。TBST洗膜3次,每次10 min,ECL化学发光试剂盒显色、曝光,保存图片。使用Fusion软件进行定量分析。实验重复3~5次。
1.8 统计学处理应用SPSS 22.0软件进行数据分析。计量资料采用K-S检验是否符合正态分布,符合正态分布的计量资料以x±s表示;方差齐者两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。检验水准(α)为0.05。
2 结果 2.1 IL-6对HUVECs存活率的影响结果显示,0、5、10、20、50 ng/mL的IL-6刺激组的细胞存活率分别为100%、(79.80±8.25)%、(60.03±6.22)%、(42.66±5.17)%、(24.90%±5.99)%,随着IL-6浓度的增加,HUVECs的细胞存活率逐渐降低(P<0.05)。
2.2 IL-6对HUVECs凋亡的影响与对照组(0 ng/mL)相比,不同浓度IL-6刺激组HUVECs中cleaved caspase-3的表达均增加(P<0.05),且作用呈浓度依赖性(P<0.05,图 1A)。流式细胞术结果(图 1B)显示,与对照组(0 mg/mL)相比,20、50 ng/mL IL-6处理后HUVECs的凋亡率均增加(P<0.05),且50 ng/mL IL-6处理组细胞凋亡率高于20 ng/mL IL-6处理组(P<0.05)。
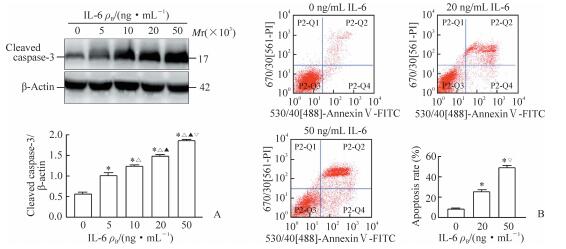
|
图 1 IL-6促进HUVECs凋亡 Fig 1 IL-6 treatment promotes apoptosis of HUVECs A: Western blotting; B: Flow cytometry. IL-6: Interleukin 6; HUVECs: Human umbilical vein endothelial cells. *P < 0.05 vs 0 ng/mL IL-6 group; △P < 0.05 vs 5 ng/mL IL-6 group; ▲P < 0.05 vs 10 ng/mL IL-6 group; ▽P < 0.05 vs 20 ng/mL IL-6 group. n=3, x±s |
2.3 IL-6对HUVECs自噬的影响
与对照组(0 ng/mL)相比,不同浓度IL-6刺激组HUVECs中LC3Ⅱ/LC3Ⅰ比值降低(P<0.05)、p62表达增加(P<0.05),且作用呈浓度依赖性(P<0.05,图 2A)。MDC染色结果(图 2B)显示,对照组(0 ng/mL)细胞中存在散在绿色光点;与对照组(0 ng/mL)相比,20、50 ng/mL IL-6刺激组细胞内自噬泡平均数均减少(P<0.05),且50 ng/mL IL-6处理组细胞内自噬泡平均数少于20 ng/mL IL-6处理组(P<0.05)。透射电镜观察(图 2C)发现,对照组(0 ng/mL)胞质中可见较多大膜状自噬小体,其典型结构为双层膜结构并弯曲延展,包裹部分胞质成分和细胞器,细胞呈正常形态;分别用20、50 ng/mL IL-6刺激后,可见较多细胞呈凋亡形态,表现为胞核碎裂形成碎片,核质向核膜边缘或中央异染色质区聚集形成浓缩的染色质块,自噬小体明显减少。
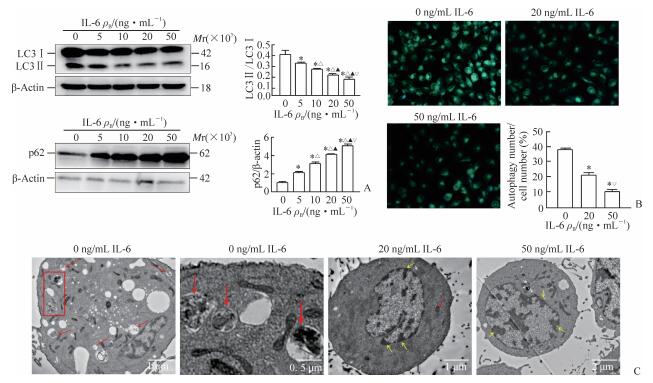
|
图 2 IL-6抑制HUVECs自噬 Fig 2 IL-6 treatment inhibits autophagy of HUVECs A: Western blotting; B: Autophagic vacuoles by MDC staining (original magnification: ×400); C: Ultra-microstructure of HUVECs by TEM (red arrows indicate autophagosome; yellow arrows indicate abnormal chromatin aggregation). IL-6: Interleukin 6; HUVECs: Human umbilical vein endothelial cells; LC3: Microtubule-associated protein 1 light chain 3; MDC: Monodansylcadaverine; TEM: Transmission electron microscope. *P < 0.05 vs 0 ng/mL IL-6 group; △P < 0.05 vs 5 ng/mL IL-6 group; ▲P < 0.05 vs 10 ng/mL IL-6 group; ▽P < 0.05 vs 20 ng/mL IL-6 group. n=3, x±s |
2.4 抑制自噬对IL-6促进HUVECs凋亡的影响
与对照组相比,3-MA刺激组HUVECs中嗜酸自噬泡减少(P<0.05),cleaved caspase-3表达无明显变化(P>0.05),LC3Ⅱ/LC3Ⅰ比值降低(P<0.05),p62表达增加(P<0.05);而与IL-6刺激组相比,IL-6联合3-MA刺激组HUVECs中嗜酸自噬泡减少(P<0.05),cleaved caspase-3表达增加(P<0.05),LC3Ⅱ/ LC3Ⅰ比值降低(P<0.05),p62表达增加(P<0.05),细胞凋亡率增加(P<0.05)。见图 3。
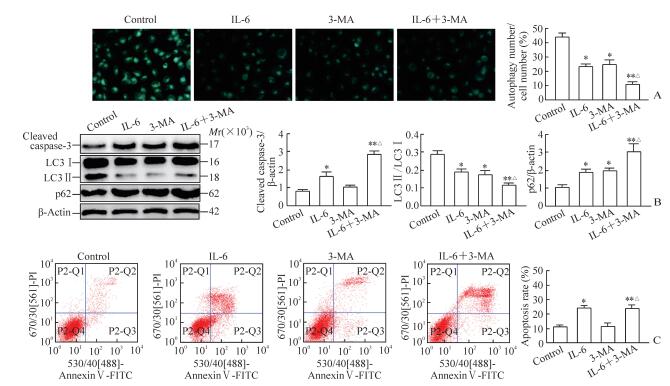
|
图 3 抑制自噬增加IL-6诱导的HUVECs凋亡 Fig 3 Inhibition of autophagy promotes apoptosis of HUVECs induced by IL-6 A: Autophagic vacuoles by MDC staining (original magnification: ×400); B: Expression of cleaved caspase-3, LC3 and p62 by Western blotting; C: Apoptosis of HUVECs by flow cytometry. IL-6: Interleukin 6; HUVECs: Human umbilical vein endothelial cells; 3-MA: 3-Methyladenine; LC3: Microtubule-associated protein 1 light chain 3; MDC: Monodansylcadaverine. *P < 0.05, **P < 0.01 vs control group; △P < 0.05 vs IL-6 group. n=3, x±s |
2.5 增强自噬对IL-6促进HUVECs凋亡的影响
与对照组相比,SRL刺激组HUVECs中嗜酸自噬泡增加(P<0.05),cleaved caspase-3表达无明显变化(P>0.05),LC3Ⅱ/LC3Ⅰ比值增加(P<0.05),p62表达减少(P<0.05);与IL-6刺激组相比,IL-6联合SRL刺激组HUVECs中嗜酸自噬泡增加(P<0.05),cleaved caspase-3表达减少(P<0.05),LC3Ⅱ/ LC3Ⅰ比值增加(P<0.05),p62表达减少(P<0.05),细胞凋亡率降低(P<0.05)。见图 4。
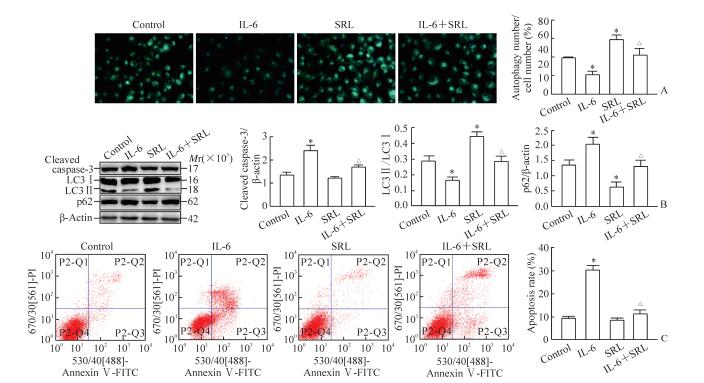
|
图 4 增强自噬减少IL-6诱导的HUVECs凋亡 Fig 4 Activation of autophagy reduces apoptosis of HUVECs induced by IL-6 A: Autophagic vacuoles by MDC staining (original magnification: ×400); B: Western blotting; C: Flow cytometry. IL-6: Interleukin 6; HUVECs: Human umbilical vein endothelial cells; SRL: Sirolimus; LC3: Microtubule-associated protein 1 light chain 3; MDC: Monodansylcadaverine. *P < 0.05 vs control group; △P < 0.05 vs IL-6 group. n=3, x±s |
3 讨论
脓毒症的发病率和病死率逐年升高[1],其发病机制未完全阐明。IL-6作为一种促炎因子能催化和放大炎性反应。研究显示,脓毒症患者血清中IL-6水平升高,其对诊断脓毒症和判断脓毒症预后有较高的敏感度和特异度[11]。血管内皮细胞的凋亡、活化等损伤在脓毒症的炎性反应和继发的多器官功能衰竭中发挥关键作用[5]。既往研究发现,IL-6可以诱导血管内皮细胞活化和功能紊乱,在脓毒症的发生、发展中起着重要作用[3]。本研究发现,IL-6可浓度依赖性降低HUVECs的活性,增加cleaved caspase-3的表达及细胞凋亡。但在脓毒症状态下,IL-6引起内皮细胞功能紊乱和凋亡的机制还需要进一步研究。
自噬是一种机体降解胞内受损的细胞器、异常蛋白质、外源微生物的自我保护机制,电镜下观察到大量双层膜结构的自噬小体为其典型形态学特征。既往在对6例脓毒症死亡患者进行尸检的研究发现,其肝脏细胞中可观察到大量自噬空泡聚集;在盲肠结扎穿刺(cecal ligation and puncture,CLP)大鼠肝脏中也发现自噬泡的异常聚集[12];SRL诱导自噬可帮助小鼠抵抗金黄色葡萄球菌肠毒素引起的感染性休克和心脏功能障碍[13];此外,在腹腔注射脂多糖(lipopolysaccharide,LPS)引起脓毒症的小鼠中,用氯喹抑制自噬可增加炎性因子水平和死亡率[14]。这些研究均表明自噬在脓毒症中具有保护作用。本研究发现,IL-6可以减少血管内皮细胞内的自噬泡或自噬小体,并浓度依赖性降低细胞内LC3Ⅱ/LC3Ⅰ的比值,增加p62的表达。LC3、p62是自噬溶酶体经典的标志性蛋白,LC3参与自噬溶酶体膜的延伸过程;而p62与经泛素化标记的蛋白结合形成复合物在溶酶体内降解,随着细胞自噬水平的增加,p62不断被消耗,检测二者变化可以反映细胞自噬活性的程度[15]。本研究结果表明,IL-6可以抑制HUVECs的自噬,推测这可能是内皮细胞功能障碍加重炎性反应的重要机制之一。
自噬与凋亡关系密切,正常水平的自噬对维持细胞的功能和代谢起重要作用,但过度的自噬会对细胞造成损伤,甚至凋亡。既往研究证明,细胞自噬可以通过降解caspase、Bcl-2等促凋亡蛋白而抑制细胞凋亡,相反,抑制细胞自噬则可以促进细胞凋亡。研究证实,5-氟尿嘧啶可通过抑制colon26和HT29细胞自噬下调Bcl-xL蛋白的表达,从而增强细胞色素C释放、caspase-3激活及其介导的细胞凋亡[16];在前列腺癌细胞系PC-3和LNCaP中抑制自噬可导致细胞色素C的释放增加,从而增强萝葡硫素诱导的细胞凋亡[17];采用喜树碱处理MCF-7细胞24 h后细胞中出现自噬泡样结构,而用自噬抑制剂氯喹预处理的细胞中caspase-9的表达增加,加速细胞凋亡[18]。因此,细胞自噬与凋亡之间有相互影响。
本研究采用自噬抑制剂3-MA联合IL-6处理HUVECs,结果发现细胞内LC3Ⅱ/LC3Ⅰ的比值下降、p62的表达增加、细胞内的自噬泡和自噬小体数量减少,提示抑制自噬可进一步增强IL-6对HUVECs自噬的抑制作用,且可进一步增强IL-6刺激下cleaved caspase-3的表达和HUVECs的凋亡。同时,采用自噬激动剂SRL联合IL-6处理HUVECs,发现SRL减轻了IL-6对HUVECs自噬的抑制作用,表现为IL-6联合SRL刺激组HUVECs内的自噬泡和自噬小体数量较IL-6刺激组增加、LC3Ⅱ/ LC3Ⅰ比值增加、p62表达减少,且HUVECs的凋亡和cleaved caspase-3的表达降低。上述结果说明,IL-6刺激下HUVECs自噬水平的不足是导致其凋亡的重要原因,而增强或恢复HUVECs的自噬水平可以减轻IL-6诱导的HUVECs凋亡。因此,可推测脓毒症发生时血清中过高的IL-6可能通过抑制血管内皮细胞自噬导致细胞过度凋亡进而引起器官功能障碍,但具体机制尚不明确,后续将通过体外实验和脓毒症动物模型进行进一步研究。
综上所述,本研究发现IL-6可以通过抑制HUVECs自噬而导致细胞凋亡增加,这可能是其引发内皮细胞损伤从而导致患者脓毒症加重和器官功能障碍的重要机制之一。
| [1] | FLEIS CHMANN C, SCHERAG A, ADHIKARI N K, HARTOG C S, TSAGANOS T, SCHLATTMANN P, et al. Assessment of global incidence and mortality of hospital-treated sepsis. Current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193: 259–272. DOI: 10.1164/rccm.201504-0781OC |
| [2] | SCHULTE W, BERNHAGEN J, BUCALA R. Cytokines in sepsis: potent immunoregulators and potential therapeutic targets-an updated view[J]. Mediat Inflamm, 2013, 2013: 1–16. |
| [3] | KOZIEL J, BRYZEK D, SROKA A, MARESZ K, GLOWCZYK I, BIELECKA E, et al. Citrullination alters immunomodulatory function of LL-37 essential for prevention of endotoxin-induced sepsis[J]. J Immunol, 2014, 192: 5363–5372. DOI: 10.4049/jimmunol.1303062 |
| [4] | TSCHAIKOWSKY K, HEDWIG-GEISSING M, BRAUN G G, RADESPIEL-TROEGER M. Predictive value of procalcitonin, interleukin-6, and C-reactive protein for survival in postoperative patients with severe sepsis[J]. J Crit Care, 2011, 26: 54–64. DOI: 10.1016/j.jcrc.2010.04.011 |
| [5] | SCHILDBERGER A, ROSSMANITH E, WEBER V, FALKENHAGEN D. Monitoring of endothelial cell activation in experimental sepsis with a two-step cell culture model[J]. Innate Immun, 2010, 16: 278–287. DOI: 10.1177/1753425909341885 |
| [6] | LEIST M, JÄÄTTELÄ M. Four deaths and a funeral: from caspases to alternative mechanisms[J]. Nat Rev Mol Cell Biol, 2001, 2: 589–598. |
| [7] | FADEEL B, ORRENIUS S, ZHIVOTOVSKY B. Apoptosis in human disease: a new skin for the old ceremony?[J]. Biochem Biophys Res Commun, 1999, 266: 699–717. DOI: 10.1006/bbrc.1999.1888 |
| [8] | MIZUSHIMA N, LEVINE B, CUERVO A M, KLIONSKY D J. Autophagy fights disease through cellular self-digestion[J]. Nature, 2008, 451: 1069–1075. DOI: 10.1038/nature06639 |
| [9] | CHE J, LIANG B, ZHANG Y, WANG Y, TANG J, SHI G. Kaempferol alleviates ox-LDL-induced apoptosis by up-regulation of autophagy via inhibiting PI3K/Akt/mTOR pathway in human endothelial cells[J]. Cardiovasc Pathol, 2017, 31: 57–62. DOI: 10.1016/j.carpath.2017.08.001 |
| [10] | CHAO J, WANG X, ZHANG Y, ZHU T, ZHANG W, ZHOU Z, et al. Role of MCPIP1 in the endothelial-mesenchymal transition induced by silica[J]. Cell Physiol Biochem, 2016, 40(1/2): 309–325. |
| [11] | HOU T, HUANG D, ZENG R, YE Z, ZHANG Y. Accuracy of serum interleukin (IL)-6 in sepsis diagnosis: a systematic review and meta-analysis[J]. Int J Clin Exp Med, 2015, 8: 15238–15245. |
| [12] | WATANABE E, MUENZER J T, HAWKINS W G, DAVIS C G, DIXON D J, McDUNN J E, et al. Sepsis induces extensive autophagic vacuolization in hepatocytes: a clinical and laboratory-based study[J]. Lab Invest, 2009, 89: 549–561. DOI: 10.1038/labinvest.2009.8 |
| [13] | KRAKAUER T, BUCKLEY M, ISSAQ H J, FOX S D. Rapamycin protects mice from staphylococcal enterotoxin B-induced toxic shock and blocks cytokine release in vitro and in vivo[J]. Antimicrob Agents Chemother, 2010, 54: 1125–1131. DOI: 10.1128/AAC.01015-09 |
| [14] | HSIEH C H, PAI P Y, HSUEH H W, YUAN S S, HSIEH Y C. Complete induction of autophagy is essential for cardioprotection in sepsis[J]. Ann Surg, 2011, 253: 1190–1200. DOI: 10.1097/SLA.0b013e318214b67e |
| [15] | YOSHⅡ S R, MIZUSHIMA N. Monitoring and measuring autophagy[J/OL]. Int J Mol Sci, 2017, 18. pii: E1865. doi: 10.3390/ijms18091865. |
| [16] | LI J, HOU N, FARIED A, TSUTSUMI S, TAKEUCHI T, KUWANO H. Inhibition of autophagy by 3-MA enhances the effect of 5-FU-induced apoptosis in colon cancer cells[J]. Ann Surg Oncol, 2009, 16: 761–771. DOI: 10.1245/s10434-008-0260-0 |
| [17] | HERMAN-ANTOSIEWICZ A, JOHNSON D E, SINGH S V. Sulforaphane causes autophagy to inhibit release of cytochrome C and apoptosis in human prostate cancer cells[J]. Cancer Res, 2006, 66: 5828–5835. DOI: 10.1158/0008-5472.CAN-06-0139 |
| [18] | ABEDIN M J, WANG D, McDONNELL M A, LEHMANN U, KELEKAR A. Autophagy delays apoptotic death in breast cancer cells following DNA damage[J]. Cell Death Differ, 2007, 14: 500–510. DOI: 10.1038/sj.cdd.4402039 |
 2018, Vol. 39
2018, Vol. 39


