2. 海军军医大学(第二军医大学)热带医学与公共卫生学系环境卫生教研室, 上海 200433
2. Department of Environmental Health, Faculty of Tropical Medicine and Public Health, Navy Medical University(Second Military Medical University), Shanghai 200433, China
结直肠癌是常见的高危害消化系统恶性肿瘤,全球每年新发病例约120万,其中因病致死60万,且呈增多趋势[1]。结直肠癌的发展和预后不仅与肿瘤本身特性有关,还与肿瘤微环境有关[2-3]。研究证实,在肿瘤组织及其微环境中均存在大量巨噬细胞,它们与肿瘤的发生、生长、转移等有密切的关系,又被称为肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)[3],以M2型巨噬细胞为主,多项研究证实CD163蛋白是M2型巨噬细胞的标志物[4-5]。本研究通过分析CD163表达水平与结直肠癌预后的关系,探讨M2型巨噬细胞在结直肠癌进展和转移中的作用。
1 资料和方法 1.1 病例资料与标本收集收集2010年1月至2011年12月接受外科手术的648例初治结直肠癌患者的临床资料及其术后肿瘤组织石蜡标本,资料及标本来源于海军军医大学(第二军医大学)长海医院肛肠外科,患者诊断均经术后病理证实。排除术前行新辅助化学治疗者。纳入标准:(1)术前未合并其他部位恶性肿瘤;(2)术后病理证实为结直肠癌,病理分期为Ⅰ~Ⅲ期;(3)手术根治性切除肿瘤,术后生存期大于1个月,未发生吻合口瘘及心脑血管事件等并发症;(4)有完整规范的术后病理报告及随访资料。生存时间定义为从初次手术当日到末次随访或患者死亡时间。
648例结直肠癌患者中,男性395例、女性253例,男性:女性为1.5:1;平均年龄(60.21±12.35)岁;病理分期为Ⅰ期128例、Ⅱ期273例、Ⅲ期247例。
选取上述病例中38例患者的癌旁组织制作石蜡样本,同时纳入37例行痔上黏膜环切钉合术(precedure for prolapse and hemorrhoids,PPH)的混合痔患者术后正常黏膜组织和33例内镜治疗后结直肠腺瘤样本。上述癌旁、正常黏膜、腺瘤组织均经甲醛溶液固定、石蜡包埋,作为对照组。
1.2 观察指标分析入组患者的年龄、性别、肿瘤位置、清扫淋巴结数目、TNM分期(按照美国癌症联合委员会和国际抗癌联盟结直肠癌TNM分期系统第7版进行分期)、肿瘤细胞分化程度、术前血清癌胚抗原(carcinoembryonic antigen,CEA)水平、血清癌抗原糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平、术后是否行辅助化学治疗。术后复发:局部复发包括局部淋巴结复发、吻合口复发等;远处复发包括血行转移(肝、肺等)、腹腔种植转移等。术后复发诊断主要依据体格检查、影像学检查及内镜检查。随访开始于患者出院,截止时间为2016年12月或患者死亡。
1.3 免疫组织化学染色将上述甲醛固定、石蜡包埋的标本由上海芯超生物科技有限公司制作成组织芯片。鼠抗CD163单克隆抗体购自福州迈新生物技术公司,货号:MAB-0206,工作浓度为即用型。组织芯片经脱蜡水化、3%过氧化氢溶液封闭内源性过氧化物酶,柠檬酸盐高压加热修复抗原,山羊血清封闭30 min,洗净后孵育一抗,4 ℃过夜。加二抗室温孵育20 min,经DAB显色和苏木精复染后,脱水封片。
1.4 免疫组织化学评分标准免疫组织化学评分由免疫染色阳性的细胞数决定。由2位硕士生在病理科专家的指导下完成,取2位观察者观察数据的平均值。随机选取4个200倍视野的相同大小的间质进行计数,结果为平均的阳性细胞数。CD163的高表达标准:200倍视野间质内阳性细胞数大于100。阳性细胞染色标准:细胞结构清晰,细胞膜染色明显,着色和背景对比清楚。
1.5 统计学处理采用SPSS 21.0软件进行数据分析,计量资料比较采用t检验,计数资料比较采用χ2检验或双侧Fisher精确概率法,分类变量比较采用Mann-Whitney U检验。采用Kaplan-Meier法分析CD163高表达组与低表达组生存率的差异;采用Cox单因素和多因素回归分析法分析结直肠癌预后的影响因素。检验水准(α)为0.05。
2 结果 2.1 CD163在结直肠癌中的表达CD163在结直肠癌组织芯片中表达于间质的巨噬细胞膜上,呈棕黄色,在正常黏膜组织、癌旁组织、腺瘤组织和结直肠癌组织呈不同程度的染色(图 1)。结直肠癌组织中CD163阳性细胞数与正常黏膜组织、癌旁组织、腺瘤组织比较差异均有统计学意义(121.46±49.76 vs 48.69±13.37、75.75±43.07、88.21±52.69,P<0.01)。
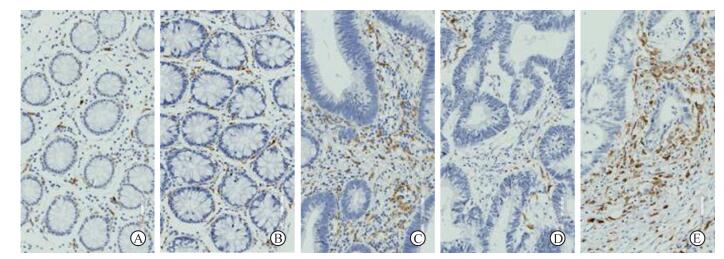
|
图 1 CD163在正常黏膜组织、癌旁组织、腺瘤组织和结直肠癌组织中的表达 Fig 1 Expressions of CD163 in normal mucosal, paracancerous, adenoma and colorectal cancer tissues A: Normal mucosal tissue; B: Paracancerous tissue; C: Adenoma tissue; D: Colorectal cancer tissue with low CD163 expression; E: Colorectal cancer tissue with high CD163 expression. Original magnification: ×200 |
2.2 结直肠癌临床病理参数与组织芯片中CD163表达之间的关系
648例结直肠癌患者癌组织芯片的免疫组织化学分析结果显示,CD163蛋白的表达水平与分化程度(P=0.002)、血清CA19-9浓度(P=0.011)、肿瘤复发转移(P<0.001)相关;而与年龄、性别、肿瘤部位、TNM分期、血清CEA浓度无关(P均>0.05)。见表 1。
|
|
表 1 结直肠癌组织中CD163的表达与临床病理参数的关系 Tab 1 Relationship between expression of CD163 in colorectal cancer tissues and the clinicopathological factors |
2.3 CD163的表达水平与结直肠癌患者预后的关系
648例结直肠癌患者的5年平均生存期为(42.32±14.51)个月;5年总体生存(overall survival,OS)率为91.05%(590/648);5年无病生存(disease-free survival,DFS)率为76.23%(494/648)。CD163高表达组与CD163低表达组的5年DFS率和5年OS率比较差异均有统计学意义(P 均<0.001,图 2)。
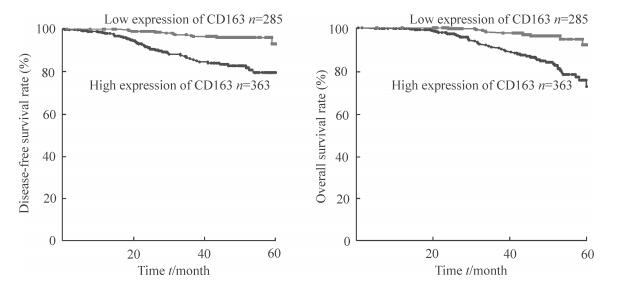
|
图 2 CD163高表达与低表达结直肠癌患者的无病生存曲线和总生存曲线比较 Fig 2 Comparison of disease-free survival curve and overall survival curve of patients with colorectal cancer with high expression and low expression of CD163 |
2.4 结直肠癌患者预后影响因素的Cox单因素和多因素分析
患者总体生存期的Cox单因素分析结果显示,血清CEA水平(P=0.049)、CD163表达水平(P<0.001)是结直肠癌预后的影响因素,而患者的年龄、性别、肿瘤部位、分化程度、TNM分期和血清CA19-9水平不是结直肠癌预后的影响因素(P均>0.05);Cox多因素分析结果显示,血清CEA水平(P=0.008)、CD163表达水平(P<0.001)是结直肠癌预后的独立影响因素,而患者的年龄、性别、肿瘤部位、分化程度、TNM分期和血清CA19-9水平不是结直肠癌预后的独立影响因素(P均>0.05)。见表 2。
|
|
表 2 648例结直肠癌患者总体生存期的影响因素 Tab 2 Influencing factors of overall survival of 648 patients with colorectal cancer |
患者无病生存期的Cox单因素分析结果显示,TNM分期(P=0.047)、血清CEA水平(P=0.035)、CD163表达水平(P<0.001)是结直肠癌预后的影响因素,而患者的年龄、性别、肿瘤部位、分化程度和血清CA19-9水平不是结直肠癌预后的影响因素(P均>0.05);Cox多因素分析结果显示,血清CEA水平(P=0.010)、CD163表达水平(P<0.001)是结直肠癌预后的独立影响因素,而患者的年龄、性别、肿瘤部位、分化程度、TNM分期和血清CA19-9水平不是结直肠癌预后的独立影响因素(P均>0.05)。见表 3。
|
|
表 3 648例结直肠癌患者无病生存期的影响因素 Tab 3 Influencing factors of disease-free survival of 648 patients with colorectal cancer |
3 讨论
肿瘤微环境是指肿瘤局部浸润的免疫细胞、间质细胞及所分泌的活性介质等与肿瘤细胞共同构成的局部内环境[6]。肿瘤微环境与肿瘤细胞的生长关系密切[7],而肿瘤微环境中数量最多是巨噬细胞[8],其在肿瘤的发生、进展、免疫逃逸和转移中发挥重要作用[9-10]。因此,巨噬细胞对肿瘤微环境的改变和肿瘤细胞的生长有重要影响[11-13]。
目前认为TAM有2种亚型,即M1型和M2型,M1型巨噬细胞通过激活免疫系统和释放活性氧、一氧化氮、肿瘤坏死因子等发挥抗肿瘤作用。M2型巨噬细胞发挥免疫抑制和促进肿瘤生长的作用,通过促进微血管生长进而促进肿瘤转移。肿瘤细胞分泌细胞因子诱导巨噬细胞向M2型转化,以利于其生长,因此肿瘤相关巨噬细胞以M2型为主[14]。M2型巨噬细胞增多在多个肿瘤中提示预后不良[10, 15-16],其常用标志物为CD163,表达于M2型巨噬细胞膜上[17]。
本研究通过648例结直肠癌样本探讨CD163表达水平与结直肠癌预后的关系,推测M2型巨噬细胞在结直肠癌中的作用,在样本量和随访时间方面较之前的研究更完善[4, 14],为进一步论证CD163表达与结直肠癌的关系提供了线索和依据。本研究提示648例结直肠癌患者间质中CD163的表达水平与肿瘤分化程度、血清CA19-9水平、肿瘤复发转移有关。生存分析发现CD163高表达组的DFS率和OS率较低表达组低,且预后差。患者总体生存期的Cox单因素分析结果显示,血清CEA水平、CD163表达水平是结直肠癌预后的影响因素;Cox多因素分析结果显示,血清CEA水平、CD163表达水平也是结直肠癌预后的独立影响因素。患者无病生存期的Cox单因素分析结果也显示,TNM分期、血清CEA水平、CD163表达水平是结直肠癌预后的影响因素;Cox多因素分析结果也显示,血清CEA水平、CD163表达水平是结直肠癌预后的独立影响因素。
综上,CD163高表达结直肠癌患者较低表达患者预后差,提示M2型巨噬细胞可能引起结直肠癌的不良预后,CD163有希望成为新的预测结直肠癌侵袭及转移的生物标志物,未来可通过减少结直肠癌中M2型巨噬细胞的数量达到治疗肿瘤的目的。
| [1] | SIEGEL R L, MILLER K D, FEDEWA S A, AHNEN D J, MEESTER R G S, BARZI A, et al. Colorectal cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67: 177–193. DOI: 10.3322/caac.v67.3 |
| [2] | ISELLA C, TERRASI A, BELLOMO A E, PETTI C, GALATOLA G, MURATORE A, et al. Stromal contribution to the colorectal cancer transcriptome[J]. Nat Genet, 2015, 47: 312–320. DOI: 10.1038/ng.3224 |
| [3] | MANTOVANI A, GERMANO G, MARCHESI F, LOCATELLI M, BISWAS S K. Cancer promoting tumor-associated macrophages:new vistas and open questions[J]. Eur J Immunol, 2011, 41: 2522–2525. DOI: 10.1002/eji.201141894 |
| [4] | KIM K J, WEN X Y, YANG H K, KIM W H, KANG G H. Prognostic implication of M2 macrophages are determined by the proportional balance of tumor associated macrophages and tumor infiltrating lymphocytes in microsatellite-unstable gastric carcinoma[J/OL]. PLoS One, 2015, 10: e0144192. doi: 10.1371/journal.pone.0144192. |
| [5] | EDIN S, WIKBERG M L, DAHLIN A M, RUTEGÅRD J, ÖBERG Å, OLDENBORG P A, et al. The distribution of macrophages with a M1 or M2 phenotype in relation to prognosis and the molecular characteristics of colorectal cancer[J/OL]. PLoS One, 2012, 7: e47045. doi: 10.1371/journal.pone.0047045. |
| [6] | WHITESIDE T L. The tumor microenvironment and its role in promoting tumor growth[J]. Oncogene, 2008, 27: 5904–5912. DOI: 10.1038/onc.2008.271 |
| [7] | QUANTE M, VARGA J, WANG T C, GRETEN F R. The gastrointestinal tumor microenvironment[J]. Gastroenterology, 2013, 145: 63–78. DOI: 10.1053/j.gastro.2013.03.052 |
| [8] | ERRENI M, MANTOVANI A, ALLAVENA P. Tumor-associated macrophages (TAM) and inflammation in colorectal cancer[J]. Cancer Microenviron, 2011, 4: 141–154. DOI: 10.1007/s12307-010-0052-5 |
| [9] | QIAN B Z, POLLARD J W. Macrophage diversity enhances tumor progression and metastasis[J]. Cell, 2010, 141: 39–51. DOI: 10.1016/j.cell.2010.03.014 |
| [10] | SICA A, MANTOVANI A. Macrophage plasticity and polarization:in vivo veritas[J]. J Clin Invest, 2012, 122: 787–795. DOI: 10.1172/JCI59643 |
| [11] | SCHMIEDER A, MICHEL J, SCHÖNHAAR K, GOERDT S, SCHLEDZEWSKI K. Differentiation and gene expression profile of tumor-associated macrophages[J]. Semin Cancer Biol, 2012, 22: 289–297. DOI: 10.1016/j.semcancer.2012.02.002 |
| [12] | LEWIS C E, POLLARD J W. Distinct role of macrophages in different tumor microenvironments[J]. Cancer Res, 2006, 66: 605–612. DOI: 10.1158/0008-5472.CAN-05-4005 |
| [13] | ALLAVENA P, SICA A, GARLANDA C, MANTOVANI A. The Yin-Yang of tumor-associated macrophages in neoplastic progression and immune surveillance[J]. Immunol Rev, 2008, 222: 155–161. DOI: 10.1111/j.1600-065X.2008.00607.x |
| [14] | HERRERA M, HERRERA A, DOMÍNGUEZ G, SILVA J, GARCÍA V, GARCÍA J M, et al. Cancer-associated fibroblast and M2 macrophage markers together predict outcome in colorectal cancer patients[J]. Cancer Sci, 2013, 104: 437–444. DOI: 10.1111/cas.2013.104.issue-4 |
| [15] | PAN Y F, TAN Y X, WANG M, ZHANG J, ZHANG B, YANG C, et al. Signal regulatory protein α is associated with tumor-polarized macrophages phenotype switch and plays a pivotal role in tumor progression[J]. Hepatology, 2013, 58: 680–691. DOI: 10.1002/hep.26391 |
| [16] | HUTCHESON J, BALAJI U, POREMBKA M R, WACHSMANN M B, McCUE P A, KNUDSEN E S, et al. Immunologic and metabolic features of pancreatic ductal adenocarcinoma define prognostic subtypes of disease[J]. Clini Cancer Res, 2016, 22: 3606–3617. DOI: 10.1158/1078-0432.CCR-15-1883 |
| [17] | ZHOU W, KE S Q, HUANG Z, FLAVAHAN W, FANG X, PAUL J, et al. Periostin secreted by glioblastoma stem cells recruits M2 tumour-associated macrophages and promotes malignant growth[J]. Nat Cell Biol, 2015, 17: 170–182. DOI: 10.1038/ncb3090 |
 2018, Vol. 39
2018, Vol. 39


