2. 海军军医大学(第二军医大学)长海医院病理科, 上海 200433;
3. 海军军医大学(第二军医大学)长海医院整形外科, 上海 200433
2. Department of Pathology, Changhai Hospital, Navy Medical University(Second Military Medical University), Shanghai 200433, China;
3. Department of Plastic Surgery, Changhai Hospital, Navy Medical University(Second Military Medical University), Shanghai 200433, China
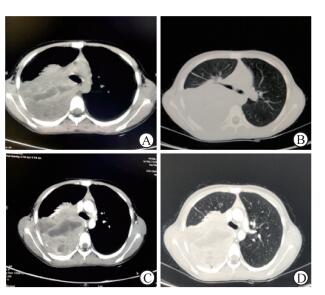
患儿,女,11岁,体质量30.5 kg,体表面积1.12 m2。既往体健,无药物、食物过敏史。因“反复咳嗽10 d伴发热”于2015年8月28日入院。入院前10 d无明显诱因出现咳嗽伴低热,抗炎治疗效果不佳,胸部X线片示右侧胸腔积液。体格检查:右侧胸廓呼吸运动受限,右肺叩诊浊音,右肺呼吸音减弱,双肺未闻及明显干、湿啰音。实验室检查:血常规、肝肾功能正常;癌胚抗原(CEA)<0.5 ng/mL、糖类抗原(CA)19-9为12.60 U/mL、CA72-4为0.96 U/mL、CA125为418.80 U/mL、CA15-3为9.90 U/mL、神经元特异性烯醇化酶(NSE)20.23 μg/L、甲胎蛋白(AFP)0.54 ng/mL。胸部CT扫描示(图 1A、1B):左肺野纹理清晰,右上胸腔可见不规则软组织肿块影,大小约为8.8 cm×9.7 cm,边界欠清,内见条状低密度影。胸部增强CT扫描示(图 1C、1D):右肺呈不规则均匀强化改变,体积缩小;气管及主要支气管通畅;右侧胸腔内见水样密度影。CT扫描诊断:右上胸腔内巨大占位并部分囊变坏死,考虑恶性肿瘤、肉瘤类可能,右侧胸腔积液伴右肺膨隆不全。后行CT引导下右肺穿刺活组织检查。电镜检查结果:小圆细胞排列密集成片,其中可见较丰富的血窦,其细胞核类圆形,染色质深浅不一,可见异型。免疫组化结果:波形蛋白(VIM,+)、CD99(+)、S-100(-)、结蛋白(Des,-)、NSE(-)、突触素(Syn,-)、上皮膜抗原(EMA,-)、肌红蛋白(MG,+)、转录增强因子3抗体(TEF-3,-)、Oct3/4(-)、Ki-67(40%)。病理诊断:(右肺)穿刺组织小圆细胞恶性肿瘤,结合免疫组化符合外周型原始神经外胚层肿瘤(peripheral primitive neuroectodermal tumor,pPNET)。拟行环磷酰胺、多柔比星及铂类方案化学治疗(环磷酰胺400 mg/m2第1天,多柔比星60 mg/m2第1天,顺铂75 mg/m2第1、2天),患儿家属拒行全身化学治疗,回当地行中医药治疗,患儿2个月后死亡。
|
图 1 患儿胸部CT扫描影像 A(纵隔窗), B(肺窗):胸部CT平扫(左肺野纹理清晰, 右上胸腔可见不规则软组织肿块影,大小约为8.8 cm×9.7 cm, 边界欠清, 内见条状低密度影); C(纵隔窗), D(肺窗):胸部CT增强扫描(右肺呈不规则均匀强化改变, 体积缩小; 气管及主要支气管通畅; 右侧胸腔内见水样密度影) |
2 讨论
原始神经外胚层肿瘤(PNET)是一组具有多向分化潜能的较少见的小圆细胞肿瘤,发生于中枢神经系统神经上皮细胞及外间叶组织,分为中枢型PNET和pPNET[1]。pPNET可发于全身各部位,多发于骨组织、胸壁部、躯干及四肢,而原发于肺内的PNET非常罕见。该病临床表现缺乏特异性,影像学特征不明显,术前确诊率低,易与其他肺部疾病混淆,且文献报道不多,故应引起临床医师的注意。PNET由Hart和Earle[2]于1973年首次报道,被认为是一种由神经嵴衍生而来的极其罕见的高度恶性肿瘤,病因尚不明确。目前,已将骨和骨外尤文肉瘤(Ewing’s sarcoma,EWS)与pPNET合称为“尤文家族肿瘤”[3-5],包括发生在胸壁上的Askin肉瘤。PNET具有恶性程度高、病程短、进展快、有转移倾向、误诊率高、预后差等特点,发病人群以儿童及青少年多见,男性多于女性[6]。有文献报道,PNET可发于肾脏、膀胱、胸壁、胰腺,以及女性生殖道内,且起病隐匿[7-9]。其临床表现主要为进行性增大的肿块及肿块所引起的压迫症状,影像学表现常为巨大不规则形软组织肿块影,病灶内偶见液化区,强化扫描为不均匀强化[6]。本例患儿以低热、咳嗽等非特异临床症状起病,CT扫描示右上胸腔巨大占位、部分囊变坏死,伴右侧胸腔积液。临床表现与影像学检查均无明显特异性;实验室检查NSE水平轻度增高,CA125水平明显增高,其余均正常。目前研究尚未发现PNET特异性的肿瘤标志物。据文献报道,小圆细胞肿瘤患者的CA125及NSE水平均有不同程度的升高[10]。肌间线蛋白、角蛋白、VIM与PNET有较强的相关性,而CEA、AFP、CA19-9等其他常见肿瘤标志物多在正常范围内[10]。本例患儿肿瘤标志物未检测完全,存在一定不足,在以后类似疾病的诊断中应加以避免。PNET的明确诊断还需依赖病理组织学检查。
PNET病理诊断借助于光镜下的小圆细胞特征形态的识别[11]。镜下表现由形态一致的小、圆形或椭圆形细胞组成,细胞质内含有糖原,有时可排列成“血管外周细胞瘤样”结构。超微结构观察可见肿瘤细胞较原始,胞质内有丰富的糖原、发育不良的细胞连接和不太明显的神经分化[12-15]。PNET常出现特征性的Homer-Wright菊形团结构[16],其典型特点是有一个原始神经上皮成分和室管膜母细胞性菊团(中央)排列在内的纤细的纤维网基质。其免疫组化对CD99、NSE、CD56、VIM等均敏感,符合2种以上的免疫组化指标即可确诊[17]。此外,约85%的EWS可见t(11;22)(q24;q12)染色体易位而形成的EWS-ELI1融合基因,10%~15%可见t(21;22)(q22;q12)染色体易位形成的EWS-ERC融合基因[18]。近年来还发现t(4;22)(q13;q12)易位形成融合基因EWSR1-SMARCA5[19-21]。因此PNET的诊断基于肿瘤细胞的病理形态和病理免疫组化,还可以通过遗传基因的融合分析得出结论。本例患儿进行了CT引导下穿刺活组织检查,组织病理标本镜下形态及免疫组化结果符合PNET,故予以明确诊断。
PNET误诊率高,尤其是原发于肺内的PNET,影像学检查常与其他肺部疾病混淆,诊断需与以下疾病相鉴别。(1)肺小细胞癌:好发于成年男性,与吸烟、空气污染、职业因素等密切相关;临床表现主要为咳嗽、痰中带血、发热、肿瘤压迫及转移表现;镜下肿瘤细胞体积小,呈弥漫分布或巢状分布,核圆形或卵圆形,核染色质细颗粒状,核仁不明显;细胞角蛋白5/6(CK5/6)和甲状腺转录因子1(TTF-1)等免疫组化阳性,VIM、弗里德白血病病毒插入位点1(Fli-1)和CD99阴性[22]。而PNET的上述指标的免疫组化检测结果正好相反。(2)恶性淋巴瘤:临床上常与淋巴母细胞型淋巴瘤相鉴别,患者常以无痛性进行性淋巴结肿大为首发症状;镜下常见瘤细胞染色质细腻或呈颗粒状,胞质少,细胞核近似圆形或卵圆形,偶可见小核仁;PNET镜下常见形态一致的幼稚的小圆细胞,胞质内含有可染性糖原,这是其与恶性淋巴瘤相鉴别的重要特征;恶性淋巴瘤中绝大多数白细胞共同抗原(LCA)免疫组化阳性;此外,CD3或CD20等阳性也可与PNET相鉴别[23]。(3)腺泡状横纹肌肉瘤:好发于青少年四肢深部软组织,瘤细胞呈片状或巢状排列,常见特征性的腺泡状结构,瘤细胞呈圆形、卵圆形或小多边形,核深染,胞质少;分化差的区域可出现小圆形细胞,另可见散在的核居周边分布、胞质弱嗜伊红染的多核巨细胞;Des、肌原调节蛋白MyoD1、肌细胞生成蛋白(myogenin)等免疫组化阳性,一般不表达CD99、NSE;遗传学研究显示72%~75%的病例含有特征性的t(2;13)(q35;q14)和PAX7-FKHR融合性基因[24]。
针对pPNET的治疗,目前尚无标准方案,临床推荐采用综合治疗模式。相关文献报道,推荐的治疗方案是采用术前新辅助化学治疗和早期手术切除,加以术后重点局部放射治疗及全身化学治疗[25]。新辅助化学治疗能够有效缩小原发肿瘤体积,减少肿瘤的转移,为施行肿瘤广泛性、根治性切除提供有利条件。化学治疗方案主要有CAV(环磷酰胺+多柔比星+长春新碱)、CAVD(环磷酰胺+多柔比星+长春新碱+地塞米松)[26]。张凤春等[27]通过临床病例分析及回顾性文献复习,对126例pPNET进行了研究,其中完全性手术切除88例、不完全性手术切除22例;综合治疗93例,单一疗法31例。上述4组的3年生存率分别为21.6%、0.0%、18.3%和9.7%。研究显示,完全性手术切除(手术切缘距肿瘤2~3 cm)及多学科综合治疗可以提高患者的1年、3年、5年生存率[28]。
尽管术后放射治疗和化学治疗能降低肿瘤的复发率和转移率,明显改善患者预后,但同时也会带来严重的不良反应,如严重的骨髓抑制和消化道反应。Qi等[29]研究表明康莱特注射液和参芪扶正注射液等传统中医药制剂可用于治疗pPNET等恶性肿瘤,同时联合使用能够降低恶病质的发生率,缓解放、化学治疗带来的严重不良反应,同时也能减轻联合用药带来的抗药性。
PNET预后极差,且与多种因素有关,多项回顾性研究显示,中枢型PNET患者的7年总生存率<30%,pPNET患者的1年生存率<60%、3年生存率<20%、5年生存率<5%,并提示肿瘤大小、组织学类型、转移情况、分期及治疗方式与总生存率和无病生存率相关[27, 30-32]。年龄、性别及肿瘤原发部位等因素对预后是否有影响尚不确切。因PNET发病率低,确定其预后的相关因素仍需较大样本的分析研究。
综上所述,原发于肺内的pPNET恶性程度高,预后差,难以治愈,且术前极易被漏诊、误诊。本例初发症状为反复咳嗽伴发热,影像学表现为右上胸腔内巨大占位。术前诊断极易与原发性支气管肺癌混淆,原因主要为本病的临床表现及影像学检查不具特异性,且原发于肺内的pPNET极为罕见。临床若见到症状体征及影像学表现与原发性支气管肺癌相似,但缺乏年龄、吸烟、家族遗传史等支持条件时,应警惕原发肺内pPNET可能。
| [1] | BURKHARDT J K, KOCKRO R A, DOHMEN-SCHEUFLER H, WOERNLE C M, BELLUT D, KOLLIAS S, et al. Small supratentorial, extraaxial primitive neuroectodermal tumor causing large intracerebral hematoma[J]. Neurol Med Chir (Tokyo), 2011, 51: 441–444. DOI: 10.2176/nmc.51.441 |
| [2] | HART M N, EARLE K M. Primitive neuroectodermal tumours of the brain in children[J]. Cancer, 1973, 32: 890–897. DOI: 10.1002/(ISSN)1097-0142 |
| [3] | JÜRGENS H, BIER V, HARMS D, BECK J, BRANDEIS W, ESTPÜLER G, et al. Malignant peripheral neuroectodermal tumors. A retrospective analysis of 42 patients[J]. Cancer, 1988, 61: 349–357. DOI: 10.1002/(ISSN)1097-0142 |
| [4] | SCHMIDT D, HARMS D, BURDACH S. Malignant peripheral neuroectodermal tumours of childhood and adolescence[J]. Virchows Arch A Pathol Anat Histopathol, 1985, 406: 351–365. DOI: 10.1007/BF00704304 |
| [5] | VARIEND S. Small cell tumors in childhood. A review[J]. J Pathol, 2000, 8: 59–65. |
| [6] | 李文一, 周俊林. 原始神经外胚层肿瘤的研究进展[J]. 国际医学放射学杂志, 2014, 37: 221–224. DOI: 10.3874/j.issn.1674-1897.2014.03.Z0303 |
| [7] | KHOSLA D, RAI B, PATEL F D, SREEDHARANUNNI S, DEY P, SHARMA S C. Primitive neuroectodermal tumor of the uterine cervix diagnosed during pregnancy:a rare case with review of literature[J]. J Obstet Gynaecol Res, 2014, 40: 878–882. DOI: 10.1111/jog.12238 |
| [8] | KAKKAR S, GUPTA D, KAUR G, RANA V. Primary primitive neuroectodermal tumor of kidney:a rare case report with diagnostic challenge[J]. Indian J Pathol Microbiol, 2014, 57: 298–300. DOI: 10.4103/0377-4929.134723 |
| [9] | BANERJEE S S, EYDEN B P, McVEY R J, BRYDEN A A, CLARKE N W. Primary peripheral primitive neuroectodermal tumor of urinary bladder[J]. Histopathology, 1997, 30: 486–490. DOI: 10.1046/j.1365-2559.1997.00524.x |
| [10] | ORDÓÑEZ N G, SAHIN A A. CA125 production in desmoplastic small round cell tumor:report of a case with elevated serum levels and prominent signet ring morphology[J]. Hum Pathol, 1998, 29: 294–299. DOI: 10.1016/S0046-8177(98)90050-8 |
| [11] | JIMENEZ R E, FOLPE A L, LAPHAM R L, RO J Y, O'SHEA P A, WEISS S W, et al. Primary Ewing's sarcoma/primitive neuroectodermal tumor of the kidney:a clinicopathologic and immunohistochemical analysis of 11 cases[J]. Am J Surg Pathol, 2002, 26: 320–327. DOI: 10.1097/00000478-200203000-00005 |
| [12] | ILLESPIE J J, ROTH L M, WILLS E R, EINBORN L H, WILLMAN J. Extraskeletal Ewing's sarcoma. Histologic and ultrastructural observations in three cases[J]. Am J Surg Pathol, 1979, 3: 99–108. DOI: 10.1097/00000478-197904000-00001 |
| [13] | HASHIMOTO H, TSUNEYOSHI M, DAIMARU Y, ENJOJI M. Extraskeletal Ewing's sarcoma. A clinicopathologic and electron microscopic. Analysis of 8 cases[J]. Acta Pathol Jpn, 1985, 35: 1087–1098. |
| [14] | SUH C H, ORDÓÑEZ N G, HICKS J, MACKAY B. Ultrastructure of the Ewing's sarcoma family of tumors[J]. Ultrastruct Pathol, 2002, 26: 67–76. DOI: 10.1080/01913120252959236 |
| [15] | WIGGER H J, SALAZAR G H, BLANE W A. Extraskeletal Ewing's sarcoma. An ultrastructural study[J]. Arch Pathol Lab Med, 1977, 101: 446–449. |
| [16] | 王亮, 张俊廷, 杨俊, 李桂林, 唐铠, 郝淑煜, 等. 椎管内原发外周性原始神经外胚层肿瘤四例报告及文献复习[J]. 中华神经外科杂志, 2012, 28: 70–73. DOI: 10.3760/cma.j.issn.1001-2346.2012.01.023 |
| [17] | JIN X, CAO J, LIU Y, BIAN F, ZHAO Q, WANG Y, et al. Primitive neuroectodermal tumor originating from the lung:a case report[J]. Oncol Lett, 2016, 12: 2692–2695. DOI: 10.3892/ol.2016.4973 |
| [18] | SUMEGI J, NISHIO J, NELSON M, FRAYER R W, PERRY D, BRIDGE J A. A novel t(4;22)(q31;q12) produces an EWSR1-SMARCA5 fusion in extraskeletal Ewing sarcoma/primitive neuroectodermal tumor[J]. Mod Pathol, 2011, 24: 333–342. DOI: 10.1038/modpathol.2010.201 |
| [19] | TURC-CAREL C, PHILIP I, BERGER M P, PHILIP T, LENOIR G M. Chromosome study of Ewing's sarcoma (ES) cell lines. Consistency of a reciprocal translocation t(11;22)(q24;q12)[J]. Cancer Genet Cytogenet, 1984, 12: 1–19. DOI: 10.1016/0165-4608(84)90002-5 |
| [20] | DE ALAVA E, PARDO J. Ewing tumor:tumor biology and clinical applications[J]. Int J Surg Pathol, 2001, 9: 7–17. DOI: 10.1177/106689690100900104 |
| [21] | DELATTRE O, ZUCMAN J, MELOT T, GARAU X S, ZUCKER J M, LENOIR G M, et al. The Ewing family of tumors-a sub group of small-round-cell tumors defined by specific chimeric transcripts[J]. N Engl J Med, 1994, 331: 294–299. DOI: 10.1056/NEJM199408043310503 |
| [22] | 汪美华, 凌扬, 周林艳. 免疫组织化学在肺小细胞癌诊断中的应用[J]. 肿瘤基础与临床杂志, 2015, 28: 148–149. |
| [23] | 李甘地. 免疫组织化学在淋巴瘤诊断和鉴别诊断中的应用[J]. 中华病理学杂志, 1997, 26: 182–184. DOI: 10.3760/j.issn:0529-5807.1997.03.025 |
| [24] | 邵馨, 谢军, 范钦和. 成人经典型腺泡状横纹肌肉瘤1例并文献复习[J]. 临床与实验病理学杂志, 2016, 32: 1394–1396. |
| [25] | APPLEBAUM M A, WORCH J, MATTHAY K K, GOLDSBY R, NEUHAUS J, WEST D C, et al. Clinical features and outcomes in patients with extraskeletal Ewing sarcoma[J]. Cancer, 2011, 117: 3027–3032. DOI: 10.1002/cncr.v117.13 |
| [26] | CARVAJAL R, MEYERS P. Ewing's sarcoma and primitive neuroectodermal family of tumors[J]. Hematol Oncol Clin North Am, 2005, 19: 501–525. DOI: 10.1016/j.hoc.2005.03.004 |
| [27] | 张凤春, 唐雷, 马越, 任芳, 王红霞, 徐迎春. 126例外周性原始神经外胚层瘤临床特征及预后因素分析[J]. 上海交通大学学报(医学版), 2012, 32: 1490–1497. DOI: 10.3969/j.issn.1674-8115.2012.11.020 |
| [28] | CRAVER R D, LIPSCOMB J T, SUSKIND D, VELEZ M C. Malignant teratoma of the thyroid with primitive neuroepithelial and mesenchymal sarcomatous components[J]. Ann Diagn Pathol, 2001, 5: 285–292. DOI: 10.1053/adpa.2001.27918 |
| [29] | QI F, ZHAO L, ZHOU A, ZHANG B, LI A, WANG Z, et al. The advantages of using traditional Chinese medicine as an adjunctive therapy in the whole course of cancer treatment instead of only terminal stage of cancer[J]. Biosci Trends, 2015, 9: 16–34. DOI: 10.5582/bst.2015.01019 |
| [30] | VON BUEREN A O, GERSS J, HAGEL C, CAI H, REMKE M, HASSELBLATT M, et al. DNA copy number alterations in central primitive neuroectodermal tumors and tumors of the pineal region:an international individual patient data meta-analysis[J]. J Neurooncol, 2012, 109: 415–423. DOI: 10.1007/s11060-012-0911-7 |
| [31] | 陈利娟, 贾永旭, 范菲菲, 李醒亚. 原始神经外胚层肿瘤中FLI-1的表达及预后因素分析[J]. 中华肿瘤杂志, 2010, 32: 917–920. |
| [32] | EL WESHI A, ALLAM A, AJARIM D, AL DAYEL F, PANT R, BAZARBASHI S, et al. Extraskeletal Ewing's sarcoma family of tumors in adults:analysis of 57 patients from a single institution[J]. Clin Oncol, 2010, 22: 374–381. DOI: 10.1016/j.clon.2010.02.010 |
 2018, Vol. 39
2018, Vol. 39


