2. 海军军医大学(第二军医大学)免疫学研究所, 上海 200433
2. Institute of Immunology, Navy Medical University(Second Military Medical University), Shanghai 200433, China
器官移植已成为多种终末期脏器疾病唯一、有效的治疗手段[1-3]。然而,如何解决器官移植过程中出现的缺血再灌注损伤、急慢性排斥反应以及免疫耐受等移植免疫学问题,尚需进一步研究。因此,建立合适的动物器官移植模型非常重要。目前研究人员已成功构建多种动物器官移植模型[4-6],其中小鼠具有开展移植免疫学研究的优势,包括遗传背景明确、成本及实验费用低廉、试剂来源广泛、免疫学检测方便和便于基因操控等,而小鼠心脏移植模型较肝脏、肾脏等器官移植模型具有实验设备要求低、操作简单、易于观察等优点,是移植免疫学研究的良好动物模型[7-9]。本研究在利用套管技术建立小鼠颈部异位心脏移植模型[10]的基础上,采用吻合法建立腹腔异位心脏移植模型,并对受体准备、供体心脏摘取和修整以及血管吻合技术进行改进,降低了操作难度,并获得了较高的手术成功率。现报告如下。
1 材料和方法 1.1 实验动物8~10周龄C57BL/6小鼠(H-2b)、BALB/c小鼠(H-2d),体质量20~25 g,购于海军军医大学(第二军医大学)实验动物中心,实验动物许可证号:SCXK(沪)2012-0003,无特殊病原体环境饲养,自由进食、饮水。同系移植供、受体均为C57BL/6小鼠,共20对;同种移植以BALB/c小鼠为供体,C57BL/6小鼠为受体,共17对。
1.2 主要实验器械XTZ-04型单人双目手术显微镜,显微外科手术器械,包括弯头显微镊、持针器、显微剪刀等[上海医疗器械(集团)有限公司];11-0无损伤带线缝合针、5-0丝线(上海浦东金环医疗用品股份有限公司);手术台、拉钩等均为自制。
1.3 手术方法 1.3.1 术前准备供体小鼠术前不禁食、不禁水,受体小鼠术前禁食8 h、不禁水。1%戊巴比妥钠同时麻醉供体及受体小鼠(30~40 mg/kg);受体小鼠腹部备皮,75%乙醇消毒;单人在手术显微镜下完成。
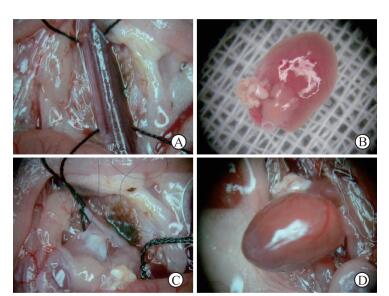
1.3.2 受体心脏植入前准备将受体小鼠麻醉后固定于自制手术台,用安尔碘皮肤消毒剂消毒腹部2次,经腹正中线剪开腹壁进腹,上至剑突,下至膀胱底部水平。两侧放置浸润温盐水的纱布,保护切口。用棉签将腹腔内部分肠襻提出腹腔,推向小鼠腹部切口外左侧,并用纱布包裹。钝性分离后腹膜,暴露腹主动脉和下腔静脉,结扎或电凝切断腰静脉。完全游离左肾静脉下方至膀胱底部水平以上的腹主动脉和下腔静脉,预置5-0丝线,暂不打结(图 1A)。
|
图 1 小鼠腹部异位心脏移植的手术过程 Fig 1 Surgical procedure of abdominal heterotopic heart transplantation in mice A: Recipient preparing; B: Donor preparing; C: Vascular anastomosis; D: Blood recovering |
1.3.3 供体心脏的摘取
将供体小鼠麻醉后固定于手术台。用安尔碘皮肤消毒剂消毒皮肤,“十”字切口开腹,显露肝上段下腔静脉并注入4 ℃含50U/mL肝素的生理盐水1 mL。全身肝素化后,沿双侧腋前线整块切除胸前壁及部分膈肌,将心、肺连同胸腺完整切除,迅速置于4 ℃乳酸钠林格注射液中,待修整。
1.3.4 供体心脏的修整待心脏完全停跳后,首先钝性游离、摘除双侧胸腺。再分离升主动脉,剪除周围结缔组织,并于第一分支血管发出前横断。然后,游离肺动脉主干并于左、右肺动脉分叉处横断。最后,使用6-0无损伤线结扎下腔静脉,切断结扎点远端组织,并结扎左、右肺门,切除所有的肺叶和多余组织,完成供体心脏的修整(图 1B)。
1.3.5 血管吻合及血流开放以活结依次结扎受体心脏近心端和远心端预置线,阻断腹主动脉和下腔静脉血流。29G针头穿刺下腔静脉,注入少量含肝素的生理盐水。显微剪沿穿刺孔剪开静脉壁约2 mm,与供体心脏肺动脉干直径相当,同样剪开腹主动脉壁约1~2 mm,与供体心脏升主动脉直径相当。取出供体心脏,置于小鼠左侧结肠下,表面覆盖浸润预冷生理盐水的纱布。动、静脉均采用两定点缝合法,动脉一侧缝合4~5针,先缝右侧。然后行供体心脏肺动脉-下腔静脉端侧吻合,一侧吻合约4针,最后1针打结前用生理盐水排空血管腔内空气,打结不宜过紧以免吻合口狭窄。最后,将供体心脏翻向受体右侧腹腔,缝合左侧动脉壁,收紧最后1针缝线前排空管腔内空气,以免形成气栓(图 1C)。吻合过程中可以用少量4 ℃生理盐水滴润供体心脏表面降温。吻合完毕后依次去除远端及近端结扎线,见冠状动脉充盈,供体心脏颜色由苍白转为红润(图 1D),1~2 min内复跳,并很快由纤颤转为规律的跳动。3-0丝线连续缝合关腹。受体小鼠置温箱内保温、复苏,术后可自由饮水、进食。
1.4 术后监测及排斥判断术后每天目视及触摸观察移植心脏的跳动,规律跳动持续3 d以上判为手术成功。3 d后目视及触摸均不能发现心脏跳动视为已经排斥,记录排斥反应的发生时间及存活期。
1.5 统计学处理采用SPSS 16.0软件进行数据分析。计数资料以率(百分比)表示,计量资料以x±s表示,组间比较采用两样本均数比较的t检验。检验水准(α)为0.05。
2 结果 2.1 预实验完成50对小鼠腹部异位心脏移植,主要用于练习显微外科血管吻合技术。模型制作早期,受体死亡的主要原因为麻醉意外、吻合口出血、血管栓塞等。
2.2 移植结果同系间移植完成20对,成功17对,成功率为85.0%;同种间移植完成15对,成功13对,成功率为86.7%;两组间移植成功率差异无统计学意义。受体血管吻合前准备时间平均为(11.2±2.5)min,供体心脏摘取和修整时间平均为(13.6±3.3)min,供、受体血管吻合时间平均为(21.7±3.5)min。同系间移植成功的供体心脏可以长期存活(超过100 d);同种间移植成功的供体心脏因发生排斥反应,存活期平均为(7.2±1.3)d。失败5对中,2对因动脉吻合口出血术后6 h内死亡;1对因血管栓塞术后2 d内死亡;1对因阻断时间过长,双下肢缺血损伤、瘫痪术后3 d死亡;1对术后2 d死亡,原因不详。
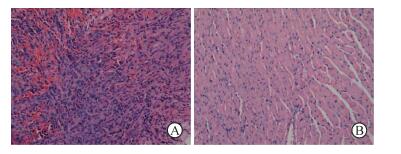
2.3 病理检测术后第7天,同种移植供体心脏明显充血、肿胀,光镜下可见心肌细胞变性、坏死,纤维断裂、间质水肿,肌束间及血管周围大量炎性细胞浸润(图 2A)。同系移植供体心脏心肌细胞无明显变性、水肿,血管周围仅少量淋巴细胞浸润(图 2B)。
|
图 2 小鼠腹部异位心脏移植术后心脏组织病理学检测 Fig 2 Histological examination of heart tissues after abdominal heterotopic heart transplantation in mice A: Allogeneic cardiac transplantation; B: Syngeneic cardiac transplantation. H-E staining. Original magnification: ×200 |
3 讨论
自19世纪60年代器官移植技术开始尝试应用于临床以来,移植免疫学家迫切希望建立简单、可靠的小动物器官移植模型。早期限于显微设备、缝线、吻合技术的不足,无法快速、可靠地重建移植器官的管道系统成为制约动物器官移植模型发展的最主要因素之一。自1979年Kamada利用套管技术重建门静脉而成功建立大鼠肝脏移植模型,套管技术开始应用于多种小动物器官移植模型的血管重建中,并为多个实验室的小鼠心脏移植模型所采用[11-13]。然而,套管法重建供体器官血管的缺点逐渐显现,包括易于形成血栓影响长期预后、材料难以获得、单人完成操作难度大、较难模拟临床实际情况等。随着设备、材料和技术的进步,缝合法逐渐开始应用于动物模型的血管重建,取得了较好的结果。综合国内外研究资料,缝合法相较于套管法可延长手术时间,两者手术成功率无明显差异,但在长期并发症尤其血栓形成方面缝合法具有一定优势[14-16]。有研究显示,腹腔异位心脏移植与颈部异位心脏移植在总手术时间、供体存活率和组织病理学表现方面差异无统计学意义,但颈部血管管径明显较腹腔血管管径细,操作难度增加[17]。
本研究在既往应用套管法建立小鼠颈部异位心脏移植模型的基础上,综合国内外相关报道,并经过50对预实验后,对小鼠腹部异位心脏移植模型的制作方法进行了改进,摸索出建立该模型的一些技巧,获得了较高的建模成功率。
3.1 腹部异位心脏移植模型的改进 3.1.1 操作流程有研究者先获取并修整供体心脏,然后进行受体手术,这样会增加供体心脏的冷保存时间,加重术后再灌注损伤[18]。本研究采用“受体血管吻合前准备-供体心脏的摘取、修整-血管吻合及血流开放”的手术流程,可以缩短供体心脏的冷保存时间,减少非实验因素对实验结果的影响。
3.1.2 手术麻醉乙醚麻醉的优点是停止吸入后动物可以很快苏醒,但容易出现麻醉过浅或过深的问题,麻醉过浅会影响手术操作,过深则会导致受体迅速死亡,尤其是血管吻合时需全神贯注操作,更容易出现麻醉过深的情况。采用腹腔注射戊巴比妥钠麻醉受体具有剂量安全窗大、麻醉效果确切的优点,能保障手术安全、顺利进行,故也将该麻醉方法应用于大鼠肝脏移植模型,效果良好[19]。
3.1.3 受体准备受体血管吻合区的准备非常重要,既往曾强调仔细分离下腔静脉与腹主动脉之间的粘连,并要求结扎肾动脉至髂动脉之间所有的腰动、静脉分支或属支,操作复杂且易造成出血。本研究发现动脉分支可不予处理,静脉属支中只需结扎最主要的1支腰静脉,这样既保证了手术视野内不会有静脉渗血,又减少了对受体不必要的损伤。
3.1.4 供体心脏获取既往有报道在供体心脏心跳动的情况下原位摘取供体心脏,该方法优点是操作时视野相对清楚、组织结构毗邻关系清晰;然而,其在肺脏气体交换功能已经丧失的情况下仍可以维持心脏跳动,增加了供体心脏的热缺血时间,必将加重缺血再灌注损伤[20]。本研究采用快速法联合切取供体心脏与肺脏,置于冰水混合物内促进供体心脏迅速停跳,然后进行修整,热缺血时间为5~10 s(结果未列出),可明显降低上述损伤。
3.1.5 血流阻断本研究早期采用血管夹同时阻断腹主动脉及下腔静脉,操作简单,但由于下腔静脉毗邻腹主动脉,而静脉壁较动脉壁薄,因此静脉血流阻断效果并不理想,术中易出血影响操作,术后易形成静脉血栓。本研究采用5-0丝线同时结扎动脉和静脉,操作简单、效果确切,且不会对血管内膜造成明显损害。
3.1.6 血管吻合血管吻合顺序为动脉右侧壁、静脉左侧壁、静脉右侧壁、动脉左侧壁,可以避免在吻合过程中反复翻动供体心脏。其中吻合静脉时近心段先做牵引结,远心端结扎固定后采用一针法吻合[21]。
3.2 注意事项(1)受体麻醉要适当,麻醉过量可导致动物血压偏低,影响血流开放后移植心脏的血液灌注,从而对移植物的长期存活产生不良影响。(2)单人修整供体心脏时应注意仔细操作、结扎确切,否则开放后易导致供体出血,同时注意不要损伤供体心脏,尤其是心耳部位。(3)动、静脉吻合时一般以每侧4~5针连续缝合为宜,在不漏血的情况下可适当减少针数,静脉打结时线不要拉得太紧;吻合时注意血管的自然走向,防止供体心脏流出道狭窄。也有研究者采用连续缝合间断打结的方法吻合供体升主动脉与受体腹主动脉,减少动脉血栓发生率[22]。(4)血流阻断时间不宜过长,一般控制在40 min内,否则可能导致下肢严重的缺血再灌注损伤,甚至造成瘫痪,影响受体存活。(5)动、静脉吻合结束打结前应用生理盐水排空血管腔内空气,防止发生栓塞。(6)缓慢开放动脉血流,使动脉吻合口有足够的时间充分膨胀,减少出血。(7)术后可经尾静脉注射生理盐水0.2~0.3 mL,补充血容量,有利于受体恢复。
总之,本研究改进的小鼠腹部异位心脏移植模型具有操作简便、成功率高等优势,经过适当的练习即可熟练并稳定建立,为进一步开展基于该模型的研究奠定了基础。
| [1] | SCHEUHER C. A review of organ transplantation:heart, lung, kidney, liver, and simultaneous liver-kidney[J]. Crit Care Nurs Q, 2016, 39: 199–206. DOI: 10.1097/CNQ.0000000000000115 |
| [2] | PONDROM S. White House Holds Summit on organ transplantation[J]. Am J Transplant, 2016, 16: 2241–2242. DOI: 10.1111/ajt.13942 |
| [3] | MALIK S, KASSAÏ B, COCHAT P. Overview of pediatric organ transplantation:current opinion and future perspectives on immunosuppression[J]. Curr Opin Organ Transplant, 2015, 20: 527–535. DOI: 10.1097/MOT.0000000000000224 |
| [4] | UMBRO I, TINTI F, SCALERA I, EVISON F, GUNSON B, SHARIF A, et al. Acute kidney injury and post-reperfusion syndrome in liver transplantation[J]. World J Gastroenterol, 2016, 22: 9314–9323. DOI: 10.3748/wjg.v22.i42.9314 |
| [5] | CHEN W, WU Y, SHIMIZU A, LIAN Y, TASAKI M, VILLANI V, et al. Rat-to-Chinese tree shrew heart transplantation is a novel small animal model to study non-Gal-mediated discordant xenograft humoral rejection[J]. Xenotransplantation, 2015, 22: 468–475. DOI: 10.1111/xen.12211 |
| [6] | JIANG X, NICOLLS M R. Working toward immune tolerance in lung transplantation[J]. J Clin Invest, 2014, 124: 967–970. DOI: 10.1172/JCI74701 |
| [7] | YOKOTA S, UEKI S, ONO Y, KASAHARA N, PÉREZ-GUTIÉRREZ A, KIMURA S, YOSHIDA O, et al. Orthotopic mouse liver transplantation to study liver biology and allograft tolerance[J]. Nat Protoc, 2016, 11: 1163–1174. DOI: 10.1038/nprot.2016.073 |
| [8] | DENG C Y, WANG X F, QI H, LI F R. Effects of anti-CD45RB monoclonal antibody for T lymphocyte subsets in mice heart transplantation model[J]. Scand J Immunol, 2016, 84: 86–94. DOI: 10.1111/sji.12446 |
| [9] | HUEPER K, HENSEN B, GUTBERLET M, CHEN R, HARTUNG D, BARRMEYER A, et al. Kidney transplantation:multiparametric functional magnetic resonance imaging for assessment of renal allograft pathophysiology in mice[J]. Invest Radiol, 2016, 51: 58–65. DOI: 10.1097/RLI.0000000000000205 |
| [10] | FU H, SONG S, LIU F, NI Z, TANG Y, SHEN X, et al. Dendritic cells transduced with SOCS1 gene exhibit regulatory DC properties and prolong allograft survival[J]. Cell Mol Immunol, 2009, 6: 87–95. DOI: 10.1038/cmi.2009.12 |
| [11] | KAMADA N, CALNE R Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage[J]. Transplantation, 1979, 28: 47–50. DOI: 10.1097/00007890-197907000-00011 |
| [12] | CHEN H, ZHANG Y, ZHENG D, PRASEEDOM R K, DONG J. Orthotopic kidney transplantation in mice: technique using cuff for renal vein anastomosis[J/OL]. PLoS One, 2013, 8: e77278. doi: 10.1371/journal.pone.0077278. |
| [13] | MARNI A, FERRERO M E. Heart and kidney transplantation in the rat using a mixed cuff-stent microsurgical technique[J]. Am J Surg, 1988, 155: 590–593. DOI: 10.1016/S0002-9610(88)80415-X |
| [14] | LIU F, KANG S M. Heterotopic heart transplantation in mice[J/OL]. J Vis Exp, 2007, 6: 238. doi: 10.3791/238. |
| [15] | YU Z, ZHOU X, YU S, XIE H, ZHENG S. IL-15 is decreased upon CsA and FK506 treatment of acute rejection following heart transplantation in mice[J]. Mol Med Rep, 2015, 11: 37–42. DOI: 10.3892/mmr.2014.2703 |
| [16] | RATSCHILLER T, DEUTSCH M A, CALZADA-WACK J, NEFF F, ROESCH C, GUENZINGER R, et al. Heterotopic cervical heart transplantation in mice[J/OL]. J Vis Exp, 2015, 102: e52907. doi: 10.3791/52907. |
| [17] | 陈义发, 尹辉, 梁宾勇, 黄致远, 刘洪亮, 陈孝平, 等. 两种异位心脏移植小鼠模型的建立和比较[J]. 中国实验动物学报, 2010, 18: 17–20. DOI: 10.3969/j.issn.1005-4847.2010.01.005 |
| [18] | 鲍春荣, 梅举, 丁芳宝, 张韫佼. 小鼠腹腔异位心脏移植模型方法改进[J]. 中华实验外科杂志, 2013, 30: 2748. DOI: 10.3760/cma.j.issn.1001-9030.2013.12.100 |
| [19] | SONG S, SHEN X, TANG Y, WANG Z, GUO W, DING G, et al. Sinomenine pretreatment attenuates cold ischemia/reperfusion injury in rats:the role of heme oxygenase-1[J]. Int Immunopharmacol, 2010, 10: 679–684. DOI: 10.1016/j.intimp.2010.03.011 |
| [20] | SCHRAMM R, SCHÄFERS H J, HAMACHER J, MENGER M D. Simplified technique for heterotopic vascularized heart transplantation in mice[J]. Microsurgery, 2006, 26: 212–213. DOI: 10.1002/(ISSN)1098-2752 |
| [21] | QIAN S G, FUNG J J, DEMETRIS A V, ILDSTAD S T, STARZL T E. Orthotopic liver transplantation in the mouse[J]. Transplantation, 1991, 52: 562–564. DOI: 10.1097/00007890-199109000-00039 |
| [22] | 崔得利, 谭长军, 刘忠. 连续缝合间断打结吻合动脉在小鼠心脏移植中的应用[J]. 复旦学报(医学版), 2016, 43: 211–214. DOI: 10.3969/j.issn.1672-8467.2016.02.015 |
 2018, Vol. 39
2018, Vol. 39


