2. 南通大学附属医院肿瘤科, 南通 226001;
3. 南通大学江苏省神经再生重点实验室, 南通 226001
2. Department of Oncology, Affiliated Hospital of Nantong University, Nantong 226001, Jiangsu, China;
3. Key Laboratory for Neuroregeneration of Jiangsu Province, Nantong University, Nantong 226001, Jiangsu, China
随着我国经济水平的飞速发展,饮食结构和生活方式的改变导致肥胖、2型糖尿病等代谢异常疾病的发病率剧增[1]。截止到2013年我国糖尿病患者已达到1.14亿[2]。有文献报道,肥胖引起的慢性炎症在2型糖尿病的发生、发展中起到重要作用[3],而这种代谢性炎症可引起体内内质网应激的发生,两者互为因果、互相促进[4]。双水杨酸酯(salsalate,SAL)是水杨酸盐的前体物质,作为类固醇消炎药治疗关节疼痛,研究表明其可缓解2型糖尿病、肥胖、脂肪肝和代谢综合征等多种代谢性疾病的糖脂紊乱[5-6],但具体机制尚不完全明确。本研究旨在探讨SAL对高脂饮食喂养的2型糖尿病小鼠血糖水平的影响及其机制。
1 材料和方法 1.1 实验动物与分组8周龄的雄性C57BL/6J SPF级小鼠20只[购于南通大学实验动物中心,实验动物使用许可证号:SYKX(苏)2012-0031),随机选取10只,分为2组:正常饮食组(n=5)和高脂饮食组(HFD组,高脂饲料:45% kcal猪油来源;Research Diets[7],n=5),共喂养40 d,观察高脂饮食糖尿病模型的建立情况。另外10只小鼠随机分为2组:对照组(高脂饮食和生理盐水混匀联合喂养,n=5)和高脂联合药物组[高脂饮食和0.5%(质量比)SAL混匀联合喂养[7],SAL组,n=5],共喂养40 d。所有动物实验都遵从南通大学和江苏省动物伦理委员会的条例。
1.2 葡萄糖耐量试验(glucose tolerance test,GTT)与胰岛素耐量试验(insulin tolerance test,ITT)[7]GTT:小鼠饥饿过夜后,经腹腔注射0.5 g/kg的D-葡萄糖,用血糖仪分别于注射后0、15、30、60、90、120 min检测小鼠尾静脉血血糖浓度。ITT:小鼠饥饿6 h后,经腹腔注射0.75 U/kg重组人胰岛素,分别于注射后0、15、30、60、90、120 min检测小鼠尾静脉血血糖浓度。
1.3 RNA提取与qPCR检测喂养40 d后处死小鼠,用TRIzol试剂(Invitrogen公司)抽提肝脏总RNA,用反转录试剂盒iScript cDNA(Bio-Rad公司)将RNA反转录成cDNA,以此cDNA为模板,用qPCR检测内质网应激相关蛋白CCAAT增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)、内质网DnaJ同系物4(endoplasmic reticulum-localized DnaJ 4,ERDJ4)、葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)和GRP94。检测试剂:FastStart Essential DNA Green Master(Roche公司);检测仪器:StepOne Real-Time PCR System(Applied Biosystems公司)。各检测基因引物序列如下:CHOP上游5'-CTG GAA GCC TGG TAT GAG GAT-3',下游5'-CAG GGT CAA GAG TAG TGA AGG T-3';ERDJ4上游5'-CCC CAG TGT CAA ACT GTA CCA G-3',下游5'-AGC GTT TCC AAT TTT CCA TAA ATT-3';GRP78上游5'-TCA TCG GAC GCA CTT GGA A-3',下游5'-CAA CCA CCT TGA ATG GCA AGA-3';GRP94上游5'-TCG TCA GAG CTG ATG ATG AAG T-3',下游5'-GCG TTT AAC CCA TCC AAC TGA AT-3';内参基因18S上游5'-AGT CCC TGC CCT TTG TAC ACA-3',下游5'-CGT TCC GAG GGC CTC ACT-3'。
1.4 蛋白质印迹法检测蛋白表达处理结束后处死小鼠,提取肝脏总蛋白。取总蛋白样品50 μg进行SDS-PAGE分离(10%分离胶和4%浓缩胶),通过湿法转印法将分离胶中的蛋白转移至0.45 μm的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,恒压100 V转膜120 min。PVDF膜经封闭1 h后,加入一抗:兔单克隆抗体CHOP、GRP78、GRP94、β-actin(美国Cell Signaling Technology公司,1:1 000稀释)和ERDJ4(英国Abcam公司,1:1 000稀释)。4 ℃孵育过夜,TBST洗膜4次,每次10 min。加入辣根过氧化物酶标记的相应二抗工作液(美国Cell Signaling Technology公司,1:10 000稀释),室温摇动孵育1 h,TBST洗膜4次,每次10 min;ECL(美国Millipore公司)化学发光,显影,拍照;蛋白质印迹法检测条带用凝胶成像仪分析系统Quantity One软件扫描灰度值。计算目的蛋白与内参蛋白β-actin灰度值的比值。
1.5 统计学处理采用SPSS 17.0软件进行数据分析,单因素组间数据(x±s)差异分析采用t检验,检验水准(α)为0.05。
2 结果 2.1 高脂饮食对小鼠血糖与胰岛素水平的影响在高脂饲料喂养40 d后,小鼠空腹血糖和胰岛素水平相比正常饮食小鼠均上升[(8.76±0.25) mmol/L vs (4.26±0.14) mmol/L,(1.08±0.05) ng/mL vs (0.22±0.02) ng/mL,t=2.216、3.472,P均<0.01]。GTT和ITT结果提示,腹腔注射后0~120 min内高脂饮食小鼠的糖耐量和胰岛素敏感性均下降(P<0.05或P<0.01,图 1)。证明高脂糖尿病模型建模成功。
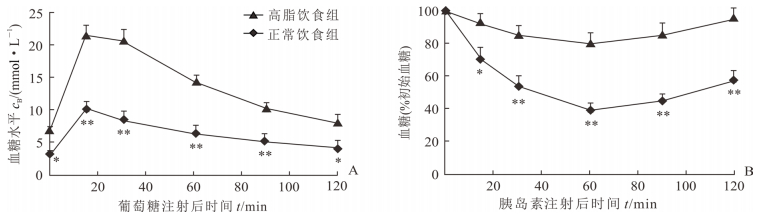
|
图 1 高脂饮食对小鼠糖代谢的影响 A: 葡萄糖耐量实验; B: 胰岛素耐量实验. *P<0.05, **P<0.01与高脂饮食组比较.n=5, x±s |
2.2 SAL对糖尿病小鼠血糖水平与葡萄糖耐量的影响
与对照组相比,SAL可降低糖尿病小鼠的随机血糖水平[(8.17±0.28) mmol/L vs (11.69±0.23) mmol/L,t=3.221,P<0.01]。GTT结果(图 2)显示,SAL组小鼠血糖水平在注射葡萄糖后0~120 min内的各时间点均低于对照组,并且在0、30、60 min这3个时间点2组血糖水平差异均有统计学意义(P<0.05或P<0.01)。
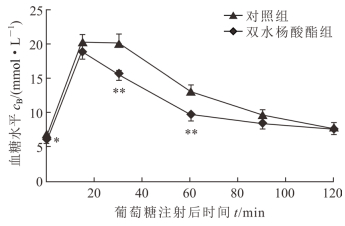
|
图 2 双水杨酸酯对高脂饮食诱导的糖尿病小鼠糖代谢的影响 *P<0.05, **P<0.01与对照组比较.n=5, x±s |
2.3 SAL对糖尿病小鼠空腹胰岛素水平与胰岛素耐量的影响
与对照组相比,SAL组小鼠的空腹胰岛素水平下降,但2组差异无统计学意义[(0.98±0.04) ng/mL vs (1.07±0.03) ng/mL,t=0.162,P>0.05)。ITT结果(图 3)显示,SAL对糖尿病小鼠的胰岛素耐受能力没有影响(P>0.05)。
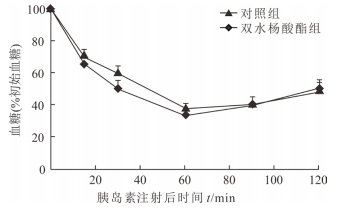
|
图 3 双水杨酸酯对高脂饮食诱导的糖尿病小鼠血胰岛素水平的影响 n=5, x±s |
2.4 SAL对糖尿病小鼠肝组织内质网应激相关蛋白mRNA表达的影响
与对照组相比,SAL组小鼠肝脏组织CHOP、ERDJ4、GRP78和GRP94的mRNA表达水平均下调,2组GRP78和GRP94的mRNA表达差异有统计学意义(P均<0.05,图 4)。表明SAL可降低高脂饮食诱导的糖尿病小鼠肝脏组织中的内质网应激,这可能是SAL调节糖尿病小鼠糖代谢紊乱的机制之一。
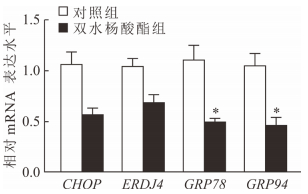
|
图 4 双水杨酸酯对ERS相关蛋白CHOP、ERDJ4、GRP78和GRP94 mRNA表达的影响 ERS:内质网应激; CHOP: CCAAT增强子结合蛋白同源蛋白; ERDJ4:内质网DnaJ同系物4; GRP:葡萄糖调节蛋白. *P<0.05与对照组比较. n=5, x±s |
2.5 SAL对糖尿病小鼠肝组织内质网应激相关蛋白表达的影响
与对照组相比,SAL组小鼠肝脏组织CHOP、ERDJ4、GRP78和GRP94的蛋白表达水平均下调,差异均有统计学意义(P<0.05或P<0.01,图 5)。表明SAL可改善高脂饮食诱导的糖尿病小鼠肝脏组织中的内质网应激。
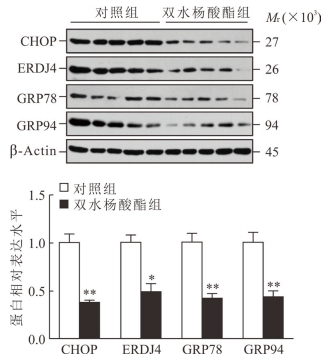
|
图 5 双水杨酸酯对ERS相关蛋白CHOP、ERDJ4、GRP78和GRP94蛋白表达的影响 ERS:内质网应激; CHOP: CCAAT增强子结合蛋白同源蛋白; ERDJ4:内质网DnaJ同系物4; GRP:葡萄糖调节蛋白. *P<0.05, **P<0.01与对照组比较. n=5, x±s |
3 讨论
1957年,Reid等[8]提出炎症参与了胰岛素抵抗过程,促进了2型糖尿病研究的发展。Hotamisligil等[9]发现脂肪组织中有高表达的肿瘤坏死因子,并且其对胰岛素抵抗有着决定性作用,这一假说得以证实。摄入能量多于消耗导致肥胖和2型糖尿病的发生,脂肪沉积在肝脏及骨骼肌等外周组织中引起系统性炎症[10-11]。先天性和获得性免疫机制参与炎性细胞的黏附和迁移,促进脂肪斑块和血小板在大血管内的聚集,从而导致心血管不良事件的发生率大幅增高[12]。
水杨酸盐类由植物中提取,至今已有3 500年的历史,主要用于镇痛和消炎,其作用机制和临床应用仍在不断探索中[13]。100年前就有文献报道服用高浓度的水杨酸钠可减轻2型糖尿病患者的症状,但是相关不良反应阻止了其临床应用。本研究所使用的SAL是水杨酸盐的二聚体,进入体内后在小肠中被分解为单体发挥作用,既往用于治疗关节疼痛。研究表明,SAL可以改善2型糖尿病甚至糖尿病初期的血糖、血脂等多种代谢异常[14]。Goldfine等[15]评价了SAL治疗2型糖尿病1年后的有效性和安全性,发现与安慰剂组相比使用SAL治疗48周后患者的糖化血红蛋白水平降低了0.37%,血循环中的白细胞、中性粒细胞和淋巴细胞计数降低,尿酸、空腹血糖和三酰甘油水平降低,脂联素水平增高,但尿白蛋白经过校正后肾小球滤过率无明显改变。Salastekar等[16]发现服用SAL 30个月可改善罹患超重度心血管疾病患者的糖代谢,这些患者同时还服用他汀类降脂药物。
SAL改善糖代谢的机制尚未完全明了,研究发现有以下几种:(1)激活棕色脂肪。SAL可选择性增加棕色脂肪中脂肪酸的摄取,减少细胞内脂质沉积,提高直肠内温,从而减轻体质量和改善糖耐量。体外实验发现SAL可以上调棕色脂肪细胞中解偶联蛋白1(uncoupling protein 1,UCP1)的表达,并增强甘油的释放[7, 17]。(2)通过下调脂肪组织中11β-羟基类固醇脱氢酶1(11β-hydroxysteroid dehydrogenase 1,11β-HSD1)的表达,提高胰岛素敏感性。Nixon课题组用水杨酸盐处理肥胖小鼠4周后,其糖耐量及高胰岛素血症改善,脂肪组织中11β-HSD1基因表达水平和酶活性下调,同时,服用水杨酸盐的男性皮下脂肪中11β-HSD1表达下降,尿中皮质醇代谢产物水平也下降[18]。(3)激活线粒体功能,解偶联线粒体呼吸链,通过协助质子传递降低其电导电位[19]。Smith等[17]发现SAL可以增加机体耗氧量,降低血糖水平和肝脂肪含量。(4)本研究首次发现内质网应激参与了SAL降低糖尿病小鼠的血糖过程。本研究应用高脂饮食联合SAL共同饲养雄性小鼠40 d,发现小鼠随机血糖水平降低、糖耐量更好,并且首次发现肝脏组织CHOP、ERDJ4、GRP78和GRP94的mRNA和蛋白表达水平均较对照组低,高糖高脂毒性引起的内质网应激得到缓解,上述结果提示SAL可通过减轻体内内质网应激程度缓解高糖状态。内质网应激是2型糖尿病发生、发展的重要机制,其是指内质网中蛋白质合成、修饰和降解之间的平衡被细胞内外的环境因素破坏后造成细胞内异常蛋白堆积或Ca2+超载或缺氧,触发非折叠蛋白反应。高糖高脂引发体内内质网应激时,内质网跨膜蛋白—蛋白激酶R样内质网激酶通过寡聚化和自身磷酸化活化导致其下游因子真核翻译起始因子2α亚单位(eukaryotic translation initiation factor 2α subunit,eIF2α)磷酸化,磷酸化的eIF2α可直接抑制蛋白合成,致使新生的多肽流出内质网减轻其负担,维持细胞内环境平衡。而当刺激持续时,内质网应激将上调CHOP等的表达诱导细胞凋亡[20]。本研究发现,SAL导致糖尿病小鼠肝脏内高表达的CHOP下调,从而提示高糖高脂毒性导致的内质网应激缓解。同时,ERDJ4、GRP78和GRP94在本研究中也有类似的趋势。在内质网中,新生蛋白的折叠和重组需要一系列分子伴侣的参与,热休克蛋白70分子伴侣结合免疫球蛋白(binding immunoglobulin protein,BiP)就是其中一员,ERDJ族蛋白可激活BiP的ATP酶活性并稳定其与底物的结合。内质网应激发生时ERDJ4表达上调,可参与协助清除内质网应激所产生的错误折叠的蛋白质[21]。GRP94和BiP/GRP78是内质网应激发生时的“前哨兵”,其增加表达、参与清除内质网中错误折叠蛋白质,当应激缓解后其表达下调[22],故给予SAL后这些重要分子的表达下调预示着内质网内错误折叠蛋白的减少和内质网应激的减轻。
对于SAL对血胰岛素的作用众说纷纭,很多文献报道SAL可通过增加胰岛素敏感性达到降低血糖的作用[5, 13, 23],但更多的研究未发现其可增加胰岛素的水平,本研究也得到了类似的结果。有文献报道SAL治疗非糖尿病的肥胖和超重患者有效,可减慢血胰岛素的廓清[24]。也有文献报道SAL的实验浓度远低于引起血胰岛素变化的浓度[14]。
综上所述,本研究发现SAL可通过缓解糖尿病小鼠肝脏内质网应激,增加糖耐量,降低血糖,该研究为SAL治疗2型糖尿病奠定了理论基础。
| [1] | BRAGG F, HOLMES M V, IONA A, GUO Y, DU H, CHEN Y, et al. Association between diabetes and cause-specific mortality in rural and urban areas of China[J]. JAMA, 2017, 317: 280–289. DOI: 10.1001/jama.2016.19720 |
| [2] | XU Y, WANG L, HE J, BI Y, LI M, WANG T, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310: 948–959. DOI: 10.1001/jama.2013.168118 |
| [3] | WEI X, SONG H, YIN L, RIZZO M G, SIDHU R, COVEY D F, et al. Fatty acid synthesis configures the plasma membrane for inflammation in diabetes[J]. Nature, 2016, 539: 294–298. DOI: 10.1038/nature20117 |
| [4] | SHAN B, WANG X, WU Y, XU C, XIA Z, DAI J, et al. The metabolic ER stress sensor IRE1α suppresses alternative activation of macrophages and impairs energy expenditure in obesity[J]. Nat Immunol, 2017, 18: 519–529. DOI: 10.1038/ni.3709 |
| [5] | LIANG W, VERSCHUREN L, MULDER P, VAN DER HOORN J W, VERHEIJ J, VAN DAM A D, et al. Salsalate attenuates diet induced non-alcoholic steatohepatitis in mice by decreasing lipogenic and inflammatory processes[J]. Br J Pharmacol, 2015, 172: 5293–5305. DOI: 10.1111/bph.13315 |
| [6] | GOLDFINE A B, BUCK J S, DESOUZA C, FONSECA V, CHEN Y D, SHOELSON S E, et al. Targeting inflammation using salsalate in patients with type 2 diabetes:effects on flow-mediated dilation (TINSAL-FMD)[J]. Diabetes Care, 2013, 36: 4132–4139. DOI: 10.2337/dc13-0859 |
| [7] | VAN DAM A D, NAHON K J, KOOIJMAN S, VAN DEN BERG S M, KANHAI A A, KIKUCHI T, et al. Salsalate activates brown adipose tissue in mice[J]. Diabetes, 2015, 64: 1544–1554. DOI: 10.2337/db14-1125 |
| [8] | REID J, MacDOUGALL A I, ANDREWS M M. Aspirin and diabetes mellitus[J]. Br Med J, 1957, 2: 1071–1074. DOI: 10.1136/bmj.2.5053.1071 |
| [9] | HOTAMISLIGIL G S, SHARGILL N S, SPIEGELMAN B M. Adipose expression of tumor necrosis factor-alpha:direct role in obesity-linked insulin resistance[J]. Science, 1993, 259: 87–91. DOI: 10.1126/science.7678183 |
| [10] | WU H, BALLANTYNE C M. Skeletal muscle inflammation and insulin resistance in obesity[J]. J Clin Invest, 2017, 127: 43–54. DOI: 10.1172/JCI88880 |
| [11] | SHOELSON S E, LEE J, GOLDFINE A B. Inflammation and insulin resistance[J]. J Clin Invest, 2006, 116: 1793–1801. DOI: 10.1172/JCI29069 |
| [12] | HAUSER T H, SALASTEKAR N, SCHAEFER E J, DESAI T, GOLDFINE H L, FOWLER K M, et al. Effect of targeting inflammation with salsalate:the TINSAL-CVD randomized clinical trial on progression of coronary plaque in overweight and obese patients using statins[J]. JAMA Cardiol, 2016, 1: 413–423. DOI: 10.1001/jamacardio.2016.0605 |
| [13] | PEDERSEN B K, FEBBRAIO M A. Diabetes:treatment of diabetes mellitus:new tricks by an old player[J]. Nat Rev Endocrinol, 2010, 6: 482–483. DOI: 10.1038/nrendo.2010.130 |
| [14] | GOLDFINE A B, CONLIN P R, HALPERIN F, KOSKA J, PERMANA P, SCHWENKE D, et al. A randomised trial of salsalate for insulin resistance and cardiovascular risk factors in persons with abnormal glucose tolerance[J]. Diabetologia, 2013, 56: 714–723. DOI: 10.1007/s00125-012-2819-3 |
| [15] | GOLDFINE A B, FONSECA V, JABLONSKI K A, CHEN Y D, TIPTON L, STATEN M A, et al. Salicylate (salsalate) in patients with type 2 diabetes:a randomized trial[J]. Ann Intern Med, 2013, 159: 1–12. DOI: 10.7326/0003-4819-159-1-201307020-00003 |
| [16] | SALASTEKAR N, DESAI T, HAUSER T, SCHAEFER E J, FOWLER K, JOSEPH S, et al. Salsalate improves glycemia in overweight persons with diabetes risk factors of stable statin-treated cardiovascular disease:a 30-month randomized placebo-controlled trial[J]. Diabetes Obes Metab, 2017, 19: 1458–1462. DOI: 10.1111/dom.12940 |
| [17] | SMITH B K, FORD R J, DESJARDINS E M, GREEN A E, HUGHES M C, HOUDE V P, et al. Salsalate (salicylate) uncouples mitochondria, improves glucose homeostasis, and reduces liver lipids independent of AMPK-β1[J]. Diabetes, 2016, 65: 3352–3361. DOI: 10.2337/db16-0564 |
| [18] | NIXON M, WAKE D J, LIVINGSTONE D E, STIMSON R H, ESTEVES C L, SECKL J R, et al. Salicylate downregulates 11β-HSD1 expression in adipose tissue in obese mice and in humans, mediating insulin sensitization[J]. Diabetes, 2012, 61: 790–796. DOI: 10.2337/db11-0931 |
| [19] | GUTKNECHT J. Salicylates and proton transport through lipid bilayer membranes:a model for salicylate-induced uncoupling and swelling in mitochondria[J]. J Membr Biol, 1990, 115: 253–260. DOI: 10.1007/BF01868640 |
| [20] | KYATHANAHALLI C, ORGAN K, MORECI R S, ANAMTHATHMAKULA P, HASSAN S S, CARITIS S N, et al. Uterine endoplasmic reticulum stress-unfolded protein response regulation of gestational length is caspase-3 and -7-dependent[J]. Proc Natl Acad Sci USA, 2015, 112: 14090–14095. DOI: 10.1073/pnas.1518309112 |
| [21] | LAI C W, OTERO J H, HENDERSHOT L M, SNAPP E. ERdj4 protein is a soluble endoplasmic reticulum (ER) DnaJ family protein that interacts with ER-associated degradation machinery[J]. J Biol Chem, 2012, 287: 7969–7978. DOI: 10.1074/jbc.M111.311290 |
| [22] | MARZEC M, ELETTO D, ARGON Y. GRP94:an HSP90-like protein specialized for protein folding and quality control in the endoplasmic reticulum[J]. Biochim Biophys Acta, 2012, 1823: 774–787. DOI: 10.1016/j.bbamcr.2011.10.013 |
| [23] | FLEISCHMAN A, SHOELSON S E, BERNIER R, GOLDFINE A B. Salsalate improves glycemia and inflammatory parameters in obese young adults[J]. Diabetes Care, 2008, 31: 289–294. DOI: 10.2337/dc07-1338 |
| [24] | KIM S H, REAVEN G. Salsalate treatment for prediabetes:a therapeutic alternative?[J]. Diabet Med, 2017, 34: 592–594. DOI: 10.1111/dme.2017.34.issue-4 |
 2018, Vol. 39
2018, Vol. 39


