2. 嘉兴市妇幼保健院药学部, 浙江 314050;
3. 上海交通大学医学院附属新华医院药学部, 上海 200093
2. Department of Pharmacy, Jiaxing Maternity and Child Health Care Hospital, Jiaxing 314050, Zhejiang, China;
3. Department of Pharmacy, Xinhua Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200093, China
由于肿瘤治疗的难度和复杂性,化学治疗药物和基因药物的协同传递系统成为近年来肿瘤治疗研究的热点。共递送系统可克服单一疗法的不足,进而可减少化学治疗药物的剂量,增加药物在靶器官的分布量、减轻毒副作用,从而提高抗肿瘤效果;同时保护携带基因的稳定性和完整性,提高了基因的转染效率,以达到减轻毒副作用和提高疗效的目的[1]。因此,选择共递送系统的载体需考虑以下几个特点:(1)有效包载化学治疗药物并保护核苷酸不被降解;(2)减少网状内皮系统(reticuloendothelial system,RES)清除,发挥高通透性和滞留效应(enhanced permeability and retention effect,EPR);(3)载体能有效跨膜摄取;(4)保护基因不受内涵体溶酶体的破坏降解,使基因和化学治疗药物有效释放[2]。
多肽类载体主要是指各种细胞穿透肽。在基因治疗方面其因高效传递基因药物的能力及低毒性、容易制备而在过去20多年中成为研究热点。固有无序蛋白(intrinsically disordered protein,IDP)是一类在天然状态下具有不确定的三维结构,但是依然能够行使正常生物学功能的蛋白质,在分子识别、细胞周期调控、细胞信号转导、细胞内调节等生理活动中具有关键作用[3]。许多细胞穿膜肽(cell penetrating peptide,CPP)的穿膜效应依赖于其α-螺旋和β-折叠的空间构象,然而这种空间结构一方面加速其进入细胞,另一方面也会引起膜裂解行为,在一定程度上限制了CPP的应用。虽然CPP跨过细胞膜涉及很多机制,但是至今已应用的CPP负载药物跨膜都以内吞作用为主,而内吞作用跨膜时存在内吞体捕获和溶酶体降解的问题。故寻找一种低裂解性并通过非吞噬作用进入细胞膜的CPP将会给肿瘤的治疗带来新的机遇。有研究发现了一种通过跨细胞膜易位就可以直接穿过细胞膜的IDP-细胞质定位的内化肽6(cytosol-localizing internalization peptide 6,CL),其结构中发挥作用的是谷氨酸,通过非内吞体途径进入细胞;富含的精氨酸可赋予其穿膜效应和载DNA或RNA能力;D-脯氨酸使其蛋白酶水解稳定性比较高,可见CL有望成为递送细胞穿透能力弱和易发生溶酶体降解的药物分子进入细胞并稳定存在于细胞中的载体[4]。
细胞内含有较高浓度(约2~10 mmol/L)的谷胱甘肽(glutathione,GSH),是细胞外(约2~20 μmol/L)的100~1 000倍;而肿瘤细胞内的GSH浓度是正常细胞的4倍[5]。携带药物的纳米胶束进入肿瘤细胞后,其可断裂的二硫键在高浓度GSH作用下被打开,使载体降解,纳米胶束在胞内释放药物发挥药效[6]。硫辛酸(lipoic acid,LA)是一种具有分子内五元环二硫键结构且末端为羧基的两亲性物质,与细胞膜脂质双分子层有较好的亲和力[7],具有较好的包载化学治疗药物作用,且其二硫键可在细胞内还原性条件下裂解,为药物在肿瘤部位的有效释放提供条件[8-9]。
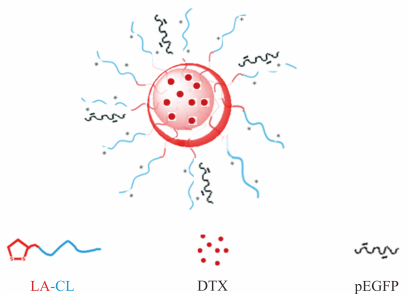
基于上述理论,本实验构建了一种LA修饰的细胞质定位的内化肽(LA-CL),克服了当前多肽类载体存在内吞体捕获、溶酶体降解、引入基因片段进入细胞能力不强、基因转染效率不高、不可降解的不足。将此多肽载体通过半胱氨酸进行交联,利用LA的含有二硫键的五元环形成疏水性空腔包裹疏水性化学治疗药多西他赛(docetaxel,DTX),二硫键可以响应肿瘤细胞内还原性条件触发释放的化学治疗药,再利用具有穿膜效应的IDP上面富有的带正电的精氨酸载增强型绿色荧光蛋白质粒(plasmid enhanced green fluorescent protein,pEGFP),见图 1。并初步对该载体共载基因和化学治疗药的性能进行体外评价。
|
图 1 LA-CLss/DTX/pEGFP纳米复合物示意图 Fig 1 Sketch of LA-CLss/DTX/pEGFP nanocomplex LA: Lipoic acid; CL: Cytosol-localizing internalization peptide 6; LA-CLss: Disulfide cross-linked lipoic acid modified intrinsically disordered protein-cytosol-localizing internalization peptide 6; DTX: Docetaxel; pEGFP: Plasmid enhanced green fluorescent protein |
1 材料和方法 1.1 主要仪器与试剂
ZS90型激光粒度测定仪(英国Malvern公司),倒置荧光显微镜(德国Leica公司),透射电子显微镜(日本Hitachi公司),全自动酶标仪(美国Thermo公司)。LA [生工生物工程(上海)股份有限公司],pEGFP(上海英为信生物科技有限公司),支化聚乙烯亚胺(branched polyethyleneimine,bPEI;相对分子质量为25 000;美国Sigma公司),BCA蛋白浓度测定试剂盒(美国Thermo公司),胎牛血清(fetal bovine serum,FBS)、DMEM培养液(美国Gibco公司),其他试剂均为分析纯。
1.2 二硫键交联的LA修饰的交联CL(LA-CLss)多肽的合成与表征本研究采用固相合成法合成LA修饰的多肽单体,序列为LA-KVRVRVRVDPTRVRERVK(DP是D-脯氨酸),并用反相高效液相色谱法(HPLC)纯化。采用半胱氨酸盐酸盐进行交联合成LA-CLss:将多肽单体溶于甲醇中,加入比例分别为2.5%、5%、10%、20%的半胱氨酸盐酸盐进行交联,在室温下聚合12 h,N2吹干甲醇;产物用去离子水经透析膜(截留相对分子质量为3 500)纯化12 h、冻干,去除多余单体。所得产物分别命名为LA-CLss1、LA-CLss2、LA-CLss3、LA-CLss4。取合成好的多肽聚合物5 mg溶于0.5 mL D2O,用600 MHz核磁共振氢谱(1HNMR)仪和凝胶色谱法进行产物分析。
1.3 LA-CLss/pEGFP纳米复合物构建与表征取2 μg pEGFP和LA-CLss以不同氮磷比(N/P,2.5、5、10、20、40、80)自组装形成的复合物溶于1 mL PBS(pH 7.4)中,涡旋30 s,室温下孵育30 min。用ZS90型激光粒度测定仪测定粒径和zeta电位。
1.4 琼脂糖凝胶电泳考察载体LA-CLss对pEGFP的包裹能力和保护能力包裹能力:制备N/P值为0.5、1、2、3、4、5、10、20的LA-CLss3/pEGFP纳米复合物,孵育30 min后将含1 μg pEGFP的纳米复合物加入含1%琼脂糖凝胶的TAE(Tris碱、乙酸、EDTA配制)缓冲液的孔中,100 V电泳30 min,在紫外光下显像。
保护能力:通过耐肝素竞争置换实验考察。制备浓度分别为5、10、20、50 μg/mL的肝素水溶液,分别加入LA-CLss3/pEGFP纳米复合物(N/P=10),共孵育1 h后取样进行凝胶电泳分析,以bPEI-25k/pEGFP(N/P=10时肝素水溶液浓度为20、50 μg/mL)作为对照。
1.5 芘荧光探针光谱法测定LA-CLss3的临界胶束浓度以丙酮为溶剂配制6×10-6 mol/L的芘溶液,将丙酮自然挥发,然后在含微量芘的容量瓶中加入空白胶束溶液,最后定容,配制LA-CLss3浓度为1× 10-5~2.0 mg/mL的一系列溶液(1×10-5、5×10-5、1×10-4、5×10-4、1×10-3、5×10-3、0.01、0.05、0.1、0.5、1.0、2.0),25 ℃下避光孵育2 h以上,用F-7000型荧光分光光度计(日本Hitachi公司)测定各溶液的荧光光谱图。荧光扫描的激发波长为333 nm,激发狭缝设置为5.0 nm,发射狭缝设置为2.5 nm,扫描速度为500 nm/min。记录373 nm(I1)和383 nm(I3)波长处的荧光值,以空白载体浓度对数值为横坐标,I1/I3为纵坐标绘图。
1.6 超声乳化法制备载DTX胶束取1 mg DTX溶于1 mL二氯甲烷中,将20 mg与半胱氨酸交联后的载体(LA-CLss3)溶于1 mL二氯甲烷中。将上述2种溶液混合后与8 mL纯水混合,在冰浴条件下用超声探头进行超声处理,功率200 W,时间30 s。将乳化完全的LA-CLss3/DTX混合溶液迅速转移至磁力搅拌器上盛有10 mL蒸馏水的烧杯里,搅拌5 h,除去溶液中的二氯甲烷。用0.45 μm微孔滤膜过滤溶液除去未包封的DTX颗粒。
采用HPLC测定DTX浓度。高效液相仪:Agilent 1260型,美国Agilent Technologies公司;流动相为乙腈:水(60:40,体积比);流速为1.0 mL/min;紫外检测波长为230 nm;色谱柱为C18柱(Diamonsil,5 μm,250 mm×4.6 mm);柱温为30 ℃,载药量和包封率计算公式为:载药量(%)=(胶束中药物的质量/载药胶束质量)×100%,包封率(%)=(胶束中药物的质量/投入药物的质量)×100%。
1.7 LA-CLss/pEGFP纳米复合物HEK293细胞摄取能力的测定取HEK293细胞(ATTC® CRL-3216,中国科学院生物化学与细胞生物研究所)按3×105/孔的密度接种于12孔板,在5% CO2、37 ℃培养箱中培养24 h后更换为无血清培养液。之后每孔加入含0.75 nmol羟基荧光素(FAM)标记的siRNA的N/P=40的纳米复合物。培养4 h后弃培养液,消化、离心,重悬于300 μL PBS中,用流式细胞仪(美国BD公司)检测细胞摄取情况。
1.8 LA-CLss/pEGFP纳米复合物基因转染情况的检测取HEK293细胞按1×105/孔的密度接种于48孔板,培养24 h,转染前更换为无血清培养液。每孔加入含0.5 μg pEGFP的不同N/P值(10、20、40、80)的纳米复合物。培养4 h后换含10% FBS的培养液。pEGFP转染细胞48 h后,用荧光显微镜观察,确定最佳半胱氨酸盐酸盐交联度,并拍照。
1.9 透析袋法考察载DTX胶束的体外释放情况选取截留相对分子质量为3 500的透析袋,透析介质为pH=7.4含有0.5%(质量百分比浓度)的吐温-80的PBS,分别加入DTT(用来模拟肿瘤细胞内高GSH还原性条件,0.05 mol/L)和不加DTT,37 ℃进行考察。按1.6项下方法制备LA-CLss3/DTX纳米胶束。取2 mL LA-CLss3/DTX PBS于透析袋中,放置于50 mL PBS中,100 r/min下磁力搅拌,37 ℃,分别于2、4、6、8、10、12、24、48、72 h时间点取1 mL外液,并补加1 mL释放介质,按1.6项下方法行HPLC测定其浓度。绘制体外释放曲线。
1.10 统计学处理用SPSS 18.0软件进行统计学分析。数据以x±s表示,组间比较采用方差分析(ANOVA)。检验水准(α)为0.05。
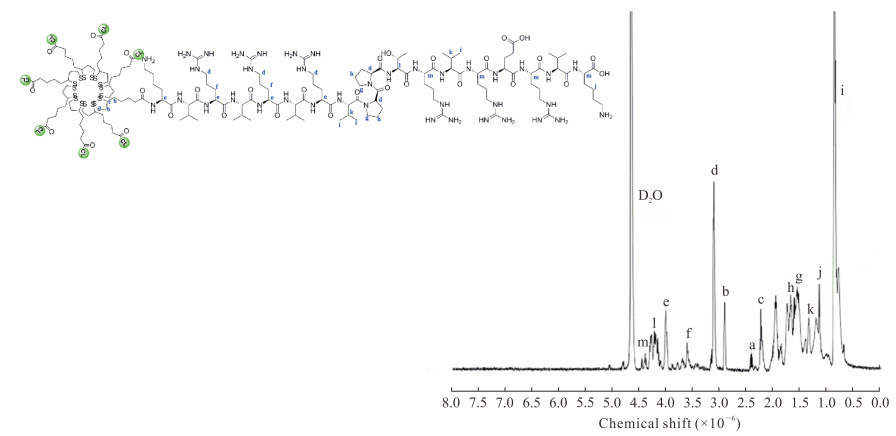
2 结果 2.1 多肽聚合物LA-CLss结构鉴定和凝胶色谱检测结果图 2为合成的LA-CLss的谱图,化学位移为2.25~3.16(峰a、b和c)归属于LA的质子峰,3.13(峰d)、3.63(峰f)和4.06(峰e)为精氨酸中邻近叔碳的−CH2−峰。0.82(峰i)和1.32(峰k)分别归属于缬氨酸伯碳和叔碳上的氢。1.53~1.74(峰g和h)归属于脯氨酸上的−CH2−。1.14(峰j)归属于赖氨酸的仲碳。4.23(峰l)归属于LA-CLss的叔碳质子峰。4.40(峰m)归属于精氨酸中胍基附近的−CH2−。不同交联度LA-CLss的合成条件和相对分子质量如表 1所示,随着半胱氨酸比例的增加LA-CLss的相对分子质量逐渐增大,表明复合物多肽合成成功。
|
图 2 LA-CLss的1HNMR谱图 Fig 2 1HNMR spectrum of LA-CLss LA-CLss: Disulfide cross-linked lipoic acid modified cytosol-localizing internalization peptide 6; a, b, c: Lipoic acid; d, f, e: −CH2− of arginine; i, k: −CH3− and −CH− of valine; g, h: −CH2− of proline; j: −CH2− of lysine; l: Tertiary carbon in LA-CLss; m: −CH2− near the guanidine group in arginine |
|
|
表 1 不同交联度LA-CLss的合成条件及相对分子质量 Tab 1 Synthesis conditions and relative molecular mass of LA-CLss at different cross-linked degrees |
2.2 不同交联度条件下不同N/P值纳米复合物的粒径与zeta电位
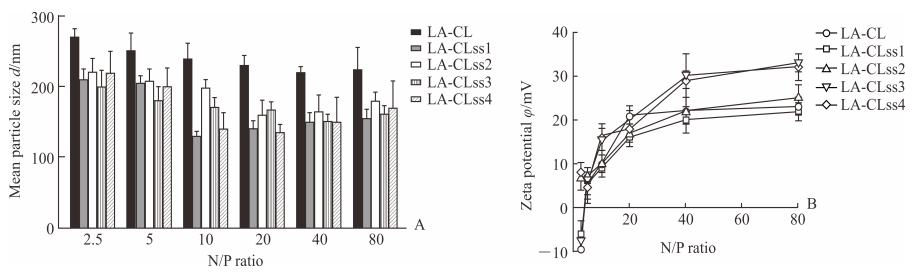
交联度不同的纳米复合物的粒径随着N/P值的增大而降低,交联之后的纳米复合物的粒径明显小于未交联的纳米复合物;当N/P值大于10时,纳米复合物LA-CLss1~3/pEGFP的粒径都在200 nm以内(图 3A)。不同交联度纳米复合物的zeta电位均随着N/P值的增大而增加(图 3B),当N/P值为40和80时,LA-CLss3/pEGFP和LA-CLss4/pEGFP的zeta电位在30 mV左右。
|
图 3 不同N/P值LA-CLss/pEGFP纳米复合物的粒径(A)和zeta电位(B) Fig 3 The particle size (A) and zeta potential (B) of LA-CLss/pEGFP nanocomplexes at different N/P ratios LA-CLss: Disulfide cross-linked lipoic acid modified cytosol-localizing internalization peptide 6; pEGFP: Plasmid enhanced green fluorescent protein; N/P: The ratio of nitrogen to phosphorus.n=3, x±s |
2.3 琼脂糖凝胶电泳
当N/P值为0~3时pEGFP不能被LA-CLss3有效地压缩包裹,电场作用下可观察到清晰的条带;而当N/P值为4时未见明显的条带,表明此时pEGFP被LA-CLss3有效地包载(图 4A)。耐肝素竞争置换实验也表明,LA-CLss3可有效保护pEGFP不被肝素置换,当肝素浓度达50 μg/mL时才有清晰条带出现(图 4B)。

|
图 4 不同N/P值时LA-CLss 3/pEGFP纳米复合物(A)和耐肝素竞争置换(B)的电泳图 Fig 4 Electrophoresis diagram LA-CLss 3/pEGFP nanocomplexes at different N/P ratios (A) and protection of LA-CLss3 to pEGFP against pEGFP heparin (B) N/P: The ratio of nitrogen to phosphorus; LA-CLss: Disulfide cross-linked lipoic acid modified cytosol-localizing internalization peptide 6; bPEI: Branched polythyleneimine; pEGFP: Plasmid enhanced green fluorescent protein |
2.4 临界胶束浓度的测定
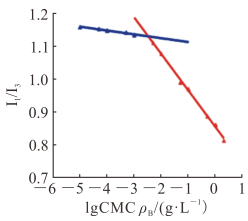
荧光光谱如图 5所示,可以看出I1/I3值随LA-CLss3浓度的变化有突变点,突变点处的聚合物浓度为3.27 mg/L,可以确定LA-CLss3的临界胶束浓度为3.27 mg/L,该胶束具有较强的抗血液稀释能力。
|
图 5 芘荧光探针光谱法测定LA-CLss3的CMC Fig 5 CMC values of LA-CLss3 evaluated by pyrene fluorescence spectroscopy LA-CLss: Disulfide cross-linked lipoic acid modified cytosol-localizing internalization peptide 6; CMC: Critical micelle concentration; I1/I3: The ratio of fluorescence intensity in the wavelength of 373 nm to 383 nm |
2.5 载药量和包封率
计算得LA-CLss/DTX胶束的载药量为(8.81±0.02)%,包封率为(85.25±0.04)%。
2.6 LA-CLss/pEGFP纳米复合物的细胞摄取能力如图 6所示,随着N/P值的增加,HEK293细胞对LA-CLss3/pEGFP的摄取逐渐增加,在N/P值为40和80时,平均荧光强度分别约为N/P=10时的1.98和1.21倍,为N/P=20时的1.60和1.73倍(P均<0.05);摄取的阳性细胞比例均达80%左右,高于N/P=20的阳性细胞比例(P均<0.05)。
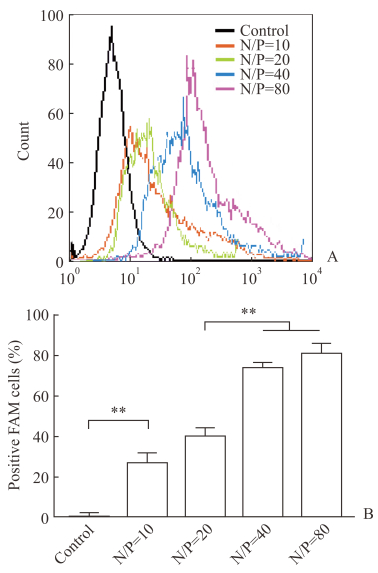
|
图 6 HEK293细胞对LA-CLss/pEGFP纳米复合物的摄取情况 Fig 6 Cellular uptake of LA-CLss/pEGFP nanocomplex by HEK293 cells A: Flow cytometry figure; B: The percentage of positive FAM cells at different N/P ratios.LA-CLss: Disulfide cross-linked lipoic acid modified cytosol-localizing internalization peptide 6; FAM-siRNA: Fluorescein labeled small interfering RNA; N/P: The ratio of nitrogen to phosphorus.**P < 0.01.n=3, x±s |
2.7 LA-CLss/pEGFP纳米复合物的基因转染情况
由图 7可见,随着交联度的增加,LA-CLss/pEGFP纳米复合物作用细胞的荧光强度逐渐增强,LA-CLss3/pEGFP组在N/P=40时荧光细胞的荧光强度比其他组强,且荧光强度与bPEI-25k相近。考虑到N/P值越大载体的毒性会相应增大,由此筛选出交联度为10%的LA-CLss3(N/P=40)为后续实验所用。
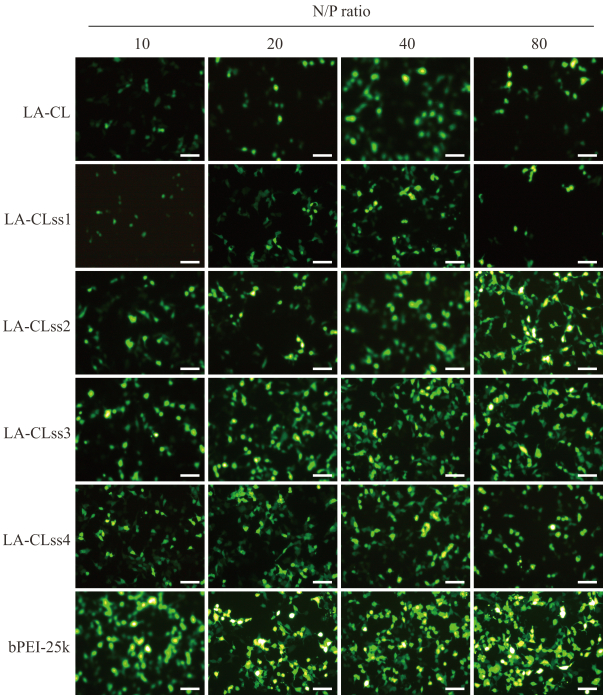
|
图 7 不同N/P值时LA-CLss/pEGFP纳米复合物的体外基因转染效率 Fig 7 In vitro transfection efficacy of LA-CLss/pEGFP nanocomplexes at different N/P ratios N/P: The ratio of nitrogen to phosphorus; LA-CLss: Disulfide cross-linked lipoic acid modified cytosol-localizing internalization peptide 6; pEGFP: Plasmid enhanced green fluorescent protein; bPEI: Branched polythyleneimine.Scale bar=250 μm |
2.8 体外释放
如图 8所示,48 h后LA-CLss/DTX在含有DTT的环境下释放接近80%的DTX,而在不含有DTT的环境下仅仅释放60%左右,显示了LA-CLss/DTX胶束具有还原性敏感,可以在DTT模拟的肿瘤细胞内的还原性条件下释放化学治疗药DTX。
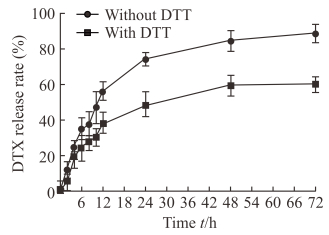
|
图 8 LA-CLss/DTX体外释放曲线 Fig 8 In vitro release curve of LA-CLss/DTX LA-CLss: Disulfide cross-linked lipoic acid modified cytosol-localizing internalization peptide 6; DTX: Docetaxel; DTT: Dithiothreitol.n=3, x±s |
3 讨论
非病毒基因载体自身对机体无免疫原性,在保持高转染效率的同时也可以保护基因药物免受核酸酶的破坏和降解,还能克服组织屏障使细胞摄取效果良好,利于将DNA导入到细胞内,是一种较理想的基因递送载体。在前期研究基础上,本研究设计合成了一种高效的基因载体,由LA修饰的非内吞机制进入细胞质定位的内化肽LA-CL,形成共载化学治疗药和基因的纳米胶束载体。本研究通过粒径、zeta电位对不同交联度的载体与pEGFP形成的纳米复合物的表征进行筛选,主要是通过转染实验对载体进行筛选,综合结果表明,在半胱氨酸比例为10.0%(LA-CLss3)且N/P=40时形成的纳米复合物的粒径为150 nm左右,zeta电位在30 mV左右,且转染效率最高,细胞摄取实验结果也得到了一致的结论。其中LA-CLss3/pEGFP纳米复合物在N/P=40时转染的效果接近于bPEI-25k在N/P=10时的荧光素酶表达,可能是由于LA五元环增加了载体/基因复合物与细胞膜的亲和力,同时二硫键在细胞内GSH还原性条件下断裂释放基因药物,从而达到有效运输和高效释放的目的[10]。交联之后的纳米复合物粒径变小,可能是交联后LA五元环形成的亲脂性内核结构更加紧密所致。琼脂糖凝胶电泳实验结果表明,在N/P≥4时LA-CLss3成功压缩包裹基因,且N/P=10时纳米复合物的耐肝素竞争置换实验结果也表明该载体具有较好的耐肝素竞争性质。体外释放结果表明,该多肽载体具有还原性条件敏感行为,为抗肿瘤药物在肿瘤微环境中释放提供了条件。
综上所述,LA修饰的固有无序多肽有望成为一种理想的共载基因和化学治疗药的载体,用于联合化学治疗药和基因药物协同抗肿瘤。后期将用LA-CLss3作为共载化学治疗药和基因药物的共载体系,进一步开展体外细胞学评价以及体内药效、体内靶向性等研究。
| [1] | KOMAROVA N L, BOLAND C R. Cancer:calculated treatment[J]. Nature, 2013, 499: 291–292. DOI: 10.1038/499291a |
| [2] | SHIM M S, KWON Y J. Efficient and targeted delivery of siRNA in vivo[J]. Febs J, 2010, 277: 4814–4827. DOI: 10.1111/j.1742-4658.2010.07904.x |
| [3] | THEILLET F X, BINOLFI A, FREMBGEN-KESNER T, HINGORANI K, SARKAR M, KYNE C, et al. Physicochemical properties of cells and their effects on intrinsically disordered proteins (IDPs)[J]. Chem Rev, 2014, 114: 6661–6714. DOI: 10.1021/cr400695p |
| [4] | MEDINA S H, MILLER S E, KEIM A I, GORKA A P, SCHNERMANN M J, SCHNEIDER J P. An intinsically disordered peptide facilitates non-endosomal cell entry[J]. Angew Chem Int Ed Engl, 2016, 55: 3369–3372. DOI: 10.1002/anie.201510518 |
| [5] | CHEN W, ZHONG P, MENG F, CHENG R, DENG C, FEIJEN J, et al. Redox and pH-responsive degradable micelles for dually activated intracellular anticancer drug release[J]. J Control Release, 2013, 169: 171–179. DOI: 10.1016/j.jconrel.2013.01.001 |
| [6] | YAO C, LIU J, WU X, TAI Z, GAO Y, ZHU Q, et al. Reducible self-assembling cationic polypeptide-based micelles mediate co-delivery of doxorubicin and microRNA-34a for androgen-independent prostate cancer therapy[J]. J Control Release, 2016, 232: 203–214. DOI: 10.1016/j.jconrel.2016.04.034 |
| [7] | HU C, GU F, TAI Z, YAO C, GONG C, XIA Q, et al. Synergistic effect of reduced polypeptide micelle for co-delivery of doxorubicin and TRAIL against drug-resistance in breast cancer[J]. Oncotarget, 2016, 7: 61832–61844. |
| [8] | TUDOSE M, CULITA D C, MUSUC A M, SOMACESCU S, GHICA C, CHIFIRIUC M C, et al. Lipoic acid functionalized SiO2@Ag nanoparticles.Synthesis, characterization and evaluation of biological activity[J]. Mater Sci Eng C Mater Biol Appl, 2017, 79: 499–506. |
| [9] | WEI R, CHENG L, ZHENG M, CHENG R, MENG F, DENG C, et al. Reduction-responsive disassemblable core-cross-linked micelles based on poly(ethylene glycol)-b-poly(N-2-hydroxypropyl methacrylamide)-lipoic acid conjugates for triggered intracellular anticancer drug release[J]. Biomacromolecules, 2012, 13: 2429–2438. DOI: 10.1021/bm3006819 |
| [10] | MIYATA K, KAKIZAWA Y, NISHIYAMA N, HARADA A, YAMASAKI Y, KOYAMA H, et al. Block catiomer polyplexes with regulated densities of charge and disulfide cross-linking directed to enhance gene expression[J]. J Am Chem Soc, 2004, 126: 2355–2361. DOI: 10.1021/ja0379666 |
 2018, Vol. 39
2018, Vol. 39


