2. 第二军医大学长海医院药学部, 上海 200433
2. Department of Pharmacy, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
溃疡性结肠炎(ulcerative colitis,UC)是一种以反复发作腹痛、腹泻,肠黏膜炎症和溃疡为病理特点的肠道非特异性炎性疾病[1]。其发病机制尚不明确,有研究发现UC的发生与氧、一氧化碳自由基以及肠道炎性介质的释放有关[2]。至今还没有治疗UC的特异性药物和方法,因此开发高效、低毒的抗UC药物成为临床迫切需求[3]。临床上UC活动期以湿热蕴结肠道、兼有脾虚为门辨证要点[4]。第二军医大学长征医院中医科岳小强教授自拟白术黄连方,其中白术健脾止泻、黄连燥湿止泻、乌梅涩肠止泻、防风祛风胜湿,可治肠风下血。乌梅合黄连为连梅丸,本是治疗“噤口痢”之主方,又有“乌梅丸,又主久利”之意,并且乌梅入血成分宗“行血则便脓自愈”之旨。4味药合用正合UC脾虚、湿热蕴结大肠、腹痛、腹泻之病机,该方在临床上取得了良好疗效。本实验观察白术黄连方对UC大鼠一般情况、溃疡的作用,及其对一氧化氮(nitric oxide,NO)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、髓过氧化物酶(myeloperoxidase,MPO)、白细胞介素6(interleukin 6,IL-6)水平的影响,探讨白术黄连方对UC的治疗作用。
1 材料和方法 1.1 实验动物SPF级SD大鼠74只,雌雄各半,体质量为180~200 g;由第二军医大学实验动物中心提供[实验动物生产许可证号:SCXK(沪)2013-0016]。
1.2 药品、试剂与仪器白术黄连方(白术30 g、黄连15 g、乌梅15 g、防风12 g)由第二军医大学长海医院药剂室提供,制备方法:取白术加10倍水提取6 h,收集挥发油;另取黄连、防风、乌梅加8倍水,提取2次,第1次1.5 h,第2次1 h,合并2次提取液浓缩至1:1;合并挥发油与提取液制得。柳氮磺胺吡啶、三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS)、戊巴比妥钠、羧甲基纤维素钠(CMC-Na)均购自美国Sigma公司。无水乙醇、多聚甲醛、生理盐水购自上海圆创生物科技有限公司。NO试剂盒、iNOS试剂盒、MPO试剂盒、IL-6试剂盒均购自上海瑶韵科技生物有限公司。DV215CD型电子天平购自美国OHAUS公司;Multifuge X1型低温超速离心机购自美国Heraeus公司;CKX41SF型光学显微镜购自日本Olympus公司;CYTATION3型酶标仪购自美国Bio-Tek公司;ULT2586-4-V型超低温冰箱购自美国Revco公司;VS-25S型高速组织匀浆仪购自无锡沃信仪器制造有限公司。
1.3 大鼠UC模型的制备采用TNBS灌肠法制作大鼠UC模型[5]。取SD大鼠,造模前禁食48 h。所有大鼠均用10%戊巴比妥钠腹腔注射麻醉(40 mg/kg),深度麻醉后将大鼠倒挂,将制备的橡胶管(长12 cm,并在8 cm处用马克笔标记)用甘油润滑后,轻轻插入大鼠肛门约8 cm。使用TNBS和无水乙醇(体积比1:1)混合制备造模剂,通过橡胶管注入大鼠肛门(4 mL/kg)。正常对照组灌注相等剂量生理盐水。拔出橡胶管后用塑料夹夹住大鼠肛门。释放大鼠归笼,保持平躺,并盖以毛巾,防止大鼠感冒。2 h后解除塑料夹,大鼠清醒后常规饲养。
1.4 动物分组与给药随机将大鼠分为模型组14只,白术黄连方低、中、高剂量组和正常对照组、柳氮磺胺吡啶组各12只,雌雄各半。模型组和柳氮磺胺吡啶组在造模第2天均有1只大鼠死亡,可能是由于造模时操作不慎导致肠道穿孔。最终模型组大鼠13只,柳氮磺胺吡啶组11只,其余各组每组12只。白术黄连方低、中、高剂量组大鼠分别以人用药量等效剂量的1、2、4倍给灌胃给药,即白术黄连方低、中、高剂量组给药量分别为6.895、13.790、27.580 g/kg,上、下午各给药1次,每次2 mL。正常对照组和模型组均给予等量生理盐水,柳氮磺胺吡啶组给予柳氮磺胺吡啶混悬液(柳氮磺胺吡啶加入羧甲基纤维素钠中制备而成)0.2 g/kg灌胃给药,上、下午各1次。从造模后第2天开始给药,连续10 d,同时常规饲养大鼠。
1.5 大鼠一般情况与评分标准记录造模前及造模后第2、4、6、8、10天大鼠的体质量和大便性状评分;给药结束后处死大鼠,取肛门以上和盲肠以下肠段,测量大肠长度;剪开观察肠内部病变情况,记录大鼠结肠黏膜损伤指数(colon mucosal injury index,CMDI)。截取自肛门起8~10 cm肠段,用4%多聚甲醛固定后行H-E染色,进行病理评分。粪便性状评分标准[6]:正常成形颗粒样粪便0分;正常偏软粪便1分;松软粪便,不黏附于肛门的糊状、半成形粪便2分;稀便,可黏附于肛门的稀水样便3分;水样便4分。CMDI评分标准[7]:(1)无粘连为0分,结肠与其他组织剥离较易为1分,中度粘连为2分。(2)无炎症和溃疡形成为0分,局部充血、无溃疡为1分,1处溃疡不伴充血或肠壁增厚为2分,1处溃疡伴炎症为3分,≥2处溃疡伴炎症为4分,≥2处溃疡和(或)炎症>1 cm为5分;溃疡和(或)炎症>2 cm,病变范围每增加1 cm计分加1分,计6~8分。2项评分相加即为其CMDI评分。结肠病理评分标准[8]:(1)受累区域百分比正常为0分,<10%为1分,10%为2分,>10%且≤50%为3分,>50%为4分;(2)无滤泡聚集数为0分,轻度为1分,中度为2分,重度为3分;(3)无水肿为0分,轻度为1分,中度为2分,重度为3分;(4)上皮完整为0分,固有层受累为1分,溃疡累及黏膜下层为2分,溃疡透壁为3分;(5)隐窝丢失正常为0分,<10%为1分,10%为2分,>10%且≤50%为3分,>50%为4分;(6)无单核、多核细胞浸润为0分,轻度为1分,中度为2分,重度为3分。6项评分相加即为结肠病理总评分。
1.6 ELISA法检测结肠组织NO、iNOS、MPO、IL-6水平取湿质量0.2~1.0 g的结肠组织,用2~5 mL冰冷的生理盐水漂洗除去血液;滤纸拭干,称质量,放入5~10 mL小烧杯内,然后用移液管量取预冷的0.86%的生理盐水,体积总量为组织块质量的9倍;将组织块碾碎匀浆,2 000×g离心10 min,取上清液按照ELISA试剂盒说明书操作检测NO、iNOS、MPO、IL-6水平。
1.7 统计学处理用SPSS 21.0软件进行数据处理,呈正态分布的计量资料以x±s表示,组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 各组大鼠一般情况正常对照组大鼠反应灵活,毛色光润,喜活动,主动觅食,大便呈小球状。模型组大鼠精神萎靡,进食、活动都明显减少,体质量下降;白术黄连方高剂量组和柳氮磺胺吡啶组大鼠于治疗4~6 d后稀便基本消失,腹泻、黏液便等症状均改善,食量增加,活动明显增多,精神状态好转,体质量开始增加;白术黄连方低、中剂量组大鼠在治疗4~6 d后相比模型组也出现好转,仍存在稀便黏液便,与白术黄连方高剂量组和柳氮磺胺吡啶组大鼠相比精神状态仍较差、饮食少、体质量也下降。由图 1可见,从给药后第4天开始,模型组大鼠体质量低于正常对照组(P<0.05),而白术黄连方低、中、高剂量组和柳氮磺胺吡啶组大鼠体质量均高于模型组(P均<0.05)。白术黄连方高剂量组和柳氮磺胺吡啶组大鼠大便性状评分低于模型组和白术黄连方低、中剂量组,但差异均无统计学意义。
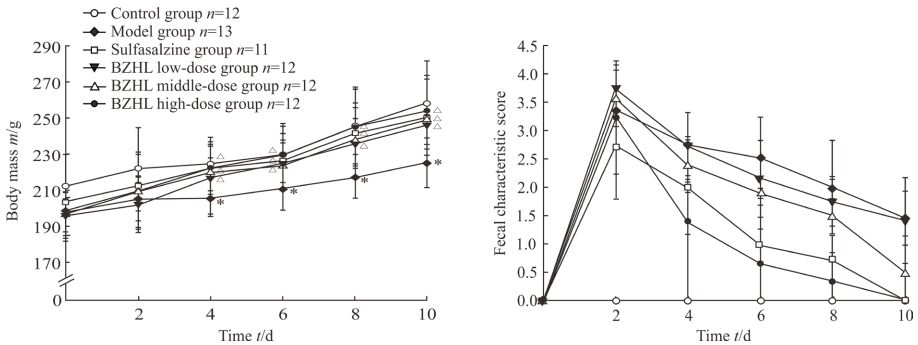
|
图 1 各组大鼠体质量和大便性状评分 Fig 1 Body mass and fecal characteristics score of rats in each group BZHL low-dose group: 6.895 g/kg BZHL; BZHL middle-dose group: 13.790 g/kg BZHL; BZHL high-dose group: 27.580 g/kg BZHL; Sulfasalazine group: 0.2 g/kg sulfasalazine. BZHL: Baizhu Huanglian Decoction. *P < 0.05 vs control group; △P < 0.05 vs model group. x±s |
2.2 各组大鼠结直肠组织病理学比较 2.2.1 结直肠病变情况
正常对照组大鼠结肠黏膜光滑,纹理清晰,未见充血、水肿。模型组大鼠肠管增粗,肠壁增厚,黏膜可见多个溃疡,溃疡旁黏膜充血、水肿明显,与周围组织粘连形成瘢痕。白术黄连方高剂量组和柳氮磺胺吡啶大鼠比模型组好转,但仍有溃疡。白术黄连方低、中剂量中药组大鼠可见溃疡存在,且溃疡旁黏膜充血仍可见,与模型组相比溃疡减轻,但程度重于白术黄连方高剂量组和模型组。
2.2.2 结直肠长度与病理、CMDI评分模型组大鼠结直肠长度短于正常对照组(P<0.01),而白术黄连方中、高剂量组和柳氮磺胺吡啶组大鼠结直肠长度均长于模型组(P均<0.05)。与正常对照组相比,模型组大鼠结肠病理评分、CMDI评分均增高(P均<0.01);而与模型组相比,柳氮磺胺吡啶组和白术黄连方低、中、高剂量组大鼠结肠病理评分均降低(P均<0.05),且柳氮磺胺吡啶组和白术黄连方高剂量组大鼠CMDI评分均降低(P均<0.05);白术黄连方低、中剂量组大鼠CMDI评分也降低,但与模型组相比差异均无统计学意义。见表 1。
|
|
表 1 各组大鼠结直肠长度、病理评分、CMDI评分比较 Tab 1 Colorectal length, pathological score and CMDI score of rats in each group |
2.3 各组大鼠结肠组织NO、iNOS、MPO、IL-6水平
与正常对照组相比,模型组大鼠结肠组织NO、iNOS、MPO、IL-6水平均增高(P均<0.01)。而与模型组相比,柳氮磺胺吡啶组和白术黄连方低、中、高剂量组大鼠结肠组织中NO、iNOS、MPO、IL-6水平均降低(P均<0.05)。见表 2。
|
|
表 2 各组大鼠结肠组织NO、iNOS、MPO、IL-6水平 Tab 2 Levels of NO, iNOS, MPO and IL-6 in colon tissue of rats in each group |
3 讨论
TNBS加无水乙醇诱导大鼠UC模型是一种相对成熟的造模方法[9]。在造模过程中仍有几点注意事项,否则易导致造模失败:(1)造模前禁食足够长时间,若禁食时间过短,大鼠肠内还留有颗粒状粪便,在造模时橡胶管插入受阻,易造成大鼠结肠损伤。本实验造模前禁食48 h,大鼠可以排空肠道内粪便,利于插管造模,也防止了麻醉后肠梗阻;(2)造模过程中会出现造模液外溢导致造模液注入量不足,从而使造模失败。本实验采用大鼠倒挂的方式造模,并且在缓慢拔出橡胶管后用塑料夹夹闭大鼠肛门,可有效防止造模液外漏。
MPO为中性粒细胞等分泌的含血红素辅基的血红素蛋白酶,其活性是评价中性粒细胞组织浸润程度的可靠指标[10]。IL-6主要由活化的巨噬细胞、淋巴细胞和上皮细胞分泌,其在急性炎性反应中对多种细胞具有促炎作用,并能诱导肝组织产生急性反应蛋白[11],故活动期UC IL-6水平显著上升。而曾有研究表明UC的发生与iNOS及其诱导产生的NO相关[12]。生理剂量的NO对消化系统有保护作用,但NO产生过多或胃肠道平滑肌对其敏感性增强可导致UC[13]。NF-κB、γ干扰素(interferon-γ,IFN-γ)、IL-6、IL-8等细胞因子能刺激炎性细胞iNOS表达上调产生大量NO,参与炎性反应[14]。NOS是NO合成的限速酶,检测此酶可间接反映NO水平,iNOS主要通过生成NO发挥其生物学作用[15]。
本研究结果显示TNBS加无水乙醇法诱导的UC大鼠远端结肠出现明显炎性反应,同时结肠组织中NO、iNOS、MPO、IL-6水平较正常大鼠升高,证实了iNOS及其催化产生的NO与UC发病密切相关,而MPO、IL-6是UC发病中高度表达的致炎因子且其表达程度与炎性程度呈正相关。柳氮磺胺吡啶属口服不易吸收的磺胺药,大部分药物进入远端小肠和结肠,在肠微生物作用下分解成5-氨基水杨酸和磺胺吡啶。5-氨基水杨酸与肠壁结缔组织络合后较长时间停留在肠壁组织中,起到抗菌消炎和免疫抑制作用[16]。而白术黄连方可能是通过抑制iNOS的表达、减少NO的分泌减轻炎性程度,并且有效抑制结肠黏膜释放一系列损伤因子以及白细胞产生各种炎性介质,从而抑制炎症介导的肠黏膜屏障损伤,保护肠黏膜上皮细胞[17]。相比柳氮磺胺吡啶,中药治疗可以长期维持缓解和降低复发率,且不良反应少;另外中药治疗UC的适用人群更广泛,临床上对水杨酸类制剂和免疫抑制剂治疗无效者仍可选用中药治疗[18]。
本实验研究的不足之处在于虽然白术黄连方中4味药物均有抗炎作用,但中药复方是一个复杂的整体,其药效更多的是多成分共同作用的结果。因此,还需要通过实验进一步探究白术黄连方中的具体有效成分。此外,本实验结果显示白术黄连方治疗UC可能与iNOS及其释放的NO相关,并且可通过降低IL-6、MPO水平减轻炎性程度、促进肠道的修复,但具体机制尚有待进一步研究。
| [1] | 王爽, 潘丹烨, 甘爱莲. 中医治疗溃疡性结肠炎研究概况[J]. 实用中医学杂志, 2017, 33: 1225–1227. |
| [2] | ALEXANDERC F, PAULM, STEVENB H, JOSEPHB K, 谭蓓, 吴东. 溃疡性结肠炎[J]. 英国医学杂志:中文版, 2017, 20: 387–392. |
| [3] | 郭瑞敏, 荀哲, 范正松, 牛亚玲, 李雁春. 2, 4, 6-三硝基苯磺酸诱导不同鼠种急性溃疡性结肠炎的比较[J]. 中国医科大学学报, 2016, 45: 787–792. DOI: 10.12007/j.issn.0258-4646.2016.09.005 |
| [4] | 刘明坤, 王博文, 陶夏平. 辨治溃疡性结肠炎经验浅析[J]. 中华中医药杂志, 2016, 31: 4081–4083. |
| [5] | 陈锦团, 柯晓, 骆云丰, 张歆, 高尤良, 方文怡, 等. 溃疡性结肠炎造模中化学诱导剂的优化[J]. 福建中医药, 2015, 46: 33–34. |
| [6] | 贺海辉, 沈洪, 朱宣宣, 顾培青, 刘亚军, 朱磊, 等. 2, 4, 6-三硝基苯磺酸/乙醇法诱导建立溃疡性结肠炎大鼠模型[J]. 中国老年学杂志, 2015, 35: 4138–4140. DOI: 10.3969/j.issn.1005-9202.2015.15.012 |
| [7] | 赵承满, 孟立娜, 陈锦龙, 陈方明. 乌司他丁对溃疡性结肠炎大鼠结肠炎症及TLR4/NF-κB信号通路的影响[J]. 中国现代应用药学, 2017, 34: 347–351. |
| [8] | 周莉, 刘刚, 熊国卫, 宋泽汎, 王增增, 王玖. 芍药汤加减联合艾灸对溃疡性结肠炎患者结肠黏膜修复的影响[J]. 中国处方药, 2017, 15: 93–94. |
| [9] | 李进. 不同给药途径对鼠的溃疡性结肠炎模型的疗效比较及其机制研究[D]. 武汉: 华中科技大学, 2011. |
| [10] | 梁晗业, 徐志立, 陶小军, 肖洪贺, 胡丽萍. 五味子甲素对小鼠溃疡性结肠炎的治疗作用[J]. 中药药理与临床, 2017, 33: 38–42. |
| [11] | 王彤, 王骁, 范焕芳, 郭娜, 武金芳, 许亚培. 白头翁汤对溃疡性结肠炎模型小鼠结肠黏膜及血清TNF-α、IL-6影响[J]. 辽宁中医药大学学报, 2017, 19: 32–35. |
| [12] | 吴岚, 张苏闽, 汪义军. 溃疡性结肠炎肠黏膜iNOS mRNA表达的检测(附92例溃疡性结肠炎肠镜资料分析)[J]. 河北医学, 2003, 9: 1011–1013. DOI: 10.3969/j.issn.1006-6233.2003.11.026 |
| [13] | 范精华, 刘康, 刘保林. NO在炎症及免疫应答中的调节作用[J]. 中外医疗, 2009, 28: 163, 166. |
| [14] | 康静静, 姚华伟, 梁宏德, 杨玉荣. 细胞因子在炎症性肠病中的作用[J]. 中国细胞生物学学报, 2011, 33: 204–209. |
| [15] | 宋翠荣, 庞胤, 陈俊荣. 诱导性一氧化氮合酶的临床意义[J]. 中国医药导刊, 2010, 20: 1022–1023. DOI: 10.3969/j.issn.1009-0959.2010.06.061 |
| [16] | 杨晓平, 杜位良. 溃疡性结肠炎的药物治疗进展[J]. 西南军医, 2015, 17: 56–59. DOI: 10.3969/j.issn.1672-7193.2015.01.025 |
| [17] | 关丽华, 龚玉芳, 张弘, 商亚珍. 结肠康对恶唑酮诱导小鼠溃疡性结肠炎MPO、NO、iNOS的影响[J]. 中成药, 2013, 35: 669–673. DOI: 10.3969/j.issn.1001-1528.2013.04.007 |
| [18] | 王新月, 王建云. 溃疡性结肠炎中医药治疗的关键问题与优势对策[J]. 中华中医药杂志, 2012, 27: 263–267. |
 2018, Vol. 39
2018, Vol. 39


